文章信息
- 丘云, 赵琦, 王娜, 崔淑衡, 郁雨婷, 姜永根, 赵根明.
- Qiu Yun, Zhao Qi, Wang Na, Cui Shuheng, Yu Yuting, Jiang Yonggen, Zhao Genming
- 上海市松江区成年人高尿酸血症与慢性肾病关系的队列研究
- Association of hyperuricemia with risk of incident chronic kidney disease in adult in Songjiang district, Shanghai: a follow-up study
- 中华流行病学杂志, 2021, 42(9): 1607-1614
- Chinese Journal of Epidemiology, 2021, 42(9): 1607-1614
- http://dx.doi.org/10.3760/cma.j.cn112338-20200719-00957
-
文章历史
收稿日期: 2020-07-19
2. 上海市松江区疾病预防控制中心 201600
2. Songjiang District Center for Disease Control and Prevention, Shanghai 201600, China
慢性肾病(chronic kidney disease,CKD)以改变肾脏的功能和结构为特征,与很多慢性疾病的发生发展密切相关[1-2]。2017年全球CKD的患病率为9.1%,约120万人死于CKD,导致每100万人伤残调整寿命年为35.8年[3]。在中国,2017年CKD的患者高达1.3亿人,死亡人数估计为176万人[3]。由此可见,CKD造成的疾病负担十分严重,已成为一个备受全球关注的公共卫生问题。CKD的发病受多方面因素的影响,发病机制尚未完全阐明。
尿酸是在人体肝脏中形成的嘌呤的终端代谢产物,主要通过尿液排泄。血尿酸(SUA)具有促氧化和抗氧化的双重特性[4-5]。近年来,伴随人们生活方式和饮食习惯的改变,我国高尿酸血症(hyperuricemia,HUA)的患病率逐年升高[6]。国内外多数研究表明,HUA与肾功能下降和CKD呈正关联[7-12],但也有研究得出不一致的结论[13]。既往国内的研究大多为横断面设计,或前瞻性研究的样本量较小,且缺乏分析HUA和相关因素交互作用的报道。
本研究基于社区人群的前瞻性队列,分析基线HUA是否与CKD的发病风险增加相关,探讨HUA和相关因素在CKD发病风险分析中是否存在交互作用。
对象与方法1. 研究对象:来自华东区域自然人群队列的上海市松江区自然人群队列。该队列建于2016年4月至2017年12月,队列现场分别来自上海市松江区新桥、佘山、泖港镇整群随机抽取的1/3居委会或行政村。共收集30 494人20~74岁的上海市居民或在上海市居住满5年个体的数据,其中有完整问卷、体格检查或实验室检查数据的人数为29 522人。在2019年4-9月,进行第一次面对面随访,并对约1/3的调查对象开展问卷调查、体格检查和血清肌酐(serum creatinine,Scr)等指标的检测,完成随访的人数为9 222人,随访率为31.24%。剔除缺少基线SUA或Scr数据的对象,以及满足以下标准者:①未签署此次知情同意书或拒绝参与;②怀孕的女性;③基线患CKD的个体;④既往患有重大的慢性疾病:如中风、肝硬化、心肺衰竭、甲状腺亢进或减退等;⑤既往或者目前患有癌症;⑥既往有肾脏器官移植或者肾透析病史。最终纳入7 276人。研究方案获得复旦大学公共卫生学院医学研究伦理委员会伦理学批准,所有研究对象均签署知情同意书。
2. 问卷调查和体格检查:基线调查时,采用统一设计的结构式调查表,由经过培训的调查员,于研究对象所属社区卫生服务中心进行面对面调查。收集研究对象的基本信息,包括人口学信息(年龄、性别、婚姻状况、文化程度、退休情况)、自报的慢性病疾病史(如高血压、2型糖尿病、慢性肾病、癌症等)和生活行为习惯(吸烟、饮酒、体力活动)等。
体格检查包括身高、体重和腰围,取2次测量的平均值。根据体重(kg)和身高(m2)计算BMI。血压包括SBP和DBP,取3次测量的平均值。
3. 实验室检查:采集空腹静脉血样前,所有的研究对象需禁食8 h以上。实验室使用自动生化分析仪(Roche Cobas C501)检测血清TG、TC、HDL-C、LDL-C。FPG使用己糖激酶法检测(Roche P800)。Scr和SUA使用Roche C702自动生化分析仪器检测。糖化血红蛋白使用高压液相色谱法进行检测(TOSOH G8)。同时采集所有研究对象的当日晨尿,尿微量白蛋白和尿肌酐使用Roche Cobas C501进行检测。
4. 诊断标准:CKD患者诊断参照美国肾脏基金会慢性肾脏病实践指南的标准:估算肾小球滤过率(estimated glomerular filtration rate,eGFR) < 60 ml·min-1·1.73 m-2;或尿微量白蛋白与尿肌酐比值(ACR,即蛋白尿)≥30 mg/g;或基于医学记录新发诊断为CKD者[1]。eGFR则根据适用于中国人群的Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI)公式计算[14]。依照国内专家共识,HUA定义为SUA > 420 μmol/L(男性)或 > 360 μmol/L(女性)[15]。2型糖尿病定义为FPG≥7.0 mmol/L或糖化血红蛋白(HbA1c)≥6.5%,或既往有2型糖尿病病史[16]。高血压定义为SBP≥140 mmHg(1 mmHg=0.133 kPa)和(或)DBP≥90 mmHg,或既往有高血压病史[17]。
5. 统计学分析:应用统计软件SAS 9.4版本(Institute Inc.,Cary,NC,USA)进行数据统计分析。连续变量正态分布资料以x±s表示,非正态分布则以M(P25,P75)表示;组间比较采用独立样本t检验或曼-惠特尼U检验。分类变量以人数和构成比表示,组间比较采用χ2检验。
首先应用多因素Cox回归的限制性立方样条分析连续变量SUA与CKD发病风险之间的剂量-反应关系,然后使用Cox比例风险模型分析HUA与CKD发病风险之间的关联。纳入校正的混杂因素包括基线年龄、性别、婚姻状况、文化程度、退休情况、吸烟、饮酒、体力活动、BMI、HDL-C、LDL-C、TC、TG、高血压、2型糖尿病和eGFR。将可能影响HUA与CKD发病风险之间关系的因素进行分层分析,分层因素包括性别、年龄(< 60,≥60岁)、BMI(< 25.0,≥25.0 kg/m2)、2型糖尿病和高血压。应用相加交互作用模型评估HUA和分层危险因素与CKD发病风险之间的交互作用。具体分析采用Rothman和Hosmer提出的相加交互指标,即相对超额危险度(relative excess risk due to interaction,RERI)、归因比(attributable proportion due to interaction,AP)和交互作用指数(synergy index,SI)[18]。若RERI或AP的可信区间包含0或SI的可信区间包含1,则说明两因素间不存在相加交互作用。双侧检验,P < 0.05为差异有统计学意义。
结果1. 队列人群基本特征及CKD发病情况:本研究纳入研究对象7 276例,男性3 046人(41.86%),女性4 230人(58.14%),年龄为(56.56±10.39)岁。随访期间共发现CKD发病301例,累积发病率为4.14%。研究对象随访中位时间为2.65(2.25,3.01)年,累计随访18 799.28人年,发病密度为16.01/1 000人年(95%CI:14.20~17.82),其中男、女性发病密度分别为14.94/1 000人年(95%CI:12.24~17.65)和16.77/1 000人年(95%CI:14.35~19.20)。分析发现,CKD发病者的年龄、基线Scr、BMI、腰围、血压、TC、TG、FPG、SUA水平大于非CKD对象;而eGFR和HDL-C水平则前者低于后者(均P < 0.05)。非CKD者的文化程度较高和有更多的未退休人员。此外,CKD发病者的HUA、2型糖尿病和高血压的基线患病率较高(P < 0.001)。性别、LDL-C、婚姻状况、吸烟、饮酒和体力活动在两组之间差异无统计学意义(P > 0.05,表 1)。
对随访人群和未随访人群的基线资料分析发现,eGFR、SBP、TC、TG、LDL-C、腰围、吸烟、饮酒和体力活动在两组人群间比较差异均无统计学意义(P > 0.05);两组人群的年龄、性别、BMI、DBP和SUA等指标差异有统计学意义(P < 0.05),但其差异较小;随访人群基线患有HUA、2型糖尿病和高血压的比例稍高于未随访人群,以上均提示两组人群基线基本特征的相似度较高(表 2)。
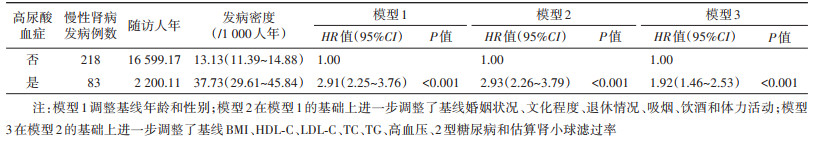
2. HUA与CKD发病风险的关联:多因素Cox回归的限制立方样条分析结果显示,非线性关系检验差异有统计学意义(P < 0.05),表明SUA与CKD发病风险存在非线性关联。当男性SUA > 350 μmol/L或女性 > 280 μmol/L时,随着SUA水平升高,CKD的发病风险呈上升趋势,见图 1。

|
| 注:模型调整基线年龄、婚姻状况、文化程度、退休情况、吸烟、饮酒、体力活动、BMI、HDL-C、LDL-C、TC、TG、高血压、2型糖尿病和估算肾小球滤过率 图 1 不同性别中血尿酸水平与慢性肾病发病风险的关联 |
Cox比例风险回归结果显示,调整了年龄、性别、婚姻状况、文化程度、退休情况、吸烟、饮酒、体力活动、BMI、HDL-C、LDL-C、TC、TG、高血压、2型糖尿病和eGFR后,与SUA正常组相比,HUA组CKD发病风险增加92%[HR值95%CI:1.92(1.46~2.53)],差异有统计学意义(表 3)。
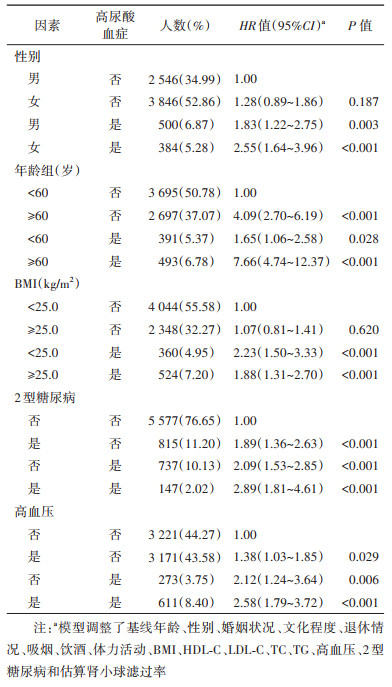
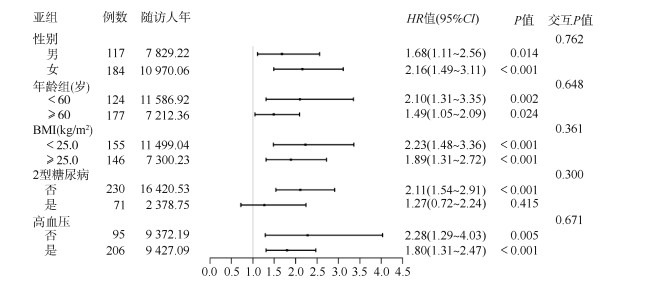
3. HUA与CKD关联的亚组及交互作用分析:将常见的可能影响HUA和CKD发病关联的相关因素分层,包括性别、年龄(< 60、≥60岁)、BMI(< 25.0、≥25.0 kg/m2)、2型糖尿病和高血压。除了在糖尿病组HUA与CKD的发病风险无统计学关联外;在其余亚组中,HUA与CKD的发病风险均呈显著正关联。在相乘模型中,性别、年龄、BMI、2型糖尿病和高血压与HUA在CKD发病风险的分析中均不存在交互作用(图 2)。
|
| 注:所有模型调整基线年龄、性别、婚姻状况、文化程度、退休情况、吸烟、饮酒、体力活动、BMI、HDL-C、LDL-C、TC、TG、高血压、2型糖尿病和估算肾小球滤过率 图 2 高尿酸血症与慢性肾病发病风险的关联在性别、年龄、BMI、2型糖尿病和高血压中的亚组分析 |
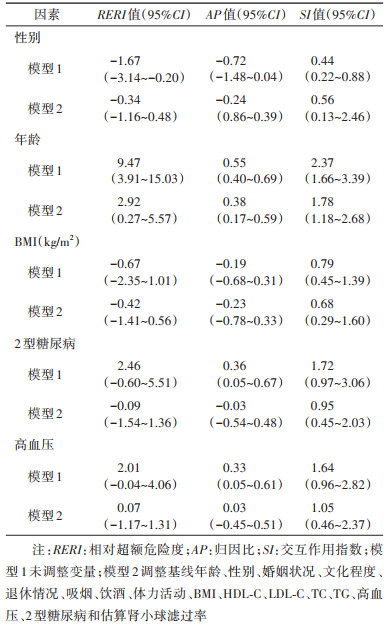
在亚组分析的基础上,我们进一步通过相加模型分析上述分层因素与HUA对CKD发病风险的交互作用。以分层因素和HUA的交叉组合为自变量,分析其与CKD发病风险的关联,发现几乎所有组分与CKD的发病风险呈显著正关联,其中CKD发病风险在年龄≥60岁和患有HUA组中最高,其HR值为7.66(95%CI:4.74~12.37),见表 4。表 5的结果显示,在调整了潜在的混杂因素后,年龄与HUA存在交互作用,RERI、AP和SI分别为2.92(95%CI:0.27~5.57)、0.38(95%CI:0.17~0.59)和1.78(95%CI:1.18~2.68)。当较高年龄和患HUA同时存在时,CKD发病的风险高于两个危险因素单独存在时之和,即两因素具有正相加交互作用。而性别、BMI、2型糖尿病和高血压与HUA在CKD发病风险的分析中均未发现相加模型的交互作用。
本研究是基于社区成年人群的队列研究,发现HUA与CKD发病风险呈显著正关联,且其关联存在于几乎所有分层分析中,提示HUA为CKD发病的危险因素。本研究还发现,较高年龄和患HUA同时存在时,CKD发病的风险高于两个危险因素单独存在时之和,存在显著的相加交互作用。
刘晓琳等[19]报道上海市浦东新区队列人群的CKD累积发病率为11.24%,发病密度为17.77/1 000人年,其中男性和女性分别为10.44/1 000人年和23.71/1 000人年。中国台湾地区一项随访5年的队列研究显示,受检者5年累计发病率为5.24%[20]。伊朗一项基于社区人群平均随访9.9年的队列研究发现,CKD粗发病率为21.8%,发病密度为21.48/1 000人年,男性和女性分别为13.26/1 000人年和28.53/1 000人年[21]。本研究显示上海市松江区社区居民CKD累积发病率为4.14%,发病密度为16.01/1 000人年,男性和女性的发病密度分别为14.94/1 000人年和16.77/1 000人年。CKD的发病水平总体与近期国内外相关报道相近,以及男性发病密度水平普遍低于女性。
HUA是一种嘌呤代谢障碍性疾病,近期多项研究表明,SUA水平升高是高血压、动脉粥样硬化、冠心病、以及非酒精性脂肪肝的危险因素[13, 22-23]。国内外多项流行病学研究表明,HUA是CKD发病或患病的独立危险因素,可以作为预测CKD发病或患病的因子[10-11]。Sedaghat等[9]在 > 55岁人群的队列研究中发现SUA与CKD的发病风险无统计学关联,但将他们的研究并入一项Meta分析发现,SUA每升高1 mg/dl,CKD发病风险增加18%(95%CI:1.15~1.22)。而Kuriyama等[13]发现SUA水平升高是高血压发病的独立危险因素,但与CKD无统计学关联。我们既往的横断面研究发现,HUA与CKD患病风险呈显著正关联[12]。与大部分研究结果一致,本研究发现,HUA是CKD发病风险的独立危险因素,且HUA与CKD正关联的关系存在于几乎所有的分层分析中。不同的研究关于HUA与CKD关系得出的结果不一致,可能的原因包括选取的研究人群不同、不同地区人口构成差别、CKD定义的标准差异等。
HUA导致CKD发病风险升高可能的机制包括,一方面尿酸结晶沉积导致肾小动脉和慢性间质炎症而损害肾脏,另外尿酸可直接使肾小球入球小动脉发生微血管病变,导致慢性肾脏疾病。另一方面,HUA可作用于并恶化CKD的其他危险因素,如高血压[9]。最后,HUA可能导致肾血管收缩、氧自由基的产生以及细胞内外的促炎反应,从而使得肾功能下降[24-25]。
目前关于HUA与相关因素的交互作用对CKD影响的研究相对缺乏。一项在中老年人群中开展的研究结果显示,在分层分析中,SUA与CKD的关联强度在高血压组较强,而在非高血压组无统计学意义;高血压与SUA在CKD发病风险的分析中存在交互作用[9]。本研究在相乘模型和相加模型中均未发现高血压和HUA与CKD发病存在交互作用,但在相加模型中,年龄和HUA与CKD发病存在正交互作用。其可能的机制是随着年龄增长,老年人的肾脏形态和功能出现改变,其肾脏储备功能也降低了,导致CKD易发生在老年群体。而年龄增长可能进一步促进HUA的发生进而导致CKD更易发病。至于具体的原因,有待今后进一步研究。
本研究的局限性在于研究对象仅选取在上海市松江区,样本的代表性以及外推性存在一定限制;此外,本研究对肾功能和蛋白尿的生化指标仅进行了单次测量,对CKD真实发病情况的估计可能存在一定偏差。因此,今后的研究应该扩大研究范围,加强随访,增加评估指标的测量次数。最后,本研究仅有31%的对象进行了随访,亦可能影响了整体结果的外推性。但我们对未随访与成功随访对象的基线特征分析发现,两组人群各项指标的差异较小,说明随访人群具有较好的代表性,结果真实性较高。
综上所述,本研究通过纵向队列研究,发现HUA为CKD发病的独立危险因素,年龄和HUA在CKD发病风险的分析中存在相加交互作用。本研究结果提示,通过定期监测社区人群SUA的水平,重视防范老年群体HUA的发生,对降低CKD的发生发展具有重要意义。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Levey AS, Coresh J, Balk E, et al. National Kidney Foundation practice guidelines for chronic kidney disease: evaluation, classification, and stratification[J]. Ann Intern Med, 2003, 139(2): 137-147. DOI:10.7326/0003-4819-139-2-200307150-00013 |
| [2] |
Nugent RA, Fathima SF, Feigl AB, et al. The burden of chronic kidney disease on developing nations: a 21st century challenge in global health[J]. Nephron Clin Pract, 2011, 118(3): c269-277. DOI:10.1159/000321382 |
| [3] |
GBD Chronic Kidney Disease Collaboration. Global, regional, and national burden of chronic kidney disease, 1990-2017:a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2020, 395(10225): 709-733. DOI:10.1016/S0140-6736(20)30045-3 |
| [4] |
Fabbrini E, Serafini M, Baric IC, et al. Effect of plasma uric acid on antioxidant capacity, oxidative stress, and insulin sensitivity in obese subjects[J]. Diabetes, 2014, 63(3): 976-981. DOI:10.2337/db13-1396 |
| [5] |
Borghi C, Tykarski A, Widecka K, et al. Expert consensus for the diagnosis and treatment of patient with hyperuricemia and high cardiovascular risk[J]. Cardiol J, 2018, 25(5): 545-564. DOI:10.5603/CJ.2018.0116 |
| [6] |
王荣, 汤哲, 孙菲, 等. 中国7城市老年人高尿酸血症患病率调查[J]. 中华流行病学杂志, 2018, 39(3): 286-288. Wang R, Tang Z, Sun F, et al. Prevalence of hyperuricemia in the elderly in 7 areas of China[J]. Chin J Epidemiol, 2018, 39(3): 286-288. DOI:10.3760/cma.j.issn.0254-6450.2018.03.007 |
| [7] |
牛敏, 高政南, 李珅, 等. 中老年妇女尿酸的变化程度对肾功能的影响——3年随访研究[J]. 中华内分泌代谢杂志, 2017, 33(5): 392-397. Niu M, Gao ZN, Li S, et al. Impact of uric acid changing degrees on kidney function in middle-aged and elderly women-A follow-up cohort study[J]. Chin J Endocrinol Metab, 2017, 33(5): 392-397. DOI:10.3760/cma.j.issn.1000-6699.2017.05.007 |
| [8] |
Kwon HC, Ahn SS, Yoo BW, et al. Hyperuricemia is associated with decreased renal function and occurrence of end-stage renal disease in patients with microscopic polyangiitis and granulomatosis with polyangiitis: a retrospective study[J]. Rheumatol Int, 2020, 40(7): 1089-1099. DOI:10.1007/s00296-020-04579-4 |
| [9] |
Sedaghat S, Hoorn EJ, van Rooij FJ, et al. Serum uric acid and chronic kidney disease: the role of hypertension[J]. PLoS One, 2013, 8(11): e76827. DOI:10.1371/journal.pone.0076827 |
| [10] |
Chou YC, Kuan JC, Yang T, et al. Elevated uric acid level as a significant predictor of chronic kidney disease: a cohort study with repeated measurements[J]. J Nephrol, 2015, 28(4): 457-462. DOI:10.1007/s40620-014-0158-9 |
| [11] |
周弋, 齐慧, 赵根明, 等. 上海市浦东新区居民高尿酸血症与慢性肾病相关性研究[J]. 中华流行病学杂志, 2012, 33(4): 351-355. Zhou Y, Qi H, Zhao GM, et al. Relationship between hyperuricemia and chronic kidney disease in Pudong New Area of Shanghai[J]. Chin J Epidemiol, 2012, 33(4): 351-355. DOI:10.3760/cma.j.issn.0254-6450.2012.04.001 |
| [12] |
周晓燕, 赵琦, 王娜, 等. 上海市松江区社区居民高尿酸血症与慢性肾病的相关性研究[J]. 中华疾病控制杂志, 2019, 23(3): 278-282, 293. Zhou XY, Zhao Q, Wang N, et al. Relationship between hyperuricemia and chronic kidney disease in adult residents of communities in the Songjiang district, Shanghai[J]. Chin J Dis Control Prev, 2019, 23(3): 278-282, 293. DOI:10.16462/j.cnki.zhjbkz.2019.03.007 |
| [13] |
Kuriyama S, Maruyama Y, Nishio S, et al. Serum uric acid and the incidence of CKD and hypertension[J]. Clin Exp Nephrol, 2015, 19(6): 1127-1134. DOI:10.1007/s10157-015-1120-4 |
| [14] |
Levey AS, Stevens LA, Schmid CH, et al. A new equation to estimate glomerular filtration rate[J]. Ann Intern Med, 2009, 150(9): 604-612. DOI:10.7326/0003-4819-150-9-200905050-00006 |
| [15] |
中华医学会内分泌学分会. 高尿酸血症和痛风治疗的中国专家共识[J]. 中华内分泌代谢杂志, 2013, 29(11): 913-920. Endocrine Committee of Chinese Medical Association. Chinese expert consensus on hyperuricemia and gout treatment[J]. Chin J Endocrinol Metab, 2013, 29(11): 913-920. DOI:10.3760/cma.j.issn.1000-6699.2013.11.001 |
| [16] |
American Diabetes Association. Executive summary: Standards of medical care in diabetes-2014[J]. Diabetes Care, 2014, 37 Suppl 1: S5-13. DOI:10.2337/dc14-S005 |
| [17] |
Chobanian AV, Bakris GL, Black HR, et al. Seventh report of the joint national committee on prevention, detection, evaluation, and treatment of high blood pressure[J]. Hypertension, 2003, 42(6): 1206-1252. DOI:10.1161/01.HYP.0000107251.49515.c2 |
| [18] |
Rothman KJ. Epidemiology: an introduction[M]. New York: Oxford University Press, 2002: 168-180.
|
| [19] |
刘晓琳, 阮晓楠, 周先锋, 等. 上海市浦东新区慢性肾病发病及其危险因素的流行病学研究[J]. 中国预防医学杂志, 2017, 18(10): 747-752. Liu XL, Ruan XN, Zhou XF, et al. Incidence of chronic kidney disease (CKD) and its related risk factors in a Pudong New Area cohort, Shanghai[J]. China Prev Med, 2017, 18(10): 747-752. DOI:10.16506/j.1009-6639.2017.10.006 |
| [20] |
孙凤, 郁凯, 陶庆梅, 等. 中国台湾省35~74岁健检人群慢性肾病5年发病风险预测模型[J]. 中国预防医学杂志, 2013, 14(1): 47-52. Sun F, Yu K, Tao QM, et al. Estimated risks on developing chronic kidney disease within 5 years for adults aged 35-74 based on Taiwan MJ health-checkup Database[J]. China Prev Med, 2013, 14(1): 47-52. DOI:10.16506/j.1009-6639.2013.01.006 |
| [21] |
Tohidi M, Hasheminia M, Mohebi R, et al. Incidence of chronic kidney disease and its risk factors, results of over 10 years follow up in an Iranian cohort[J]. PLoS One, 2012, 7(9): e45304. DOI:10.1371/journal.pone.0045304 |
| [22] |
Feig DI, Kang DH, Johnson RJ. Uric acid and cardiovascular risk[J]. N Engl J Med, 2008, 359(17): 1811-1821. DOI:10.1056/NEJMra0800885 |
| [23] |
白俊玺, 舒仁明, 黄勇, 等. 血尿酸与非酒精性脂肪性肝病发生风险相关性的随访队列研究[J]. 中华肝脏病杂志, 2018, 26(4): 271-275. Bai JX, Shu RM, Huang Y, et al. Correlation between serum uric acid and risk of new-onset nonalcoholic fatty liver disease: a 5-year observational cohort study[J]. Chin J Hepatol, 2018, 26(4): 271-275. DOI:10.3760/cma.j.issn.1007-3418.2018.04.008 |
| [24] |
Sanchez-Lozada LG, Tapia E, Santamaria J, et al. Mild hyperuricemia induces vasoconstriction and maintains glomerular hypertension in normal and remnant kidney rats[J]. Kidney Int, 2005, 67(1): 237-247. DOI:10.1111/j.1523-1755.2005.00074.x |
| [25] |
El Din UAAS, Salem MM, Abdulazim DO. Uric acid in the pathogenesis of metabolic, renal, and cardiovascular diseases: A review[J]. J Adv Res, 2017, 8(5): 537-548. DOI:10.1016/j.jare.2016.11.004 |
 2021, Vol. 42
2021, Vol. 42