文章信息
- 奚玉娥, 高文静, 吕筠, 余灿清, 王胜锋, 黄涛, 孙点剑一, 廖春晓, 逄增昌, 俞敏, 汪华, 吴先萍, 董忠, 吴凡, 江国虹, 王晓节, 刘彧, 邓健, 陆林, 曹卫华, 李立明.
- Xi Yu'e, Gao Wenjing, Lyu Jun, Yu Canqing, Wang Shengfeng, Huang Tao, Sun Dianjianyi, Liao Chunxiao, Pang Zengchang, Yu Min, Wang Hua, Wu Xianping, Dong Zhong, Wu Fan, Jiang Guohong, Wang Xiaojie, Liu Yu, Deng Jian, Lu Lin, Cao Weihua, Li Liming
- 基于中国双生子人群的冠心病遗传-BMI交互作用研究
- Gene-body mass index interaction on coronary heart disease in Chinese adult twins
- 中华流行病学杂志, 2021, 42(9): 1573-1579
- Chinese Journal of Epidemiology, 2021, 42(9): 1573-1579
- http://dx.doi.org/10.3760/cma.j.cn112338-20201130-01362
-
文章历史
收稿日期: 2020-11-30
2. 青岛市疾病预防控制中心 266033;
3. 浙江省疾病预防控制中心, 杭州 310051;
4. 江苏省疾病预防控制中心, 南京 210009;
5. 四川省疾病预防控制中心, 成都 610041;
6. 北京市疾病预防控制中心 100013;
7. 上海市疾病预防控制中心 200336;
8. 天津市疾病预防控制中心 300011;
9. 青海省疾病预防控制中心, 西宁 810007;
10. 黑龙江省疾病预防控制中心, 哈尔滨 150030;
11. 邯郸市疾病预防控制中心 056001;
12. 云南省疾病预防控制中心, 昆明 650034
2. Qingdao Municipal Center for Disease Control and Prevention, Qingdao 266033, China;
3. Zhejiang Provincial Center for Disease Control and Prevention, Hangzhou 310051, China;
4. Jiangsu Provincial Center for Disease Control and Prevention, Nanjing 210009, China;
5. Sichuan Center for Disease Control and Prevention, Chengdu 610041, China;
6. Beijing Center for Disease Prevention and Control, Beijing 100013, China;
7. Shanghai Municipal Center for Disease Control and Prevention, Shanghai 200336, China;
8. Tianjin Centers for Disease Control and Prevention, Tianjin 300011, China;
9. Qinghai Center for Diseases Prevention and Control, Xining 810007, China;
10. Heilongjiang Provincial Center for Disease Control and Prevention, Harbin 150030, China;
11. Handan Center for Disease Control and Prevention, Handan 056001, China;
12. Yunnan Center for Disease Control and Prevention, Kunming 650034, China
冠心病患病受遗传和环境因素的影响。国外研究发现人群中冠心病患病的遗传度为0.37~0.48[1];国内家系研究计算其遗传度为0.39~0.70[2-5],本课题组利用双生子研究发现在调整年龄、性别后,冠心病的遗传度为0.75(95%CI:0.68~0.81)[6]。目前的全基因组关联研究(genome-wide association study,GWAS)发现了150多个与冠心病相关的单核苷酸多态性(single nucleotide polymorphism,SNPs)位点[7-9]。但这些与冠心病相关的SNPs位点仅解释了遗传度的约20%,提示可能存在遗传度缺失[10-11]。
基因-环境交互作用(gene-environment interaction,GxE)是指遗传因素对某性状的影响随着环境的变化而变化的过程,即对特定环境的暴露增强/减弱了遗传因素对特定性状变异的效应[12-14]。GxE可以部分解释疾病的遗传度缺失现象,有助于进一步探索冠心病的发病机制,为精准预防提供依据。既往一般人群的研究发现[15],BMI可通过与某些位点的交互作用影响冠心病。双生子设计可通过表型变异的分解来分析基因-环境交互作用,目前已被广泛运用于基因-环境交互作用的研究中。需要特别说明的是,为了区别于具体基因位点与环境的交互作用,本文将通过双生子模型估计的基因-环境交互作用统称为“遗传-环境交互作用”。既往针对冠心病遗传-环境交互作用的双生子研究较少,目前仅发现一项基于瑞典双生子登记系统的研究[1]。由于不同国家人群的遗传背景和生活方式存在差异,有必要在我国人群中进一步探索BMI是否能够修饰遗传因素对于冠心病患病的作用。
对象与方法1. 研究对象:利用中国双生子登记系统(Chinese National Twin Registry,CNTR)[16]在全国11个省/市(包括山东省、浙江省、江苏省、四川省、北京市、上海市、天津市、青海省、黑龙江省、河北省邯郸市和云南省)开展的一期和二期登记调查募集到的双生子。纳入标准:年龄≥25岁;愿意参加中国双生子登记系统调查,并正式签署知情同意书者。排除标准:多胞胎;异性别者;卵型、年龄、性别、BMI和冠心病等信息缺失者;双生子任何一方被排除,则此对双生子被排除。最终纳入20 340对≥25岁的同性别双生子。本研究通过北京大学生物医学伦理委员会伦理审查(IRB00001052- 11029/14021)。
2. 研究方法及内容:CNTR采用面访式问卷调查收集数据:
(1)冠心病患病情况:通过询问“您是否曾被县/区级或以上医院诊断患有冠心病(含心绞痛和心梗发作)”判断研究对象是否患病。
(2)卵型鉴定:采用问卷结合建模的形式判断卵型。性别不同为异卵双生子(dizygotic twins,DZ),性别相同的双生子则根据问题“你觉得你们这对双生子长得像不像”以及年龄、性别建模判断卵型。本课题组已验证该方法的准确率可达到89.03%(95%CI:83.86%~94.19%),满足大型流行病学调查的要求[17]。
(3)BMI(kg/m2):由体重(kg)/身高(m)的平方计算得到,身高和体重均为自报。
3. 统计学分析:
(1)统计学描述:分性别描述冠心病患病的基本特征分布,采用单因素回归模型检验其分布差异;以双生子对为单位,按BMI分层,分性别描述DZ和同卵双生子(monozygotic,MZ)的冠心病患病一致性,并用logistic回归模型检验其分布差异。
(2)单变量结构方程模型:经典的双生子结构方程模型将表型在人群中的总变异(即方差),分解为加性遗传效应(A)、显性遗传效应(D)、共同环境效应(C)和特殊环境效应(E),A在总变异中所占的比例即为遗传度。模型原理和冠心病遗传度的模型拟合过程参见本课题组的既往研究[6],该研究发现男、女性的AE模型均优于ACE模型。因此本研究分性别拟合AE模型分析交互作用,并在模型中调整年龄。
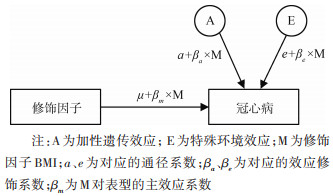
Purcell提出的遗传-环境交互作用模型将修饰因子(moderator,M)纳入经典的双生子结构方程模型[18-20]。通过分析表型的遗传变异是否随M的变化而改变,来探究该表型是否受遗传-环境交互作用的影响。如图 1,BMI为M,冠心病为表型,BMI通过函数(a+βa×M)影响冠心病的遗传通径系数,从而影响其遗传效应。其中βa为BMI对冠心病A的效应修饰系数,当βa≠0时,说明发现冠心病的遗传-BMI交互作用。研究采用Z-score标准化法标准化年龄和log-BMI。因此βa表示log-BMI每改变1个标准差,冠心病遗传通径系数的改变值。
|
| 图 1 单变量遗传-环境交互作用模型(AE模型) |
本研究通过逐步去掉修饰效应来拟合嵌套模型,模型拟合效果的比较采用似然比检验(likelihood ratio test,LRT)。如果去掉遗传修饰效应的P < 0.05,说明去掉该修饰效应改变模型的拟合效果,发现遗传-BMI交互作用;反之则没有交互作用。当发现交互作用时,通过含效应修饰系数的全模型估算βa,说明修饰效应的大小和方向;并通过估计不同BMI水平下的冠心病遗传度,明确BMI对冠心病遗传效应的影响。
本研究采用Stata/MP 14.0软件进行统计描述,采用R 3.6.0软件的OpenMx 2.12.2程序包拟合结构方程模型,以双侧检验的P < 0.05为差异有统计学意义。
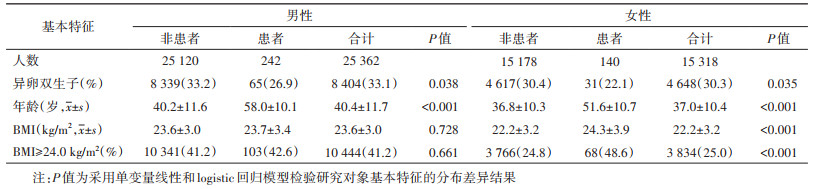
结果1. 一般情况:共纳入20 340对≥25岁同性别双生子,其中男性25 362人(62.3%),冠心病患者382人(0.9%);男、女性的平均年龄分别为40.4和37.0岁,患者年龄均较高;男性人群平均BMI为23.6 kg/m2,其中41.2%的个体BMI≥24.0 kg/m2;在女性中,双生子平均BMI为22.2 kg/m2,25.0%的个体BMI≥24.0 kg/m2,且冠心病患者具有更高的BMI(表 1)。
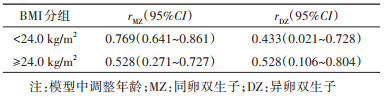
在全样本人群中,男、女性中两成员均患病的MZ双生子对[分别为31对(0.4%)和27对(0.5%)]均多于DZ[5对(0.1%)和1对(< 0.1%)],并且差异有统计学意义。按BMI分层后,在男性中,BMI < 24.0 kg/m2组MZ和DZ双生子的同病率分别为0.4%和0.1%,BMI≥24.0 kg/m2组中均为0.2%;在BMI < 24.0 kg/m2的女性中,MZ和DZ的同病率分别为0.2%和0.1%,BMI≥24.0 kg/m2组中MZ的同病率为1.4%(表 2)。
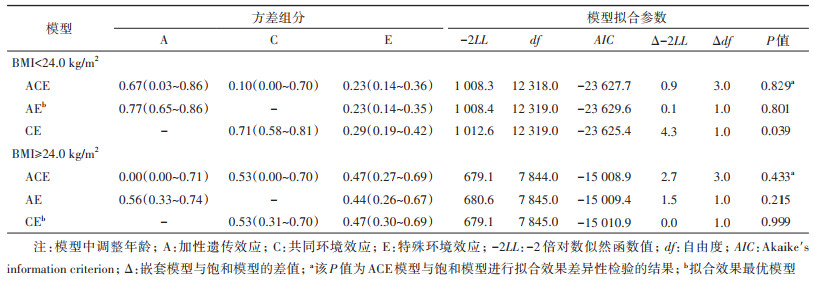
2. 遗传-BMI交互作用:在男性中,去掉遗传修饰效应(令βa=0)使模型的拟合效果变差,说明发现冠心病的遗传-BMI交互作用(P=0.008)(表 3);在包含修饰效应的全模型中,对βa的估算发现BMI对男性冠心病的遗传效应有负向修饰作用(βa=-0.14,95%CI:-0.22~-0.04),表示log-BMI每增加1个标准差,冠心病的遗传通径系数减小0.14,从而导致冠心病的遗传效应减小。而且在本人群的BMI范围内,随着BMI的升高,冠心病遗传效应减小的幅度降低。但女性中未发现此交互作用(βa=0.02,95%CI:-0.10~0.19,P=0.835)。环境效应修饰系数结果,男性βe=0.02(95%CI:-0.07~0.11);女性βe=-0.13(95%CI:-0.20~-0.04)。
3. 冠心病遗传度估计(男性):按照BMI分层后,男性双生子两成员之间冠心病患病的四分位相关系数均表现为rMZ < 2rDZ,故拟合ACE模型(表 4)。在BMI < 24.0 kg/m2组中,冠心病患病的最优模型为AE模型,冠心病的遗传度为0.77(0.65~0.86),在BMI≥24.0 kg/m2组,对应模型的冠心病遗传度为0.56(0.33~0.74)(表 5)。
本研究通过单变量遗传-环境交互作用模型,调整年龄后,在男性中发现冠心病患病的遗传-BMI交互作用:高BMI降低冠心病的遗传效应。而且低BMI(< 24.0 kg/m2)男性冠心病的遗传度较高,而高BMI(≥24.0 kg/m2)者受到的环境效应增强;在女性中未发现此交互作用。
本研究结果表明,在男性中,BMI负向修饰冠心病的遗传效应。提示与BMI较高者相比,遗传因素在BMI较低者冠心病患病中可能发挥更重要的作用。该发现与另一项基于瑞典双生子登记系统的研究结果相似。该研究纳入25 715对双生子,经过40年的随访,共发现7 264例新发冠心病病例。通过单变量交互作用模型在男性中发现冠心病的遗传-BMI交互作用:冠心病的遗传方差和遗传度均随BMI的增加而降低[1]。两项双生子研究均提示,BMI较低男性冠心病受到的遗传效应较高。可能的机制为低BMI人群中可能存在额外的冠心病易感基因,或部分冠心病易感基因在低BMI个体中效应更大。但由于缺乏来自基因水平的证据,研究结论需在未来的研究中进一步被证实。
与双生子研究发现高BMI降低冠心病的遗传效应不同,基于冠心病风险基因的研究大多发现高BMI可协同升高风险等位基因的冠心病风险。Lu等[21]的研究在中国人群中发现了UBE2Z-BMI的交互作用:BMI可与rs46522的GG基因型协同升高冠心病风险。另一项来自中国人群的病例对照研究表明,在BMI > 24.0 kg/m2的人群中,存在MAFB-BMI的交互作用:高BMI可升高GA+AA携带者的冠心病患病风险[22]。此外,研究发现超重可与CYBA基因的-930G等位基因协同升高冠心病患病风险[23]。不少研究也发现高BMI可通过与特定基因位点的交互作用影响与冠心病风险相关的血脂水平:升高LDL[24]和TG[25-26],降低HDL[27-28]。以上证据表明,目前基于双生子设计的遗传背景与BMI的交互作用(高BMI降低遗传因素的影响)与在一般人群中多数特定基因位点与BMI交互作用的研究结果(高BMI协同增加风险基因的作用)之间存在较大的差异。但由于目前两种设计的研究数量都不多,为了更好地揭示冠心病的遗传-BMI交互作用,需要在双生子和一般人群中开展更多更深入的研究。
本研究也发现,与低BMI男性相比,高BMI者冠心病患病受到更多环境因素的影响。目前的研究已证实,高BMI本身是冠心病的一个重要危险因素。一项纳入97项前瞻性队列、共计180万名研究对象的研究发现,与体重正常个体相比,超重和肥胖分别升高50%和44%的冠心病发病风险[29]。另一项基于前瞻性队列研究中389 212名研究对象的Meta分析发现,与BMI正常个体相比,超重和肥胖的相对危险度分别为1.31和1.78[30]。纳入119 859名研究对象的孟德尔随机化研究也证实,高BMI与冠心病风险之间存在显著的正相关[31]。此外,在本研究人群中,高BMI组的研究对象更倾向于具有吸烟和饮酒等不健康的生活方式,而既往研究已证实这些不健康生活方式均可升高冠心病风险[32]。因此,以上证据均支持高BMI组人群中环境因素的相对重要性。
基于本研究的发现,由于低BMI男性的冠心病遗传度较高,今后的GWAS研究应在不同BMI下探索冠心病的易感基因。这将有助于促进正常及低BMI人群的冠心病风险控制。我们的研究同时表明,在高BMI个体中,冠心病患病受到的特殊环境效应占比增强,说明环境因素在该人群中发挥更重要的作用。因此在高BMI个体的冠心病防治方面,应更加注重肥胖、吸烟、饮酒等传统的冠心病危险因素的控制。
本研究未在女性中发现冠心病的遗传-BMI交互作用,这与前述瑞典双生子的研究发现一致[1]。既往研究也发现某些SNPs位点仅在特定性别中与冠心病风险相关[33-34]。因此,特定基因的表达及其效应大小的性别差异,可能部分解释了本研究中男、女性交互作用的差异。但是由于本研究中冠心病患病率较低,且缺乏均患冠心病的女性DZ双生子对,样本量的限制也可能是未在女性中发现潜在的交互作用的原因之一。因此,研究结论的推广需谨慎。
本研究首次针对冠心病的遗传-BMI交互作用提供来自中国双生子的证据。研究基于CNTR,具有较大的样本量。此外,双生子交互作用研究可利用表型总变异中分解出的遗传效应直接分析遗传-环境交互作用,不需要获得个体的基因位点信息;而且可探寻整体遗传背景下的交互作用,与基于特定位点的交互作用研究相比,其研究结果对人群的疾病预防与管理更具意义。本研究的局限性在于,本研究为横断面研究,冠心病患病和BMI的时间顺序无法确定。其次,通过自我报告式问卷调查收集生活方式数据时,可能造成对高BMI人数的低估,这可能会使研究结果偏向于零假设。
综上所述,基于中国双生子登记系统,本研究在男性中发现冠心病的遗传-BMI交互作用,高BMI降低冠心病的遗传效应。而且BMI低者冠心病患病的遗传度较高,环境因素则更多地影响BMI较高者。由于本研究存在局限性,今后仍需开展大规模的前瞻性研究,在基因水平和整体遗传背景下评估冠心病的基因(遗传)-BMI交互作用,从而提升对冠心病交互作用的认识。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Song C, Chang Z, Magnusson PKE, et al. Genetic factors may play a prominent role in the development of coronary heart disease dependent on important environmental factors[J]. J Intern Med, 2014, 275(6): 631-639. DOI:10.1111/joim.12177 |
| [2] |
徐俊伟. 冠心病的家族遗传和饮食习惯因素研究[J]. 临床医药文献电子杂志, 2018, 5(99): 11-12. Xu JW. Study on the genetic and dietary factors of CHD[J]. J Clin Med Literat, 2018, 5(99): 11-12. DOI:10.16281/j.cnki.jocml.2018.99.007 |
| [3] |
朱静华. 冠心病遗传度的研究[J]. 中国厂矿医学, 1998(2): 91-92. Zhu JH. Study on the heritability of CHD[J]. Chin Med Factory Mine, 1998(2): 91-92. |
| [4] |
赵本华, 李召军, 代伟, 等. 冠心病发病的环境因素和遗传因素[J]. 中国慢性病预防与控制, 1995, 3(5): 196-198, 213. Zhao BH, Li ZJ, Dai W, et al. Study on the environmental and genetic factors of CHD[J]. Chin J Prev Control Chronic Dis, 1995, 3(5): 196-198, 213. DOI:10.16386/j.cjpccd.issn.1004-6194.1995.05.002 |
| [5] |
王敏霓. 冠心病遗传度和家族集聚性研究[J]. 中国慢性病预防与控制, 1994, 2(5): 197-198, 220. Wang MN. The study on heritability and familial aggregation of coronary heart disease[J]. Chin J Prev Control Chronic Dis, 1994, 2(5): 197-198, 220. DOI:10.16386/j.cjpccd.issn.1004-6194.1994.05.003 |
| [6] |
王冬萌, 高文静, 吕筠, 等. 中国成年双生子人群的冠心病遗传度估计[J]. 中华流行病学杂志, 2020, 41(5): 700-704. Wang DM, Gao WJ, Lyu J, et al. Heritability of coronary heart disease, based on the data from the Chinese adult twins[J]. Chin J Epidemiol, 2020, 41(5): 700-704. DOI:10.3760/cma.j.cn112338-20190821-00612 |
| [7] |
Erdmann J, Kessler T, Munoz Venegas L, et al. A decade of genome-wide association studies for coronary artery disease: the challenges ahead[J]. Cardiovasc Res, 2018, 114(9): 1241-1257. DOI:10.1093/cvr/cvy084 |
| [8] |
van der Harst P, Verweij N. Identification of 64 novel genetic loci provides an expanded view on the genetic architecture of coronary artery disease[J]. Circ Res, 2018, 122(3): 433-443. DOI:10.1161/CIRCRESAHA.117.312086 |
| [9] |
Musunuru K, Kathiresan S. Genetics of common, complex coronary artery disease[J]. Cell, 2019, 177(1): 132-145. DOI:10.1016/j.cell.2019.02.015 |
| [10] |
Zheng QW, Zhang Y, Jiang J, et al. Exome-wide association study reveals several susceptibility genes and pathways associated with acute coronary syndromes in Han Chinese[J]. Front Genet, 2020, 11: 336. DOI:10.3389/fgene.2020.00336 |
| [11] |
The CARDIoGRAMplusC4D Consortium, Deloukas P, Kanoni S, et al. Large-scale association analysis identifies new risk loci for coronary artery disease[J]. Nat Genet, 2013, 45(1): 25-33. DOI:10.1038/ng.2480 |
| [12] |
Li I, Clark DA, Klump KL, et al. Parental involvement as an etiological moderator of middle childhood oppositional defiant disorder[J]. J Fam Psychol, 2017, 31(6): 659-667. DOI:10.1037/fam0000311 |
| [13] |
Samek DR, Hicks BM, Keyes MA, et al. Antisocial peer affiliation and externalizing disorders: evidence for gene×environment×development interaction[J]. Dev Psychopathol, 2017, 29(1): 155-172. DOI:10.1017/S0954579416000109 |
| [14] |
Dick DM. Gene-environment interaction in psychological traits and disorders[J]. Annu Rev Clin Psychol, 2011, 7: 383-409. DOI:10.1146/annurev-clinpsy-032210-104518 |
| [15] |
Mi XJ, Eskridge KM, George V, et al. Structural equation modeling of gene-environment interactions in coronary heart disease[J]. Ann Hum Genet, 2011, 75(2): 255-265. DOI:10.1111/j.1469-1809.2010.00634.x |
| [16] |
Gao W, Cao W, Lv J, et al. The Chinese national twin registry: a "gold mine" for scientific research[J]. J Intern Med, 2019, 286(3): 299-308. DOI:10.1111/joim.12926 |
| [17] |
Wang BQ, Gao WJ, Yu CQ, et al. Determination of zygosity in adult Chinese twins using the 450 k methylation array versus questionnaire data[J]. PLoS One, 2015, 10(4): e0123992. DOI:10.1371/journal.pone.0123992 |
| [18] |
Purcell S. Variance components models for gene-environment interaction in twin analysis[J]. Twin Res, 2002, 5(6): 554-571. DOI:10.1375/136905202762342026 |
| [19] |
van der Sluis S, Posthuma D, Dolan CV. A note on false positives and power in G×E modelling of twin data[J]. Behav Genet, 2012, 42(1): 170-186. DOI:10.1007/s10519-011-9480-3 |
| [20] |
Medland SE, Neale MC, Eaves LJ, et al. A note on the parameterization of Purcell's G×E model for ordinal and binary data[J]. Behav Genet, 2009, 39(2): 220-229. DOI:10.1007/s10519-008-9247-7 |
| [21] |
Lu DF, Huang J, Ma XW, et al. Rs46522 in the ubiquitin-conjugating enzyme E2Z Gene is associated with the risk of coronary artery disease in individuals of Chinese Han population with Type 2 diabetes[J]. J Diabetes Res, 2017, 2017: 4501794. DOI:10.1155/2017/4501794 |
| [22] |
Yang Q, Yin RX, Zhou YJ, et al. Association of polymorphisms in the MAFB gene and the risk of coronary artery disease and ischemic stroke: a case-control study[J]. Lipids Health Dis, 2015, 14: 79. DOI:10.1186/s12944-015-0078-2 |
| [23] |
Niemiec P, Nowak T, Iwanicki T, et al. The -930A>G polymorphism of the CYBA gene is associated with premature coronary artery disease. A case-control study and gene-risk factors interactions[J]. Mol Biol Rep, 2014, 41(5): 3287-3294. DOI:10.1007/s11033-014-3191-9 |
| [24] |
Wu DF, Yin RX, Cao XL, et al. MADD-FOLH1 polymorphisms and their haplotypes with serum lipid levels and the risk of coronary heart disease and ischemic stroke in a Chinese Han population[J]. Nutrients, 2016, 8(4): 208. DOI:10.3390/nu8040208 |
| [25] |
Baik I, Lee S, Kim SH, et al. A lipoprotein lipase gene polymorphism interacts with consumption of alcohol and unsaturated fat to modulate serum HDL-cholesterol concentrations[J]. J Nutr, 2013, 143(10): 1618-1625. DOI:10.3945/jn.113.175315 |
| [26] |
He YH, Kong WL, Wang G, et al. The calcium-sensing receptor R990G polymorphism is associated with increased risk of hypertriglyceridemia in obese Chinese[J]. Gene, 2014, 533(1): 67-71. DOI:10.1016/j.gene.2013.09.122 |
| [27] |
Miao L, Yin RX, Huang F, et al. The effect of MVK-MMAB variants, their haplotypes and G×E interactions on serum lipid levels and the risk of coronary heart disease and ischemic stroke[J]. Oncotarget, 2017, 8(42): 72801-72817. DOI:10.18632/oncotarget.20349 |
| [28] |
Cho ER, Jee YH, Kim SW, et al. Effect of obesity on the association between MYL2(rs3782889) and high-density lipoprotein cholesterol among Korean men[J]. J Hum Genet, 2016, 61(5): 405-409. DOI:10.1038/jhg.2015.165 |
| [29] |
The Global Burden of Metabolic Risk Factors for Chronic Diseases Collaboration (BMI Mediated Effects). metabolic mediators of the effects of body-mass index, overweight, and obesity on coronary heart disease and stroke: a pooled analysis of 97 prospective cohorts with 1·8 million participants[J]. Lancet, 2014, 383(9921): 970-983. DOI:10.1016/S0140-6736(13)61836-X |
| [30] |
de Hollander EL, Bogers RP, Boshuizen HC, et al. Influence of calendar period on the association between BMI and coronary heart disease: a Meta-analysis of 31 cohorts[J]. Obesity (Silver Spring), 2013, 21(5): 865-880. DOI:10.1002/oby.20043 |
| [31] |
Lyall DM, Celis-Morales C, Ward J, et al. Association of body mass index with cardiometabolic disease in the UK biobank: a mendelian randomization study[J]. JAMA Cardiol, 2017, 2(8): 882-889. DOI:10.1001/jamacardio.2016.5804 |
| [32] |
Joseph P, Leong D, McKee M, et al. Reducing the global burden of cardiovascular disease, Part 1:the epidemiology and risk factors[J]. Circ Res, 2017, 121(6): 677-694. DOI:10.1161/CIRCRESAHA.117.308903 |
| [33] |
Byars SG, Inouye M. Genome-wide association studies and risk scores for coronary artery disease: sex biases[M]//Kerkhof P, Miller V. Sex-specific analysis of cardiovascular function. Cham: Springer, 2018, 1065: 627-642. DOI: 10.1007/978-3-319-77932-4_38.
|
| [34] |
Zhou JQ, Huang Y, Huang RS, et al. A case-control study provides evidence of association for a common SNP rs974819 in PDGFD to coronary heart disease and suggests a sex-dependent effect[J]. Thromb Res, 2012, 130(4): 602-606. DOI:10.1016/j.thromres.2012.05.023 |
 2021, Vol. 42
2021, Vol. 42