文章信息
- 冯永亮, 常越, 石璟, 蓝光华, 鲁鸿燕, 向绍密, 王富珍, 王素萍.
- Feng Yongliang, Chang Yue, Shi Jing, Lan Guanghua, Lu Hongyan, Xiang Shaomi, Wang Fuzhen, Wang Suping
- 不同CD4+T淋巴细胞水平的HIV感染者乙型肝炎疫苗免疫效果及持久性研究
- Immunization effect and persistence of hepatitis B vaccine in HIV-infected patients with different CD4+T cell levels
- 中华流行病学杂志, 2021, 42(9): 1559-1565
- Chinese Journal of Epidemiology, 2021, 42(9): 1559-1565
- http://dx.doi.org/10.3760/cma.j.cn112338-20210319-00222
-
文章历史
收稿日期: 2021-03-19
2. 山西医科大学临床流行病学与循证医学中心, 太原 030001;
3. 广西壮族自治区疾病预防控制中心艾滋病防制所, 南宁 530028;
4. 宁明县疾病预防控制中心 532500;
5. 中国疾病预防控制中心免疫规划中心, 北京 100050
2. Center of Clinical Epidemiology and Evidence Based Medicine, Shanxi Medical University, Taiyuan 030001, China;
3. Institute of AIDS Prevention and Control, Guangxi Zhuang Autonomous Region Center for Disease Prevention and Control, Nanning 530028, China;
4. Ningming County Center for Disease Control and Prevention, Ningming 532500, China;
5. Department of National Immunization Program, Chinese Center for Disease Control and Prevention, Beijing 100050, China
HIV感染者由于进行性免疫功能低下,而且与HBV感染存在相同的传播途径,HBV感染风险高,是HBV感染的高危人群,加之目前我国艾滋病疫情正在从高危人群向一般人群扩散,HIV感染者无疑是我国消除乙肝的重点防控人群。据估计,全球约3 670万HIV感染者中有5%~25%合并感染HBV[1],且合并感染时,HIV感染者发生肝硬化、肝癌和死亡的风险明显增加[2],严重危害机体健康。接种乙肝疫苗是防治HBV感染的有效手段之一[3],但现有研究显示,不论是按常规方案,还是通过增加接种次数、提高疫苗剂量、使用免疫佐剂、改变注射方式等优化接种方案后,HIV感染者的乙肝疫苗免疫效果依然不佳[4-5]。乙肝疫苗免疫应答以体液免疫为主,CD4+T淋巴细胞(CD4)在产生免疫应答中起着重要作用,而CD4下降又是HIV感染者的一大特征,HIV主要通过破坏该细胞功能而影响人体的免疫系统,继而影响疫苗接种后的免疫效果和免疫持久性,既往研究多关注其对免疫效果的影响[6-7],但对乙肝疫苗免疫效果影响的结果不一,持久性影响研究较少,且多为回顾性研究。为此,本研究在前期随机对照试验研究基础上,进行了随访研究,通过分析CD4水平对乙肝疫苗免疫应答的影响,探讨不同CD4水平的HIV感染者乙肝疫苗免疫效果及其消减规律,为优化HIV感染者乙肝疫苗免疫策略和消除乙肝策略提供理论依据。
对象与方法1. 研究对象:来自2014年10月至2018年7月广西壮族自治区CDC和宁明县CDC管理的18~70岁、HBsAg和抗-HBs阴性、CD4≥200个/µl HIV感染者182例,按1∶1的比例随机分成2组,按照0-1-6月免疫程序分别接种重组酵母乙肝疫苗(深圳康泰生物制品有限公司生产)20 μg(批号No. 201308009)和60 μg(批号No. A201301002)。CD4分为 < 350个/µl组和≥350个/µl组[8]。经山西医科大学伦理委员会批准,研究对象均签署知情同意书。
2. 资料收集:采用面对面问卷调查的方式,收集年龄、性别、民族、婚姻状况、职业、文化程度、收入和BMI等人口学信息,查阅相关医疗记录收集疾病史、HIV感染持续时间、CD4、乙肝疫苗接种史、抗病毒治疗情况等。
3. 标本采集和实验室检测:分别于乙肝疫苗首针接种后6个月,全程接种后1个月、6个月、1年和3年时,采集研究对象静脉血5 ml,采用化学发光微粒子免疫分析法(CMIA)(美国雅培公司ARCHITECT-i2000免疫发光检测仪及试剂)检测抗-HBs、HBsAg和抗-HBc。采用BD公司生产的FACSCalibur流式细胞仪检测CD4,统一在CDC有资质的实验室,由培训合格的专业人员采用统一的仪器试剂进行检测。
4. 相关定义:抗-HBs浓度 < 10 mIU/ml为阴性;抗-HBs浓度≥10 mIU/ml为阳性;抗-HBs浓度≥100 mIU/ml为强阳性[9-10]。
5. 质量控制:现场调查前,优选调查员,严格进行岗前培训。现场调查中,加强现场督导和问卷抽样复核等措施提高问卷质量。加强宣传教育,提高研究对象依从性。在同一实验室由固定的检测人员严格按照试剂盒说明书完成检测。
6. 统计学分析:采用EpiData 3.1软件进行数据双录入,采用SAS 9.4软件进行统计学分析。符合正态分布的计量资料采用x±s描述,采用几何平均浓度(GMC)描述抗-HBs平均水平,采用t检验分析;计数资料采用率或构成比描述,采用χ2检验。采用单因素和多因素logistic回归模型进行影响因素分析。双侧检验,以P < 0.05为差异有统计学意义。
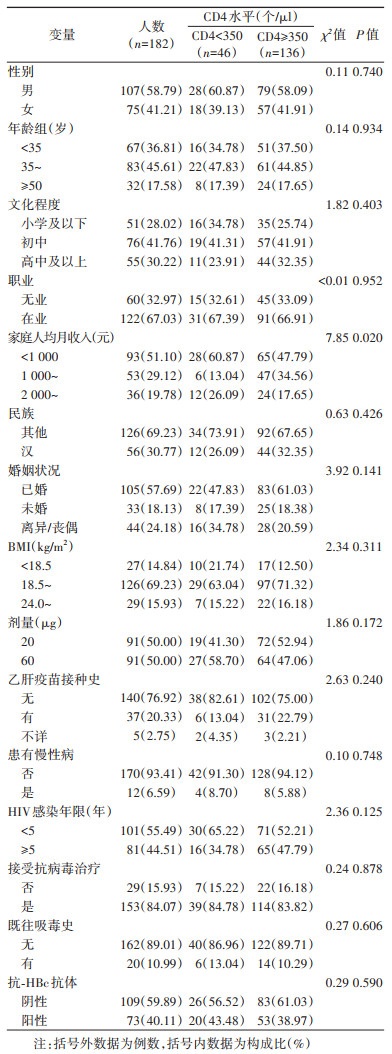
结果1.一般情况:182例HIV感染者中,CD4 < 350、≥350个/µl分别为46、136例;男性107例,女性75例(1.43∶1);年龄范围18~70岁,35~49岁者为主(45.61%,83/182);抗-HBc阳性者占40.11%(73/182);大多数接受HIV抗病毒治疗(84.07%,153/182)。CD4 < 350个/µl者的家庭人均月收入 < 1 000元的比例(60.87%)明显高于≥350个/µl者(47.79%)(P < 0.05);两组在性别、年龄、文化程度、BMI、婚姻状况、民族、职业、乙肝疫苗接种剂量、既往乙肝疫苗接种史、HIV感染年限、抗-HBc、慢性病、HIV抗病毒治疗、既往吸毒史等方面差异均无统计学意义(P > 0.05)。见表 1。
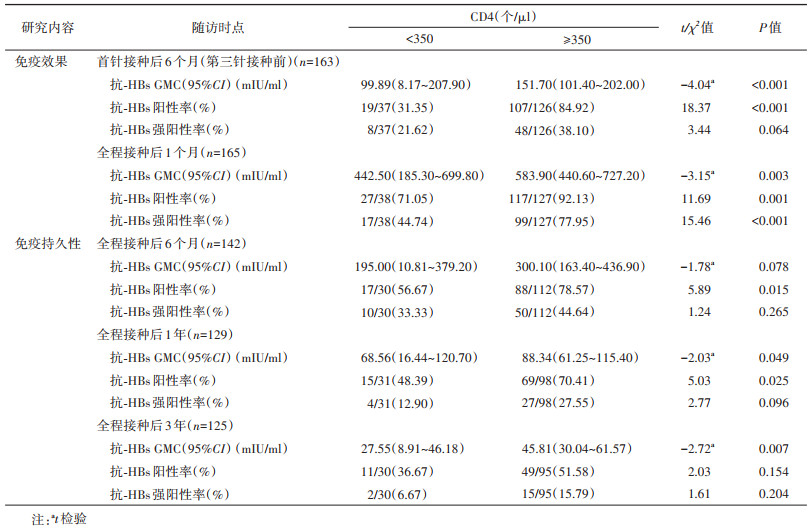
2. HIV感染者不同CD4水平时乙肝疫苗免疫效果:乙肝疫苗全程接种后1个月时,CD4 < 350个/µl的HIV感染者抗-HBs GMC为442.50 mIU/ml,抗-HBs阳性率为71.05%(27/38),强阳性率为44.74%(17/38),均明显低于CD4≥350个/µl者[583.90 mIU/ml、92.13%(117/127)和77.95%(99/127)](P < 0.05)。见表 2。
3. 不同CD4水平HIV感染者乙肝疫苗免疫持久性:乙肝疫苗全程接种后6个月、1年和3年时,CD4 < 350个/µl者抗-HBs GMC、阳性率和强阳性率均不同程度低于CD4≥350个/µl者。全程接种后6个月时,CD4 < 350个/µl者抗-HBs阳性率明显低于CD4≥350个/µl者(56.67%比78.57%)(P < 0.05);全程接种后1年时,CD4 < 350个/µl者抗-HBs GMC和阳性率均明显低于CD4≥350个/µl者(68.56 mIU/ml比88.34 mIU/ml,48.39%比70.41%)(P < 0.05);全程接种后3年时,CD4 < 350个/µl者抗-HBs GMC明显低于CD4≥350个/µl者(27.55 mIU/ml比45.81 mIU/ml)(P < 0.05)。见表 2。
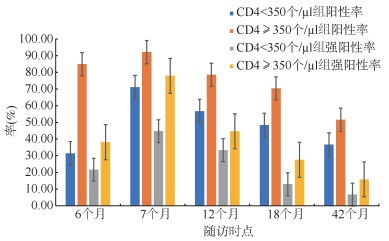
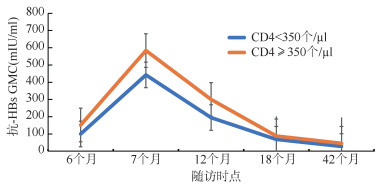
4. 不同CD4水平的HIV感染者抗-HBs GMC和(强)阳性率变化趋势:不同CD4水平的HIV感染者乙肝疫苗接种后长期效果分析显示,CD4 < 350个/µl和CD4≥350个/µl的HIV感染者接种乙肝疫苗后抗-HBs GMC与(强)阳性率均呈先上升后下降趋势。抗-HBs GMC、阳性率和强阳性率在全程接种后1个月时均达到峰值,随后抗-HBs GMC在全程接种后1个月到半年及1年内均快速下降,且CD4 < 350个/µl者抗-HBs GMC与(强)阳性率持续低于CD4≥350个/µl者。在接下来随访的两年内,抗-HBs GMC、(强)阳性率下降平缓,且CD4 < 350个/µl者仍然持续低于CD4≥350个/µl者(图 1,2),即CD4≥350个/µl的HIV感染者乙肝疫苗免疫持久性优于CD4 < 350个/µl者。
|
| 图 1 不同CD4+T淋巴细胞水平的HIV感染者各个随访时点的抗-HBs(强)阳性率 |
|
| 图 2 不同CD4+T淋巴细胞水平的HIV感染者各个随访时点的抗-HBs几何平均浓度 |
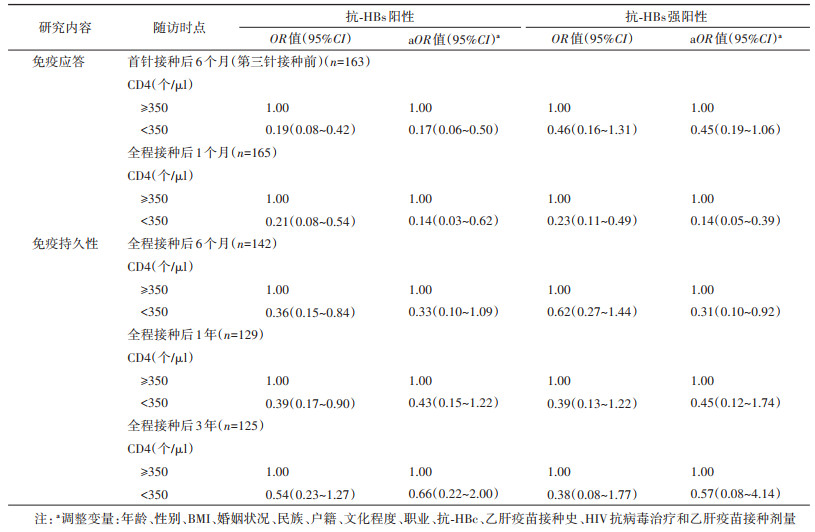
5. CD4水平对乙肝疫苗免疫应答影响因素的logistic回归分析:将HIV感染者接种乙肝疫苗后抗-HBs阳性及强阳性(抗-HBs≥100 mIU/ml)作为因变量,单因素分析有意义的变量及文献报道的相关变量,纳入非条件logistic回归模型,控制混杂因素后,结果显示:CD4 < 350个/µl的HIV感染者乙肝疫苗抗-HBs阳性的概率是CD4≥350个/µl者的0.14倍(95%CI:0.03~0.62),CD4水平较低是乙肝疫苗免疫无应答的危险因素(表 3)。全程接种后6个月、1年和3年抗-HBs阳性影响因素logistic回归分析显示,抗-HBs阳性与CD4水平无关,而与全程接种后1个月时的抗-HBs≥100 mIU/ml有关[OR值(95%CI)分别为:3.69(1.27~10.72)、14.03(4.33~45.43)和9.21(2.64~32.13)]。
HIV感染者易合并HBV感染,感染后危害严重。研究表明,90%~95%健康人接种乙肝疫苗后可产生保护性抗体(抗-HBs≥10 mIU/ml)[11]。然而,对于免疫功能缺陷的HIV感染者,优化乙肝疫苗免疫方案后其效果依然不佳,且抗体易于消减[12-14]。CD4作为乙肝疫苗体液免疫的重要环节,而CD4水平下降又是HIV感染的人群特征,HIV感染者CD4水平可能直接决定乙肝免疫效果及持久性。探讨HIV感染者不同CD4水平下乙肝疫苗免疫效果和免疫持久性,对优化HIV感染者乙肝疫苗免疫策略以预防该人群感染HBV及达到我国消除乙肝的目标至关重要。
乙肝疫苗接种后,HBsAg诱导机体产生抗-HBs必须经抗原提呈形成主要组织相容性复合体(抗原肽-MHC)、辅助性T淋巴细胞识别及B淋巴细胞激活与分化3个基本环节[15],首先被抗原提呈细胞吞噬和处理,并附着到抗原提呈细胞的表面,抗原提呈细胞向CD4呈递抗原,并由CD4释放细胞因子,B细胞成熟为浆细胞,产生中和抗体[16],CD4的减少会引起相关细胞因子分泌减少,进而影响B细胞活化、增殖、分化为浆细胞,使其合成和分泌的抗体减少,最终影响乙肝疫苗的免疫效果[15]。
本研究发现,CD4 < 350个/µl者乙肝疫苗接种后抗-HBs阳性率(71.05%)明显低于CD4≥350个/µl者(92.13%),CD4 < 350个/µl者抗-HBs阳性的概率是CD4≥350个/µl者的0.14倍,CD4水平较低是乙肝疫苗免疫无应答的危险因素。现有关CD4对免疫效果的影响研究结果不一,且多为回顾性研究。Kim等[6]和Catherine及Piroth[7]进行的文献综述表明,不论按200、350个/µl,还是500个/µl分组,多数研究显示CD4水平高者乙肝疫苗应答率高明显高于CD4水平低者,CD4水平低的HIV感染者乙肝疫苗无应答风险高。相类似,Pollack等[17]对成年HIV感染者的回顾分析显示,乙肝疫苗应答者CD4水平明显高于无应答者(309与204个/µl),接种前CD4水平是乙肝疫苗免疫应答的唯一影响因素;一项美军HIV感染者队列也表明[18],CD4每增加50个/µl,乙肝疫苗应答的概率增加8%。而Rech-Medeiros等[19]的回顾性研究显示,CD4≤350个/µl的HIV感染者乙肝疫苗应答率(81.00%)与CD4 > 350个/µl(79.50%)接近。尽管这些研究设计类型、疫苗接种方案和CD4分组标准等不尽相同,但绝大多数研究都表明CD4水平低者乙肝疫苗免疫效果不佳。综合美国关于预防和治疗HIV感染成年人和青少年机会性感染的指南建议[20],本研究建议,应定期监测HIV感染者抗-HBs水平,特别关注CD4 < 350个/µl的HIV感染者,应积极进行艾滋病抗病毒治疗,当抗-HBs阴性时应尽早全程及加强接种乙肝疫苗。
接种乙肝疫苗后,健康人群抗-HBs可长期存在[21],而HIV感染者抗-HBs短期内明显下降[12-14],这可能与HIV感染者进行性免疫功能低下、CD4水平降低有关,CD4对HIV感染者乙肝疫苗免疫持久性影响如何值得关注,但相关研究较少。本研究显示,抗-HBs GMC、阳性率在全程接种后1个月时均达到峰值,随后均下降,且CD4 < 350个/µl者持续低于CD4≥350个/µl者,即CD4 < 350个/µl者乙肝疫苗免疫持久性较差。Lara等[22]研究显示,70.7%的应答者保护性抗体水平(抗-HBs≥10 mIU/ml)平均可维持11.3年,且接种前CD4水平(OR=1.001,95%CI:1.000~1.001)和疫苗接种后抗-HBs > 100 mIU/ml(OR=2.28)与乙肝疫苗免疫持久性有关,但该研究中CD4水平的OR值接近1,CD4水平与乙肝疫苗免疫持久性关系有待进一步探讨;Lao-Araya等[23]对HIV感染儿童进行了乙肝疫苗再次免疫接种后3年持久性分析,logistic回归分析显示,CD4≥500个/µl(OR=6.63)和再次免疫后抗-HBs≥100 mIU/ml(OR=144.95)3年持久性较好。一般而言,乙肝疫苗免疫持久性与其免疫应答水平息息相关[24],本研究发现乙肝疫苗全程接种后6个月、1年和3年免疫持久性与全程接种后1个月时的抗-HBs≥100 mIU/ml有关(OR值范围3.69~14.03),但未发现与CD4水平有关,这可能与随访时样本量减少有关,也可能是CD4与其他因素综合影响了乙肝疫苗免疫应答水平,进而影响免疫持久性。因此,对于CD4水平较低的HIV感染者,应积极进行艾滋病抗病毒治疗,着力优化免疫接种方案,及早接种乙肝疫苗,最大限度提高乙肝疫苗免疫应答水平,维持乙肝疫苗免疫持久性,保护机体免于HBV感染。
本研究存在不足。一是CD4 < 350个/µl组样本量相对较小,以方便抽样选取当地CDC管理的HIV感染者,研究对象CD4水平与当地HIV感染者CD4水平、CD4 < 350个/µl的比例接近;且有关抗-HBs阳性和强阳性与CD4水平关系的结果较为稳定,单因素和多因素分析结果均显示CD4 < 350个/µl是无应答和无弱应答的危险因素,能较好地反映CD4对乙肝疫苗应答的影响;但CD4 < 350个/µl组样本量确实较少,影响研究把握度,部分HIV感染者在全程接种后1年和3年时失访,样本量进一步减少,这可能会影响研究结论,有待扩大样本量进行深入研究。二是尽管不同CD4水平的抗-HBc一致,本研究未排除抗-HBc阳性者,可能对乙肝疫苗免疫效果有影响。
综上所述,CD4 < 350个/µl的HIV感染者乙肝疫苗无应答风险高,免疫持久性较差,应定期监测HIV感染者抗-HBs水平,并特别关注CD4 < 350个/µl者,抗-HBs阴性时应尽早全程及加强接种乙肝疫苗。对于抗-HBs阴性者应尽早全程及加强接种乙肝疫苗,最大限度降低该人群易感性,保护其免于HBV感染,尽早实现WHO的2030年消除病毒性肝炎的目标。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
World Health Organization. Consolidated HIV strategic information guidelines[EB/OL]. (2020-04-22). https://www.who.int/publications/i/item/9789240000735.
|
| [2] |
Rajbhandari R, Jun T, Khalili H, et al. HBV/HIV coinfection is associated with poorer outcomes in hospitalized patients with HBV or HIV[J]. J Viral Hepat, 2016, 23(10): 820-829. DOI:10.1111/jvh.12555 |
| [3] |
中华医学会感染病学分会, 中华医学会肝病学分会. 慢性乙型肝炎防治指南(2019年版)[J]. 中华肝脏病杂志, 2019, 27(12): 938-961. Chinese Society of Infectious Diseases, Chinese Medical Association, Chinese Society of Hepatology, Chinese Medical Association. The guidelines of prevention and treatment for chronic hepatitis B (2019 version)[J]. Chin J Hepatol, 2019, 27(12): 938-961. DOI:10.3760/cma.j.issn.1007-3418.2019.12.007 |
| [4] |
Lee JH, Hong S, Im JH, et al. Systematic review and Meta-analysis of immune response of double dose of hepatitis B vaccination in HIV-infected patients[J]. Vaccine, 2020, 38(24): 3995-4000. DOI:10.1016/j.vaccine.2020.04.022 |
| [5] |
Ni JD, Xiong YZ, Wang XJ, et al. Does increased hepatitis B vaccination dose lead to a better immune response in HIV-infected patients than standard dose vaccination: a Meta-analysis?[J]. Int J STD AIDS, 2013, 24(2): 117-122. DOI:10.1177/0956462412472309 |
| [6] |
Kim HN, Harrington RD, Crane HM, et al. Hepatitis B vaccination in HIV-infected adults: current evidence, recommendations and practical considerations[J]. Int J STD AIDS, 2009, 20(9): 595-600. DOI:10.1258/ijsa.2009.009126 |
| [7] |
Catherine FX, Piroth L. Hepatitis B virus vaccination in HIV-infected people: A review[J]. Hum Vaccin Immunother, 2017, 13(6): 1304-1313. DOI:10.1080/21645515.2016.1277844 |
| [8] |
本书编写组. 国家免费艾滋病抗病毒药物治疗手册. 3版[M]. 北京: 人民卫生出版社, 2012. Compilation Group of This Book. National free AIDS treatment manual. 3rded[M]. Beijing: People's Medical Publishing House, 2012. |
| [9] |
杨志清, 郝海昀, 史晓红, 等. HBsAg阳性母亲HBV感染状况与婴儿乙肝疫苗无/弱应答的关系[J]. 中华流行病学杂志, 2018, 39(6): 805-809. Yang ZQ, Hao HY, Shi XH, et al. Relationship between the HBsAg-positive infection status of mothers and the non/low-response to hepatitis B vaccine of their infants[J]. Chin J Epidemiol, 2018, 39(6): 805-809. DOI:10.3760/cma.j.issn.0254-6450.2018.06.021 |
| [10] |
张丽, 颜丙玉, 吕静静, 等. 乙型肝炎疫苗初次免疫成年无应答者再次免疫后4年抗体持久性观察[J]. 中华预防医学杂志, 2016, 50(6): 497-502. Zhang L, Yan BY, Lyu JJ, et al. Anti-HBs persistence after revaccination with three doses of hepatitis B vaccine among non-responsive adults: a 4-year of follow-up study[J]. Chin J Prev Med, 2016, 50(6): 497-502. DOI:10.3760/cma.j.issn.0253-9624.2016.06.005 |
| [11] |
Lemon SM, Thomas DL. Vaccines to prevent viral hepatitis[J]. N Engl J Med, 1997, 336(3): 196-204. DOI:10.1056/nejm199701163360307 |
| [12] |
Launay O, Rosenberg AR, Rey D, et al. Long-term immune response to hepatitis B virus vaccination regimens in adults with Human Immunodeficiency Virus 1:secondary analysis of a randomized clinical trial[J]. JAMA Intern Med, 2016, 176(5): 603-610. DOI:10.1001/jamainternmed.2016.0741 |
| [13] |
Rey D, Piroth L, Wendling MJ, et al. Safety and immunogenicity of double-dose versus standard-dose hepatitis B revaccination in non-responding adults with HIV-1(ANRS HB04 B-BOOST): a multicentre, open-label, randomised controlled trial[J]. Lancet Infect Dis, 2015, 15(11): 1283-1291. DOI:10.1016/s1473-3099(15)00220-0 |
| [14] |
Kernéis S, Launay O, Turbelin C, et al. Long-term immune responses to vaccination in HIV-infected patients: a systematic review and Meta-analysis[J]. Clin Infect Dis, 2014, 58(8): 1130-1139. DOI:10.1093/cid/cit937 |
| [15] |
庄贵华, 颜虹, 王学良. 乙型肝炎疫苗接种无应答原因与机制[J]. 中华肝脏病杂志, 2006, 14(2): 157-160. Zhuang GH, Yan H, Wang XL. Risk factors of and mechanism for non-responsiveness to hepatitis B vaccination[J]. Chin J Hepatol, 2006, 14(2): 157-160. DOI:10.3760/j.issn:1007-3418.2006.02.026 |
| [16] |
Das S, Ramakrishnan K, Behera SK, et al. Hepatitis B vaccine and immunoglobulin: key concepts[J]. J Clin Transl Hepatol, 2019, 7(2): 165-171. DOI:10.14218/jcth.2018.00037 |
| [17] |
Pollack TM, Trang LTT, Ngo L, et al. Response to hepatitis B vaccination among HIV-infected adults in Vietnam[J]. J Virus Erad, 2016, 2(2): 102-106. DOI:10.1016/S2055-6640(20)30471-4 |
| [18] |
Landrum ML, Huppler HK, Ganesan A, et al. Hepatitis B vaccine responses in a large U.S. military cohort of HIV-infected individuals: another benefit of HAART in those with preserved CD4 count[J]. Vaccine, 2009, 27(34): 4731-4738. DOI:10.1016/j.vaccine.2009.04.016 |
| [19] |
Rech-Medeiros AF, Marcon PDS, Tovo CDV, et al. Evaluation of response to hepatitis B virus vaccine in adults with human immunodeficiency virus[J]. Ann Hepatol, 2019, 18(5): 725-729. DOI:10.1016/j.aohep.2019.03.012 |
| [20] |
Kaplan JE, Benson C, Holmes KK, et al. Guidelines for prevention and treatment of opportunistic infections in HIV-infected adults and adolescents: recommendations from CDC, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America[J]. MMWR Recomm Rep, 2009, 58(RR-4): 1-207. |
| [21] |
张丽, 颜丙玉, 吕静静, 等. 成人乙型肝炎疫苗接种后12年免疫记忆持久性及相关因素分析[J]. 中华预防医学杂志, 2019, 53(5): 497-502. Zhang L, Yan BY, Lyu JJ, et al. Persistence of immune memory and its related factors at 12 years after hepatitis B vaccination among adults[J]. Chin J Prev Med, 2019, 53(5): 497-502. DOI:10.3760/cma.j.issn.0253-9624.2019.05.012 |
| [22] |
Lara AN, Sartori AM, Fonseca MO, et al. Long-term protection after hepatitis B vaccination in people living with HIV[J]. Vaccine, 2017, 35(33): 4155-4161. DOI:10.1016/j.vaccine.2017.06.040 |
| [23] |
Lao-Araya M, Puthanakit T, Aurpibul L, et al. Prevalence of protective level of hepatitis B antibody 3 years after revaccination in HIV-infected children on antiretroviral therapy[J]. Vaccine, 2011, 29(23): 3977-3981. DOI:10.1016/j.vaccine.2011.03.077 |
| [24] |
Farooq PD, Sherman KE. Hepatitis B vaccination and waning hepatitis B immunity in persons living with HIV[J]. Curr HIV/AIDS Rep, 2019, 16(5): 395-403. DOI:10.1007/s11904-019-00461-6 |
 2021, Vol. 42
2021, Vol. 42