文章信息
- 颜丙玉, 吕静静, 冯艺, 曹传昭, 孟鑫, 梁晓峰, 王富珍, 徐爱强, 张丽.
- Yan Bingyu, Lyu Jingjing, Feng Yi, Cao Chuanzhao, Meng Xin, Liang Xiaofeng, Wang Fuzhen, Xu Aiqiang, Zhang Li
- 乙型肝炎疫苗无应答成年人再次免疫后8年抗体持久性观察
- Antibodies persistence after revaccination with three doses of hepatitis B vaccine in non-responsive adults: results from 8-year follow-up study
- 中华流行病学杂志, 2021, 42(9): 1546-1552
- Chinese Journal of Epidemiology, 2021, 42(9): 1546-1552
- http://dx.doi.org/10.3760/cma.j.cn112338-20210319-00223
-
文章历史
收稿日期: 2021-03-19
2. 济南市章丘区疾病预防控制中心计划免疫科 250200;
3. 暨南大学基础医学与公共卫生学院, 广州 510632;
4. 中国疾病预防控制中心免疫规划中心, 北京 100050
2. Division of Expanded Program Immunization, Zhangqiu District Center for Disease Control and Prevention, Ji'nan 250200, China;
3. School of Medicine, Jinan University, Guangzhou 510632, China;
4. Department of National Immunization Program, Chinese Center for Disease Control and Prevention, Beijing 100050, China
乙型肝炎(乙肝)疫苗(HepB)接种是预防和控制HBV感染的最有效措施[1-2],是实现2030年全球消除乙肝的重要策略。随着儿童HBV感染已得到有效控制,成年人特别是青壮年人群已逐渐成为我国急性HBV感染的主要人群[3],但目前我国成年人HepB接种率仍处于较低水平[2, 4]。一般成年人完成3剂次HepB接种后,约有10%~30%抗-HBs水平低于10 mIU/ml,呈现无应答[5-6],此类人群对HBV仍易感。对HepB初次免疫(初免)无应答者进行再次免疫(再免),是提高无应答者应答率的主要方法[7]。研究显示,HepB初免无应答成年人完成3剂次再免后,可诱导产生良好的体液免疫[8-9],但其再免后长期免疫持久性尚不十分清楚。本课题组于2010年在济南市章丘区建立了成年人HepB初免无应答者再免后观察队列,并于2013年(再免后2年)、2015年(再免后4年)进行了随访[10-11]。2019年(再免后8年)再次对该人群进行了随访观察,以期为科学制定我国成年人乙肝防控策略提供参考。
对象与方法1. 研究对象:2009年8-9月选择济南市章丘区北部人口流动性较小的3个相邻乡(镇)全部79个村作为研究现场。研究对象纳入标准为18~49岁、本地常住人口、既往无HBV感染史和HepB接种史、健康状况良好和知情同意。本研究经山东省CDC预防医学伦理委员会同意(批号:2019-2)。
2. 问卷调查、标本采集及检测:
(1)问卷调查:采用自行设计的结构式问卷,由经过培训的县级CDC和乡(镇)卫生院专业人员,面对面调查收集研究对象基本情况、HBV感染史、HepB免疫史、吸烟史、饮酒史、慢性病史等。
(2)标本采集及检测:每人采集静脉血3~5 ml,采用ELISA方法检测HBsAg、抗-HBs和抗-HBc。HBsAg和抗-HBs,检测试剂由英科新创(厦门)技术股份有限公司生产,抗-HBc检测试剂由上海科华生物工程股份有限公司生产。共检测24 237例,其中3项指标全部阴性者11 590名。对其进行问卷调查、HepB接种和接种后随访。
3. 初免:以村为单位整群随机抽样,将11 590名阴性者分为4组,分别使用20 μg重组酿酒酵母HepB(HepB-SC)、20 μg重组中国仓鼠卵巢细胞HepB(HepB-CHO)、10 μg HepB-SC和10 μg重组汉逊酵母HepB(HepB-HP),按0-1-6免疫程序完成3剂次初免。全程免疫后1个月,由经过培训合格的乡(镇)工作人员,采集每名调查对象的静脉血3~5 ml,共采集8 592名。分离血清后冷冻保存,送至济南市艾迪康医学检验中心,采用化学发光微粒子免疫分析法(CMIA)(美国雅培公司ARCHITECT-i2000免疫发光检测仪及试剂)统一定量检测抗-HBs,共筛出900名抗-HBs无应答者。
4. 再免及随访:于2010年9月,按照相同的0-1-6免疫程序,以村为单位整群随机采用以上4种HepB进行3剂次再免,于再免后1个月(T1)采血并进行抗体检测,对完成检测的645人纳入后续随访。于再免后2年(2013年)、4年(2015年)和8年(2019年)进行随访,分别采集到467、356和403人血液样本,其中230人各随访时间点均完成采血。随访标本均采用CMIA法检测抗-HBs、抗-HBc和HBsAg。
5. 判定标准:①初免无应答:初免后1个月抗-HBs < 10 mIU/ml[1];②抗-HBs阳性:抗-HBs≥10 mIU/ml,表明具有抵抗HBV感染的能力;③BMI(kg/m2):< 18.5为体重过轻,18.5 ~为正常体重,24.0~为超重,≥28.0为肥胖[12];④HBV突破性感染:接种HepB后出现HBsAg和/或抗-HBc阳转[13]。
6. 统计学分析:现场调查资料核对后,应用EpiData 3.0软件录入并建立队列数据库,运用Stata 10.0软件进行统计分析。分类资料的描述采用率或比例报告,应用χ2检验分析随访组和总体组年龄及性别构成差异,以及不同疫苗组或T1时GMC不同组间抗-HBs阳性率差异;采用方差分析比较接种不同疫苗组或T1时GMC不同组间抗-HBs的GMC差异。年均递减率: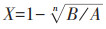
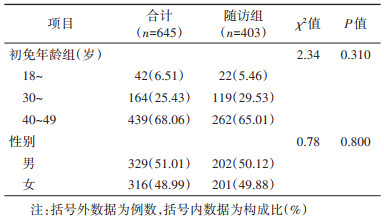
1. 基本情况:645名完成3剂次再免和T1时抗体检测者,再免后8年随访时有403例研究对象未进行过加强免疫且有随访结果,随访率为62.48%。随访组中,18~、30~和40~49岁组分别占5.46%、29.53%和65.01%,男女分别占50.12%和49.88%。随访组和总体组年龄和性别构成差异均无统计学意义(P值分别为0.310和0.800)。见表 1。
2. 再免后8年随访对象的抗-HBs阳性率及GMC:
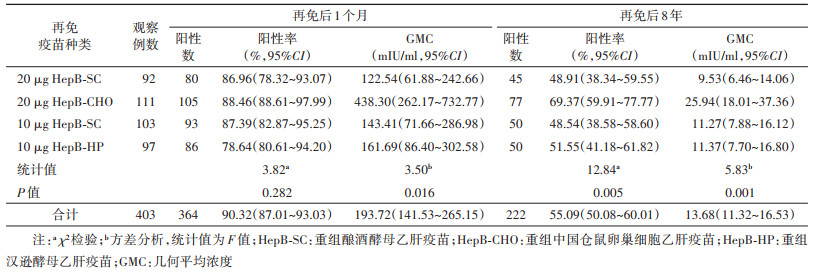
(1)抗-HBs阳性率:再免后8年随访的403名调查对象中,抗-HBs阳性率为55.09%,比T1时下降35.23%,其中20 μg HepB-SC、20 μg HepB-CHO、10 μg HepB-SC和10 μg HepB-HP再免疫苗组的抗-HBs阳性率分别为48.91%、69.37%、48.54%和51.55%,差异有统计学意义;T1时抗-HBs的GMC较高组再免后8年的阳性率亦较高,差异有统计学意义。
(2)抗-HBs的GMC:再免后8年抗-HBs的GMC为13.68 mIU/ml,与T1时相比下降92.94%;20 μg HepB-SC、20 μg HepB-CHO、10 μg HepB-SC和10 μg HepB-HP再免组抗-HBs的GMC分别为9.53、25.94、11.27和11.37 mIU/ml,差异有统计学意义;T1时抗-HBs的GMC较高组再免后8年的GMC亦较高,差异亦有统计学意义。见表 2,3。
3. 抗-HBs阳性率及GMC年均递减率:
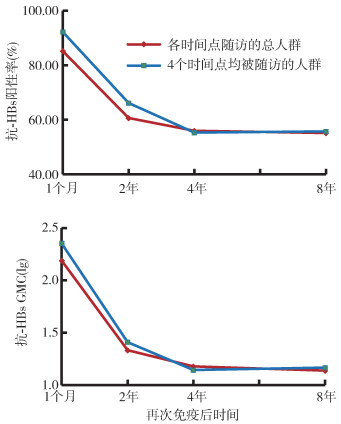
(1)抗-HBs阳性率:再免后1个月、2年、4年和8年各时间点随访的总人群中,抗-HBs阳性率分别为85.12%(549/645)、60.60%(283/467)、55.90%(199/356)和55.09%(222/403),其中均完成4次随访的230人,其抗-HBs阳性率分别为92.17%(212/230)、66.09%(152/230)、55.22%(127/230)和55.65%(128/230),各时间点阳性率和总体均一致。T1到再免后8年的总体抗-HBs阳性率年均递减率为5.29%,其中前2年、3~4年和5~8年的年均递减率分别为15.62%、3.96%和0.36%,自第5年开始,阳性率保持稳定。
(2)抗-HBs的GMC:再免后1个月、2年、4年和8年总体抗-HBs的GMC分别为153.92、21.43、15.02和13.68 mIU/ml,其中均完成4次随访的230人中,其GMC分别为225.66、25.63、13.88和14.62 mIU/ml,各时间点GMC和总体基本一致。T1到再免后8年的总体GMC年均递减率为26.11%,其中前2年、3~4年和5~8年的年均递减率分别为62.69%、16.28%和2.31%,自第5年开始,GMC亦相对稳定。见图 1。
|
| 图 1 乙肝疫苗初免无应答成年人再免后抗-HBs阳性率和GMC变化趋势 |
4. 再免后8年抗-HBs阳性率和GMC影响因素的多因素分析:再免后8年抗-HBs阳性率和GMC均与T1时抗-HBs GMC水平呈正相关,与T1时抗-HBs GMC < 100 mIU/ml者相比,T1时GMC为100~和≥1 000 mIU/ml者再免后8年抗-HBs阳性率(OR值分别为14.13和62.91)和GMC(β值分别为1.88和3.24)均较高(均P < 0.001)。而疫苗种类、初免年龄、性别、BMI和吸烟史、饮酒史的影响均未见统计学意义。见表 4。
5. HBV突破性感染:再免后8年无HBsAg阳转者;抗-HBc阳转者为57例,阳转率为14.14%。T1时GMC为 < 100、100~和≥1 000 mU/ml者再免后8年的抗-HBc阳转率分别为25.00%(31/124)、12.26%(19/155)和5.65%(7/124),差异有统计学意义(χ2=19.86,P < 0.001)。
讨论既往研究显示,健康成年人在完成HepB免疫后可获得较好的抗体持久性[15-18],但这些研究对象通常多为初免产生应答者或应答不明者,而对于初免无应答者再免的抗体持久性报道较少,其原因可能在于HepB初免后无应答发生率较低,招募较多数量的无应答者较为困难。依靠国家科技重大专项的支持,本课题组于2010年在济南市章丘区建立了社区健康成年人HepB初免不同应答状态观察固定队列,8 000多例的队列规模大、基础信息清晰、随访时间点多;该队列长期以来持续开展HepB免疫保护效果和抗体持久性观察,已有多篇文献报道[8, 10-11, 17, 19-23]。本次研究在此基础上,重点对初免无应答者再免后8年的随访结果进行分析,以期为科学制定我国乙肝疫苗无应答成年人免疫策略提供参考依据。
普遍认为抗-HBs≥10 mIU/ml即能保护人体免受HBV的感染[1],本研究对成年人HepB初免无应答者在完成3剂次HepB再免后8年的随访结果显示,仍有50%以上随访对象抗-HBs维持在保护水平以上。有学者认为,接种HepB产生应答一定时间后,即使抗-HBs水平下降至 < 10 mIU/ml,但由于机体免疫细胞存在免疫记忆,仍可提供保护[24-25]。突破性感染分析发现,再免后8年仅出现极少者抗-HBc阳转,并未发现HBsAg阳转者,提示成年人HepB初免无应答者可完全受益于3剂次再免策略,不仅可以提高其初始抗-HBs应答率,亦能提供长期的抗体持久性保护。本研究发现,影响成年人HepB再免后抗体持久性的关键因素为再免T1时的抗-HBs GMC水平,与本队列在再免随访2年、4年时的结果一致[10-11],表明对于成年人HepB初免无应答者,应优先选取为提高T1抗-HBs水平的再免策略。
本研究进一步分析显示,成年人HepB初免无应答者在完成3剂次HepB再免后的T1至8年期间,抗-HBs水平变化呈明显的3个阶段,第一阶段(再免后T1至2年内)抗-HBs阳性率和GMC均呈现急剧衰减,第二阶段(再免后2~4年)抗体呈现缓慢下降趋势,第三阶段(再免后5~8年)抗体阳性率和GMC相对稳定,前后变化不大。本研究结果与既往同期观察的初免正常(高)应答队列抗体持久性趋势相近[17, 23],提示尽管少部分成年人可能因个人生理状态、环境因素、自身遗传因素等原因,在常规3剂次HepB免疫后未能诱导应答[26-27],但再免后产生应答者的抗体衰减规律与初免正常应答者并无明显差异。
本研究存在不足。一是因农村成年人人口流动性大、随访间隔时间长等原因,研究对象随访率仅约60%,且本研究仅对随访组和总体对象的年龄、性别特征进行一致性比较,未对其他特征如T1时的抗-HBs水平进行比较,可能存在失访偏倚,但本研究通过多因素回归分析已观测了各变量独立作用的影响。二是本研究队列建立时,因各种原因所致未能对筛选出的无应答者设立未再免者作为对照,难以综合评价成年人初免无应答者再免疫策略的HBV感染预防保护效果。HepB无应答不仅对HBV高风险人群有重要影响,甚至可能阻碍我国乙肝的快速消除。本研究证实成年人HepB初免无应答可受益于3剂次再免策略,不仅可改善初始免疫反应,且再免后8年多数人仍具有良好的抗体持久性,其抗体持久性主要与再免后1个月时的抗体水平有关,这为制定和完善我国成年人HepB初免无应答这一特殊人群有效的免疫策略提供了数据支持。应继续对该队列人群进行随访,以探讨成年人HepB初免无应答者再免的长期保护效果。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
World Health Organization. Hepatitis B vaccines: WHO position paper, July 2017-Recommendations[J]. Vaccine, 2019, 37(2): 223-225. DOI:10.1016/j.vaccine.2017.07.046 |
| [2] |
Liang XF, Bi SL, Yang WZ, et al. Reprint of: epidemiological serosurvey of hepatitis B in China-declining HBV prevalence due to hepatitis B vaccination[J]. Vaccine, 2013, 31(Suppl 9): J21-28. DOI:10.1016/j.vaccine.2013.08.012 |
| [3] |
Liu J, Zhang SK, Wang QM, et al. Seroepidemiology of hepatitis B virus infection in 2 million men aged 21-49 years in rural China: a population-based, cross-sectional study[J]. Lancet Infect Dis, 2016, 16(1): 80-86. DOI:10.1016/S1473-3099(15)00218-2 |
| [4] |
朱大伟, Wangen KR, 王健, 等. 中国农村地区成人乙肝疫苗接种及影响因素[J]. 中国公共卫生, 2012, 28(10): 1291-1293. Zhu DW, Wangen KR, Wang J, et al. Influencing factors of vaccination of hepatitis B vaccine in rural adults in China[J]. Chin J Public Health, 2012, 28(10): 1291-1293. DOI:10.11847/zgggws2012-28-10-10 |
| [5] |
Vermeiren APA, Hoebe CJPA, Dukers-Muijrers NHTM. High non-responsiveness of males and the elderly to standard hepatitis B vaccination among a large cohort of healthy employees[J]. J Clin Virol, 2013, 58(1): 262-264. DOI:10.1016/j.jcv.2013.07.003 |
| [6] |
Walayat S, Ahmed Z, Martin D, et al. Recent advances in vaccination of non-responders to standard dose hepatitis B virus vaccine[J]. World J Hepatol, 2015, 7(24): 2503-2509. DOI:10.4254/wjh.v7.i24.2503 |
| [7] |
Roukens AH, Visser LG. Hepatitis B vaccination strategy in vaccine low and non-responders: a matter of quantity of quality?[J]. Hum Vaccin, 2011, 7(6): 654-657. DOI:10.4161/hv.7.6.14986 |
| [8] |
Zhang L, Liu JY, Lu JJ, et al. Antibody response to revaccination among adult non-responders to primary Hepatitis B vaccination in China[J]. Hum Vaccin Immunother, 2015, 11(11): 2716-2722. DOI:10.1080/21645515.2015.1045172 |
| [9] |
Raven SFH, Hoebe CJPA, Vossen ACTM, et al. Serological response to three alternative series of hepatitis B revaccination (Fendrix, Twinrix, and HBVaxPro-40) in healthy non-responders: a multicentre, open-label, randomised, controlled, superiority trial[J]. Lancet Infect Dis, 2020, 20(1): 92-101. DOI:10.1016/S1473-3099(19)30417-7 |
| [10] |
张丽, 吕静静, 颜丙玉, 等. 乙型肝炎疫苗初次免疫成年无应答者再次免疫后24个月免疫持久性观察[J]. 中华预防医学杂志, 2015, 49(9): 782-787. Zhang L, Lyu JJ, Yan BY, et al. Anti-HBs persistence after revaccination with three doses of hepatitis B vaccines among non-responsive adults: 24-month of follow-up[J]. Chin J Prev Med, 2015, 49(9): 782-787. DOI:10.3760/cma.j.issn.0253-9624.2015.09.005 |
| [11] |
张丽, 颜丙玉, 吕静静, 等. 乙型肝炎疫苗初次免疫成年无应答者再次免疫后4年抗体持久性观察[J]. 中华预防医学杂志, 2016, 50(6): 497-502. Zhang L, Yan BY, Lyu JJ, et al. Anti-HBs persistence after revaccination with three doses of hepatitis B vaccine among non-responsive adults: a 4-year of follow-up study[J]. Chin J Prev Med, 2016, 50(6): 497-502. DOI:10.3760/cma.j.issn.0253-9624.2016.06.005 |
| [12] |
中国肥胖问题工作组数据汇总分析协作组. 我国成人体重指数和腰围对相关疾病危险因素异常的预测价值: 适宜体重指数和腰围切点的研究[J]. 中华流行病学杂志, 2002, 23(1): 5-10. Coorperative Meta-analysis Group of China Obesity Task Force. Predictive values of body mass index and waist circumference to risk factors of related diseases in Chinese adult population[J]. Chin J Epidemiol, 2002, 23(1): 5-10. DOI:10.3760/j.issn:0254-6450.2002.01.003 |
| [13] |
Chang MH. Breakthrough HBV infection in vaccinated children in Taiwan: surveillance for HBV mutants[J]. Antivir Ther, 2010, 15(3Pt B): 463-469. DOI:10.3851/IMP1555 |
| [14] |
Hadler SC, de Monzon MA, Lugo DR, et al. Effect of timing of hepatitis B vaccine doses on response to vaccine in Yucpa Indians[J]. Vaccine, 1989, 7(2): 106-110. DOI:10.1016/0264-410x(89)90046-7 |
| [15] |
van Damme P, Leroux-Roels G, Crasta P, et al. Antibody persistence and immune memory in adults, 15 years after a three-dose schedule of a combined hepatitis A and B vaccine[J]. J Med Virol, 2012, 84(1): 11-17. DOI:10.1002/jmv.22264 |
| [16] |
van Damme P, Dionne M, Leroux-Roels G, et al. Persistence of HBsAg-specific antibodies and immune memory two to three decades after hepatitis B vaccination in adults[J]. J Viral Hepat, 2019, 26(9): 1066-1075. DOI:10.1111/jvh.13125 |
| [17] |
吴文龙, 颜丙玉, 吕静静, 等. 乙型肝炎疫苗初次免疫成年正常应答和高应答者5年抗体持久性观察[J]. 中华预防医学杂志, 2016, 50(6): 484-490. Wu WL, Yan BY, Lyu JJ, et al. Antibody persistence following primary vaccination with hepatitis B vaccine among normal and high-responder adults: a 5-year follow-up study[J]. Chin J Prev Med, 2016, 50(6): 484-490. DOI:10.3760/cma.j.issn.0253-9624.2016.06.003 |
| [18] |
张丽, 颜丙玉, 吕静静, 等. 成人乙型肝炎疫苗接种后12年免疫记忆持久性及相关因素分析[J]. 中华预防医学杂志, 2019, 53(5): 497-502. Zhang L, Yan BY, Lyu JJ, et al. Persistence of immune memory and its related factors at 12 years after hepatitis B vaccination among adults[J]. Chin J Prev Med, 2019, 53(5): 497-502. DOI:10.3760/cma.j.issn.0253-9624.2019.05.012 |
| [19] |
Zhang L, Yan BY, Lv JJ, et al. Antibody response to hepatitis B vaccine is independently associated with hepatitis B breakthrough infection among adults: Results from a three-year follow-up study in China[J]. Vaccine, 2018, 36(16): 2207-2212. DOI:10.1016/j.vaccine.2018.02.039 |
| [20] |
Wu WL, Lv JJ, Liu JY, et al. Persistence of immune memory among adults with normal and high antibody response to primary hepatitis B vaccination: Results from a five-year follow-up study in China[J]. Hum Vaccin Immunother, 2018, 14(10): 2485-2490. DOI:10.1080/21645515.2018.1477911 |
| [21] |
颜丙玉, 张丽, 吕静静, 等. 成人重组酿酒酵母和汉逊酵母乙型肝炎疫苗免疫应答及相关因素研究[J]. 中华流行病学杂志, 2012, 33(9): 988-989. Yan BY, Zhang L, Lyu JJ, et al. Comparison of the antibody response and related influencing factors after primary immunization by 10μg hepatitis B vaccine made from recombinant DNA techniques in saccharomyces and hansenula polymorpha among adults[J]. Chin J Epidemiol, 2012, 33(9): 988-989. DOI:10.3760/cma.j.issn.0254-6450.2012.09.025 |
| [22] |
颜丙玉, 吕静静, 刘甲野, 等. 成年人乙型肝炎疫苗低应答者加强免疫后24个月免疫持久性研究[J]. 中华预防医学杂志, 2014, 48(12): 1043-1047. Yan BY, Lyu JJ, Liu JY, et al. Antibody persistence following booster vaccination with three doses of hepatitis B vaccines among low-response adults in Zhangqiu county of Shandong province: 24-month of follow-up from 2009[J]. Chin J Prev Med, 2014, 48(12): 1043-1047. DOI:10.3760/cma.j.issn.0253-9624.2014.12.005 |
| [23] |
吕静静, 张丽, 颜丙玉, 等. 乙型肝炎疫苗初次免疫成年正常应答和高应答者3年抗体持久性观察[J]. 中华预防医学杂志, 2016, 50(6): 478-483. Lyu JJ, Zhang L, Yan BY, et al. Anti-HBs persistence following primary vaccination with three doses of hepatitis B vaccine among normal and high-responder adults: a 3-year follow-up study[J]. Chin J Prev Med, 2016, 50(6): 478-483. DOI:10.3760/cma.j.issn.0253-9624.2016.06.002 |
| [24] |
Leuridan E, van Damme P. Hepatitis B and the need for a booster dose[J]. Clin Infect Dis, 2011, 53(1): 68-75. DOI:10.1093/cid/cir270 |
| [25] |
Bauer T, Jilg W. Hepatitis B surface antigen-specific T and B cell memory in individuals who had lost protective antibodies after hepatitis B vaccination[J]. Vaccine, 2006, 24(5): 572-577. DOI:10.1016/j.vaccine.2005.08.058 |
| [26] |
Boland GJ, van Bommel T, van den Berg AR, et al. The efficacy of a two-dose hepatitis B vaccination scheme[M]//Marzuki S, Verhoef J, Snippe H. Tropical diseases: from molecule to bedside. Boston: Springer, 2003: 185-190. DOI: 10.1007/978-1-4615-0059-9_14.
|
| [27] |
Newport MJ, Goetghebuer T, Weiss HA, et al. Genetic regulation of immune responses to vaccines in early life[J]. Genes Immun, 2004, 5(2): 122-129. DOI:10.1038/sj.gene.6364051 |
 2021, Vol. 42
2021, Vol. 42