文章信息
- 罗明, 龚成, 罗琴, 李爱华, 王雪, 李茂中, 谢会, 王怡婷, 张合润, 黄芳.
- Luo Ming, Gong Cheng, Luo Qin, Li Aihua, Wang Xue, Li Maozhong, Xie Hui, Wang Yiting, Zhang Herun, Huang Fang
- 2015-2019年北京市肺炎衣原体流行特征分析
- Epidemiological characteristics of Chlamydia pneumoniae in cases with acute respiratory infection in Beijing, 2015-2019
- 中华流行病学杂志, 2021, 42(8): 1466-1474
- Chinese Journal of Epidemiology, 2021, 42(8): 1466-1474
- http://dx.doi.org/10.3760/cma.j.cn112338-20210522-00421
-
文章历史
收稿日期: 2021-05-22
2. 首都医科大学公共卫生学院, 北京 100069
2. School of Public Health, Capital Medical University, Beijing 100069, China
肺炎衣原体(Chlamydia pneumoniae),属于衣原体科(Chlamydiaceae)衣原体属(Chlamydia)[1],是一种严格的专性真核细胞内寄生的原核生物,通过飞沫或呼吸道分泌物形成人际传播,扩散较为缓慢,潜伏期约30 d。肺炎衣原体是引起间质性肺炎的常见和重要病原体之一[2-3],感染具有散发和流行交替出现的特点,感染后免疫力不强,为时短暂,易造成持续感染、反复感染或隐性感染[4-5]。除感染呼吸道外,还可通过血液循环途径感染心脑血管系统,与冠状动脉粥样硬化、阿尔茨海默病、心肌炎等心脑疾病密切相关[6-15]。
根据肺炎衣原体外膜蛋白A基因(ompA)的VD4可变区可将肺炎衣原体分为A、B、C、D 4种基因型[16]。其细胞壁缺乏肽聚糖,革兰染色阴性,常规抑制细胞壁合成的抗生素(如青霉素类或头孢类抗生素)对治疗肺炎衣原体感染无效,临床常使用大环内酯类、四环素类和氟喹诺酮类等药物[17]。肺炎衣原体在人群中感染较普遍,全球60%~80%成年人一生中至少有1次被感染[18],血清学结果显示成年人感染率超过50%,年长者血清阳转率甚至可超过75%[19]。目前,关于肺炎衣原体长期、较大规模的监测较少,对其流行的季节性、流行强度、好发人群、优势基因型等重要的流行病学特征还缺乏系统的研究。本研究依托北京市呼吸道病原监测系统(Respiratory Pathogen Surveillance System,RPSS),选择北京市有代表性的35家哨点医院,自2015年1月开始,对急性呼吸道感染人群中肺炎衣原体的感染情况进行持续监测,系统分析北京市肺炎衣原体的流行特征。
对象与方法1. 研究对象:依托北京市RPSS,从北京市35家不同类型和等级的哨点医院收集2015年1月至2019年12月间具有代表性的急性呼吸道感染就诊患者的标本。肺炎和重症肺炎的诊断标准依据文献[20-22]。所有患者入组后由主管医师进行个案调查,主要包括人口学资料、流行病学资料、临床资料、影像检查资料、实验室检查等资料。并尽早采集呼吸道标本(门诊病例在就诊时采集,住院病例在入院3 d内采集),呼吸道标本类型包括咽拭子、鼻咽拭子、鼻咽抽吸物、痰液、胸腔积液、气管抽吸物或肺泡灌洗液等。本研究方案经北京市CDC伦理委员会审批,所有入组患者或其监护人签署知情同意书,研究对象均完成知情同意。
2. 实验室检测:哨点医院采集的标本送至北京市CDC进行检测。除检测肺炎衣原体外,还对上呼吸道标本(咽拭子、鼻咽拭子、鼻咽抽吸物)进行肺炎支原体(江苏和创生物科技有限公司,肺炎支原体和肺炎衣原体核酸双重检测试剂盒,货号CN09-4-100)和15种病毒(甲型H1N1流感病毒、甲型H3N2流感病毒、乙型流感病毒、呼吸道合胞病毒、腺病毒、鼻病毒、副流感病毒1、2、3和4型、冠状病毒OC43/NL63、冠状病毒229E/HKU1、博卡病毒、人偏肺病毒、肠道病毒)[江苏和创生物科技有限公司,呼吸道病毒核酸多重联检试剂盒,货号CN12-33-100;肠道病毒(通用型和D68型)核酸双重检测试剂盒,货号CN08-4G-100]的检测;对下呼吸道标本(痰液、胸腔积液、气管抽吸物、肺泡灌洗液等)在上述16种病原体基础上增加13种呼吸道细菌(嗜麦芽窄食单胞菌、化脓性链球菌、金黄色葡萄球菌、肺炎克雷伯菌、流感嗜血杆菌、嗜肺军团菌、结核分枝杆菌、鲍曼不动杆菌、卡他莫拉菌、大肠埃希菌、肺炎链球菌、铜绿假单胞菌、肺囊虫)(江苏和创生物科技有限公司,呼吸道细菌核酸多重联检试剂盒,货号CN13-3-100)的检测。并对肺炎衣原体阳性标本的主要外膜蛋白基因(ompA)片段的VD4区进行基因扩增和序列测定[16, 23](表 1)。
采用Invitrogen公司的Invitrogen™ Platinum™ Hot Start PCR 2×Master Mix试剂(货号00962672)对上述标本进行ompA基因的VD4区扩增,反应总体积25 μl,2×Master Mix 12.5 μl,外部引物P1、P2(10 μmol/L)分别0.5 µl,DEPC水1.5 µl,GC Enhancer 5 µl,模板5 µl。反应条件:94 ℃ 2 min预变性;94 ℃ 30 s变性;55 ℃ 30 s退火;72 ℃ 1 min延伸,35个循环。取扩增产物1 µl做模板,用内部引物P3、P4(10 μmol/L)进行第2次扩增,扩增体系及条件同上。扩增产物进行双向测序。
3. 基因进化分析:通过NCBI的GenBank下载肺炎衣原体4个基因型的参考株,将测序完成的ompA基因的VD4区序列,与肺炎衣原体的4个基因型参考序列做进化分析:肺炎衣原体A选择肺炎衣原体J138(GenBank:BA000008.3)、肺炎衣原体TW-183(GenBank:AE009440.1)作为参考株基因型;肺炎衣原体B的GenBank序列号为AY426606.1;肺炎衣原体C的GenBank序列号为AY426607.1;肺炎衣原体D选择Koala type 1(Genbank:X72023.1)基因型。为使进化树的构建更加稳健,同时补充了5条与参考株同源性较高的序列,其中2条与A型同源(LN847246.1、LN847254.1),3条与D型同源(GQ918220.1、GQ918221.1、DQ358972.1),选用最大似然法,全部分析用Mega 7.0软件完成。
4. 统计学分析:数据录入采用EpiData 3.1软件双录入(北京京路通信息技术有限公司),采用SPSS 21.0软件进行统计学分析。符合正态分布的计量资料采用x±s描述,非正态连续变量偏态分布资料则用M(P25,P75)描述,定性资料用频数和百分数描述;不同组之间率或构成比的比较采用χ2检验,肺炎衣原体阳性率与年龄的关系用限制性立方样条(restricted cubic spline,RCS)方法分析,采用R 4.0.5与rms软件包分析。双侧检验,检验水准α=0.05。
结果1. 一般情况:35家哨点监测医院覆盖北京市16个城区,包括综合性医院34家、专科医院1家、三级医院25家、二级医院10家。从2015年1月1日至2019年12月31日,共对37 460例急性呼吸道感染就诊患者进行调查和采样,其中上呼吸道感染患者10 465人、普通肺炎患者20 509人、重症肺炎患者5 164人。每月监测患者平均624(95%CI:605~644)例;男性患者占52.7%,基本符合我国男性略多于女性的人口结构;冬-春季呼吸道高流行期的标本采集数略多于春-夏季。年龄M(P25,P75)为37(8,68)岁。37 460例患者中,肺炎衣原体总体阳性率为0.34%(129/37 460)。
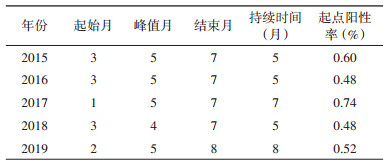
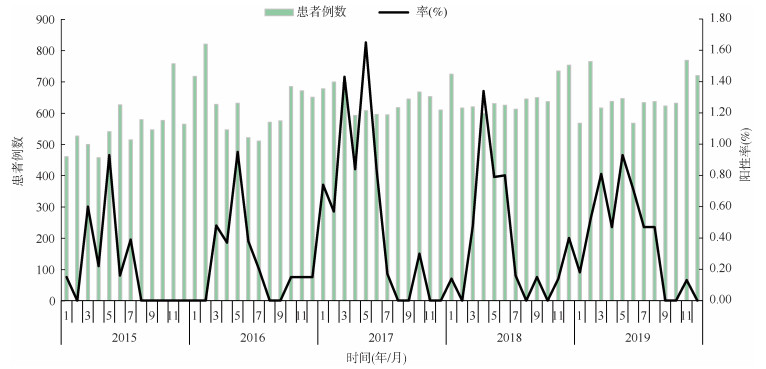
2. 季节分布:2015-2019年,肺炎衣原体在北京市急性呼吸道感染就诊患者中每年呈单峰模式流行。一般每年3月份阳性率明显增加,5月份达到峰值,7月份开始回落。肺炎衣原体高阳性率持续时间约5~8个月,不同年份可能提前或推迟1~2个月。2015、2016和2018年,高阳性率从每年3月持续到同年7月,而2017年阳性率高峰为1-7月、2019年阳性率高峰为2-8月(表 2、图 1)。高流行期每月阳性率最小值不低于0.30%(表 2)。
|
| 图 1 2015-2019年北京市急性呼吸道感染患者中肺炎衣原体感染者时间分布 |
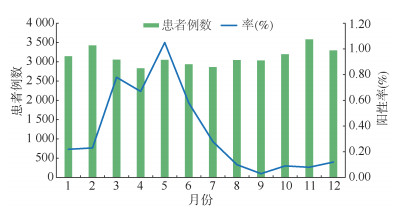
各年的合计阳性率分别为0.18%、0.23%、0.55%、0.36%和0.38%。2017年阳性率最高,其中5月份为历年最高(1.65%)。肺炎衣原体高流行期(3-7月)检出的肺炎衣原体月阳性率均值依次为0.78%、0.67%、1.05%、0.58%和0.28%(图 2)。
|
| 图 2 2015-2019年北京市急性呼吸道感染就诊患者中肺炎衣原体检测月阳性率均值 |
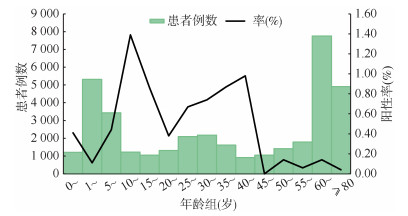
3. 不同人群肺炎衣原体的检出情况:5~44岁人群肺炎衣原体阳性率较高,45岁以后的阳性率下降至较低水平。各年龄组之间的差异有统计学意义(χ2=117.709,P < 0.01),其中10~14岁组的阳性率最高,为1.39%(图 3)。129例肺炎衣原体感染者的年龄M(P25,P75)为26(10,37)岁。
|
| 图 3 2015-2019年北京市各年龄组急性呼吸道感染患者中肺炎衣原体阳性率 |
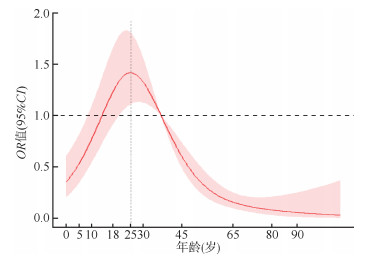
为进一步了解肺炎衣原体阳性率与年龄的关系,RCS分析结果显示,< 25岁患者中,随着年龄增加,肺炎衣原体的感染风险增加;> 25岁患者中,随着年龄增加,肺炎衣原体的感染风险降低(图 4),与阳性患者年龄中位数分布基本一致。
|
| 图 4 2015-2019年北京市肺炎衣原体阳性率与年龄关系的限制性立方样条分析 |
男、女性患者阳性率分别为0.33%(68/20 830)和0.37%(61/16 528),组间差异无统计学意义(χ2=0.486,P=0.486)(图 3)。各类型的呼吸道患者中,普通肺炎患者的阳性率(0.52%,107/20 509)明显高于上呼吸道感染患者(0.11%,12/10 465)和重症肺炎患者(0.19%,10/5 164)(χ2=36.797,P < 0.01)(图 4)。但若考虑到重症肺炎均应由普通肺炎发展而来,间接推算由普通肺炎进展为重症肺炎的概率为26.8%[0.19%/(0.19%+0.52%)]。
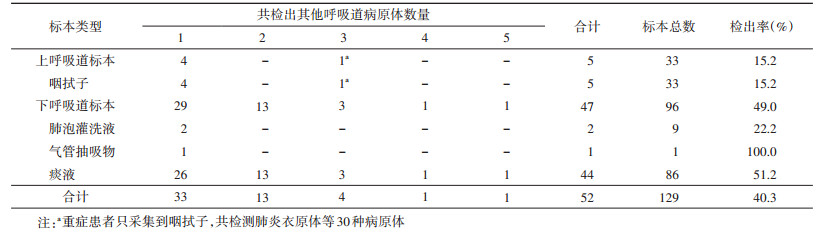
4. 肺炎衣原体感染者中其他呼吸道病原体共检出情况:共40.3%(52/129)的肺炎衣原体感染者标本中同时检测到其他呼吸道病原体的核酸,其中47例为下呼吸道标本,其余5例为咽拭子标本。52份标本中,33份标本同时检出1种其他呼吸道病原体,13份同时检出2种,6份同时检出≥3种,阳性率位居前4位的分别为流感嗜血杆菌(15份)、肺炎链球菌(13份)、鼻病毒(8份)、嗜麦芽窄食单胞菌(7份)(表 3)。
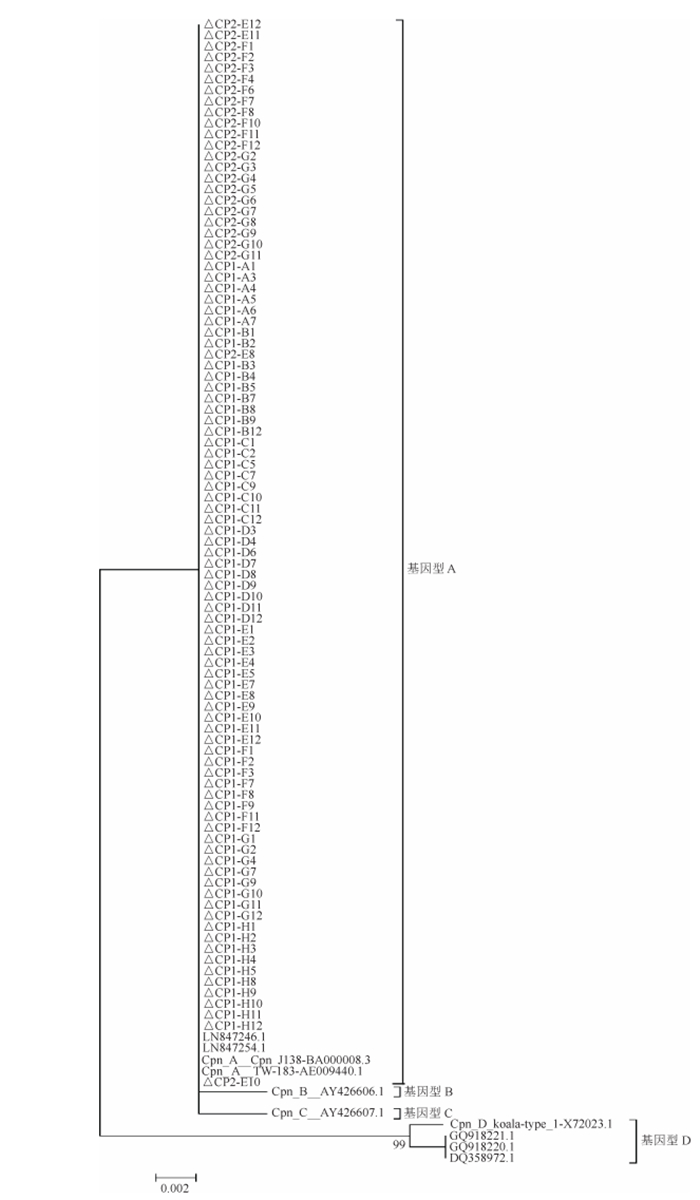
5. 基因进化分析:129份肺炎衣原体阳性患者标本中,101例患者标本完成ompA基因的VD4区测序,与A、B、C、D型参考株进行同源性比对和系统进化分析[16]。结果显示,101株ompA基因序列间同源性达100%,系统进化分析结果显示,均为A型(图 5)。
|
| 图 5 2015-2019年北京市肺炎衣原体阳性株ompA基因VD4区基因扩增进化树 |
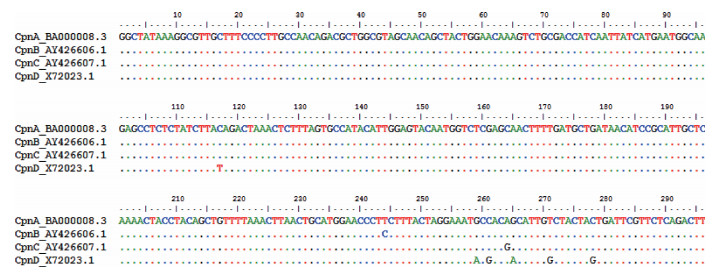
序列比对结果显示,与肺炎衣原体A型相比,肺炎衣原体B型的ompA基因VD4区仅发生1个点突变:T244C;肺炎衣原体C型的ompA基因VD4区也仅发生1个点突变:A264G;但肺炎衣原D型的ompA基因VD4区却发生6个点突变:C117T、G259A、C261G、G265A、G271T、C278G。见图 6。
|
| 注:圆点表示相同的碱基;肺炎衣原体A基因型参考株序列:J138、BA000008.3;肺炎衣原体B基因型参考株序列:AY426606.1;肺炎衣原体C基因型参考株序列:AY426607.1;肺炎衣原体D基因型参考株序列:Koala type 1、X72023.1 图 6 2015-2019年北京市肺炎衣原体不同基因型的ompA基因VD4区基因变异情况 |
本研究发现,北京市肺炎衣原体每年呈典型的单峰流行模式,存在明显的流行高峰,一般3月份肺炎衣原体阳性率明显增高,5月份达到峰值,7月份开始回落。这与既往肺炎衣原体无季节性特征的研究报道不一致[24],不排除与研究目标人群存在差异或者与肺炎衣原体发病率较低、监测入组病例数过少、监测时间短导致阳性率的值不稳定有关。本研究纳入的哨点医院覆盖了北京市的全部16个城区,含35家二级和三级医院,研究时间长达5年,研究对象累积数达3.7万余人,其中肺炎衣原体感染者共129例,从流行病学、实验室检查两方面收集资料并进行系统分析,大数据的研究结果对急性呼吸道感染就诊患者中肺炎衣原体的感染具有较好的代表性。研究还发现,不同年份流行期可能提前或推迟1~2个月,本研究5年的监测数据表明,2017年阳性率明显高于前后2年,提示肺炎衣原体可能具有一定的流行周期性,每隔几年出现一个高流行年,随着监测工作的持续进行,这一点将逐渐明朗。
肺炎衣原体和肺炎支原体均可引起间质性肺炎,且好发人群也相似,临床上常对两者进行鉴别诊断。本研究发现,北京市肺炎衣原体流行季主要在上半年(3-7月)。而据Gong等[25]报道北京市肺炎支原体流行季主要在下半年(8-12月)。这种流行季时间差可为临床肺炎衣原体和肺炎支原体鉴别诊断提供帮助。
2015-2019年监测数据表明,高流行季时,北京市RPSS的肺炎衣原体阳性率均≥0.30%,由此初步提出:北京市肺炎衣原体流行季的阳性率阈值为0.30%,即连续2个月肺炎衣原体阳性率≥0.30%,可认为北京市进入了肺炎衣原体的流行季。该阈值的准确性还有待后续监测工作的进一步验证,如果得到证实,可辅助识别肺炎衣原体的流行高峰,对于肺炎衣原体的监测具有较重要的价值,可为肺炎衣原体可能的大规模流行甚至暴发提供预警。事实上,美国CDC在呼吸道合胞病毒的监测中也采用类似的办法,他们认为只要呼吸道合胞病毒阳性率连续2周超过10%,就可判定为进入呼吸道合胞病毒的流行季[26]。
研究还发现,肺炎衣原体感染风险与年龄呈非线型关系,RCS分析发现:< 25岁人群,随着年龄增加,肺炎衣原体感染风险增加;≥25岁人群,随着年龄增加,肺炎衣原体感染风险降低。分年龄组分析发现:5~44岁人群高发;其中10~14岁组阳性率最高,可能与该年龄组样本采集量相对偏低有关;年龄中位数为26岁。这与肺炎支原体患者的年龄分布相似[25],即免疫系统发育成熟、身体条件较好的人群反而发病率高,原因还有待进一步研究。而大多数感染性疾病,如呼吸道合胞病毒,通常是患者年龄分布呈现出两头高的特点,即儿童和老年人发病率较高,青壮年较低[25]。RCS与分年龄组分析结果有一定的联系也不完全相同,一方面RCS本质上是采用分段函数进行局部logit光滑曲线拟合,对局部变化敏感,定位更准确[27],后者为传统方法,为大多数传染病在研究年龄与发病时采用,便于与同类研究进行比较,但是对年龄与发病真实联系反映较为粗糙,受限于主观分组的差异。近年来在Lancet、BMJ等杂志经常见到利用RCS来拟合非线性关系。
本研究发现,40.3%肺炎衣原体感染者的标本中检出1种及以上其他呼吸道病原体,其中下呼吸道标本多种病原体共存的情况更为普遍,这些共存的病原体,可能只是局部定植,也可能与肺炎衣原体共同参与了致病过程,形成混合感染,提示临床治疗肺炎衣原体导致的感染,特别是下呼吸道感染时,要警惕混合感染的可能。如何证明患者是由肺炎衣原体感染导致的就诊,还需要通过后续的血清学研究予以证实。
研究结果显示肺炎衣原体的总体阳性率较低,可能与监测范围的偏性有关。本研究是基于医院,而不是基于社区开展,且仅纳入了二、三级医院,因此不排除低估了前往一级及社区医院就诊的轻症患者的肺炎衣原体感染率。在后续研究中,还可补充轻症、甚至无症状人群的相关监测,探索北京市肺炎衣原体的流行情况,让研究结论更具代表性。同时,基于普通肺炎和重症肺炎的肺炎衣原体阳性率推算肺炎衣原体感染发生肺炎后进展为重症肺炎的概率达26.8%,虽非较为可靠的前瞻性研究,但仍旧提示较高进展率的可能。与既往文献报道较吻合:Balis等[28]、File和Tan[29]报道老年人或有基础疾病的患者罹患肺炎衣原体肺炎后病情较危重,常需住院治疗甚至入住ICU;黄海辉等[30]报道与肺炎支原体感染者多在门诊接受治疗相比,肺炎衣原体感染者住院或入住ICU者更为多见。而对于既往认知为不易发展为重症肺炎的肺炎衣原体,可能与临床中存在较多误诊、早期使用常规抗生素而贻误治疗有关。
肺炎衣原体除了引起呼吸道感染外,还可能引起心脑血管疾病[6-15],应该引起足够的重视。疫苗是预防传染病的最有效武器,目前尚无一种人用肺炎衣原体疫苗获得上市许可,部分人用肺炎衣原体疫苗正处于临床试验阶段[31]。不同的肺炎衣原体基因型感染宿主范围存在一定的差异,而且有着明显的地理分布特点[32]。本研究发现,2015-2019年北京市肺炎衣原体流行基因型为A型,不同于郑江花等[33]报道的南方部分地区以C基因型为优势流行株,这可能与气候(亚热带-温带)、地域等因素不同有关,这一点也可为疫苗研制提供参考。
综上所述,北京市肺炎衣原体每年呈单峰流行模式,流行季一般为3-7月,流行季节特征可用于与其他呼吸道病原体的鉴别诊断,5~44岁人群好发,基因型以A型为主;如果连续2个月肺炎衣原体核酸阳性率超过0.30%,可初步认为进入肺炎衣原体高流行期;肺炎衣原体感染发生肺炎后进展为重症肺炎的概率较高。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
阮继生. “伯杰氏系统细菌学手册(第二版)”第5卷与我国的放线菌系统学研究[J]. 微生物学报, 2013, 53(6): 521-530. DOI: CNKI:SUN:WSXB.0.2013-06-002. Ruan JS. Bergey's Manual of Systematic Bacteriology (second edition) Volume 5 and the study of Actinomycetes systematic in China[J]. Acta Microbiol Sin, 2013, 53(6): 521-530. DOI: CNKI:SUN:WSXB.0.2013-06-002. |
| [2] |
Hermann C, Graf K, Groh A, et al. Comparison of eleven commercial tests for Chlamydia pneumoniae-specific immunoglobulin G in asymptomatic healthy individuals[J]. J Clin Microbiol, 2002, 40(5): 1603-1609. DOI:10.1128/jcm.40.5.1603-1609.2002 |
| [3] |
Marr JS, Cathey JT. A century in the life of the control of communicable diseases manual: 1917 to 2017[J]. J Public Health Manag Pract, 2016, 22(6): 597-602. DOI:10.1097/PHH.0000000000000435 |
| [4] |
陈浩. 衣原体致病机制研究进展[J]. 中国免疫学杂志, 2018, 34(5): 780-785. Chen H. Progress of research on pathogenic mechanisms in Chlamydia[J]. Chin J Immunol, 2018, 34(5): 780-785. DOI:10.3969/j.issn.1000-484X.2018.05.028 |
| [5] |
Hammerschlag MR, Chirgwin K, Roblin PM, et al. Persistent infection with Chlamydia pneumoniae following acute respiratory illness[J]. Clin Infect Dis, 1992, 14(1): 178-182. DOI:10.1093/clinids/14.1.178 |
| [6] |
Kurz H, G pfrich H, Wabnegger L, et al. Role of Chlamydophila pneumoniae in children hospitalized for community-acquired pneumonia in Vienna, Austria[J]. Pediatr Pulmonol, 2009, 44(9): 873-876. DOI:10.1002/ppul.21059 |
| [7] |
Balin BJ, Little CS, Hammond CJ, et al. Chlamydophila pneumoniae and the etiology of late-onset Alzheimer's disease[J]. J Alzheimers Dis, 2008, 13(4): 371-380. DOI:10.3233/jad-2008-13403.DOI:10.3233/jad-2008-13403 |
| [8] |
Lim C, Hammond CJ, Hingley ST, et al. Chlamydia pneumoniae infection of monocytes in vitro stimulates innate and adaptive immune responses relevant to those in Alzheimer's disease[J]. J Neuroinflammation, 2014, 11: 217. DOI:10.1186/s12974-014-0217-0 |
| [9] |
Balin BJ, Gérard HC, Arking EJ, et al. Identification and localization of Chlamydia pneumoniae in the Alzheimer's brain[J]. Med Microbiol Immunol, 1998, 187(1): 23-42. DOI:10.1007/s004300050071 |
| [10] |
Li BW, Xia YP, Hu B. Infection and atherosclerosis: TLR-dependent pathways[J]. Cell Mol Life Sci, 2020, 77(14): 2751-2769. DOI:10.1007/s00018-020-03453-7 |
| [11] |
Almeida NCC, Queiroz MAF, Lima SS, et al. Association of Chlamydia trachomatis, C. pneumoniae, and IL-6 and IL-8 gene alterations with heart diseases[J]. Front Immunol, 2019, 10: 87. DOI:10.3389/fimmu.2019.00087 |
| [12] |
El Yazouli L, Criscuolo A, Hejaji H, et al. Molecular characterisation of Chlamydia pneumoniae associated to atherosclerosis[J]. Pathog Dis, 2017, 75(4): ftx039. DOI:10.1093/femspd/ftx039 |
| [13] |
Fong IW, Quinn T, Blessing E, et al. Collaborative multidisciplinary workshop report: what questions regarding the role of Chlamydia pneumoniae in atherosclerosis and cardiovascular disease need to be addressed utilizing animal models?[J]. J Infect Dis, 2000, 181(Suppl 3): S519-520. DOI:10.1086/315637 |
| [14] |
Di Pietro M, Filardo S, Cazzavillan S, et al. Could past Chlamydial vascular infection promote the dissemination of Chlamydia pneumoniae to the brain?[J]. J Biol Regul Homeost Agents, 2013, 27(1): 155-164. |
| [15] |
Campbell LA, Kuo CC, Grayston JT. Chlamydia pneumoniae and cardiovascular disease[J]. Emerg Infect Dis, 1998, 4(4): 571-579. DOI:10.3201/eid0404.980407 |
| [16] |
Cochrane M, Walker P, Gibbs H, et al. Multiple genotypes of Chlamydia pneumoniae identified in human carotid plaque[J]. Microbiology (Reading), 2005, 151(Pt 7): 2285-2290. DOI:10.1099/mic.0.27781-0 |
| [17] |
Blasi F, Tarsia P, Aliberti S, et al. Chlamydia pneumoniae and Mycoplasma pneumoniae[J]. Semin Respir Crit Care Med, 2005, 26(6): 617-624. DOI:10.1055/s-2005-925525 |
| [18] |
Peeling RW, Brunham RC. Chlamydiae as pathogens: new species and new issues[J]. Emerg Infect Dis, 1996, 2(4): 307-319. DOI:10.3201/eid0204.960406 |
| [19] |
施毅, 康晓明. 肺炎衣原体感染——一种新的呼吸系统致病原[J]. 中华结核和呼吸杂志, 1991, 14(4): 239-241. Shi Y, Kang XM. Chlamydia pneumoniae infection: a new pathogenic agent of respiratory system[J]. Chin J Tubercul Respir Dis, 1991, 14(4): 239-241. |
| [20] |
中华医学会呼吸病学分会. 中国成人社区获得性肺炎诊断和治疗指南(2016年版)[J]. 中华结核和呼吸杂志, 2016, 39(4): 253-279. Respiratory Society of Chinese Medical Association. Guidelines for the diagnosis and treatment of community-acquired pneumonia in adults in China (2016 edition)[J]. Chin J Tubercul Respir Dis, 2016, 39(4): 253-279. DOI:10.3760/cma.j.issn.1001-0939.2016.04.005 |
| [21] |
中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童社区获得性肺炎管理指南(2013修订)(上)[J]. 中华儿科杂志, 2013, 51(10): 745-752. Subspecialty Group of Respiratory Diseases, Society of Pediatrics, Chinese Medical Association, Editorial Board, Chinese Journal of Pediatrics. Guidelines for management of community acquired pneumonia in children (the revised edition of 2013) (Ⅰ)[J]. Chin J Pediatr, 2013, 51(10): 745-752. DOI:10.3760/cma.j.issn.0578-1310.2013.10.006 |
| [22] |
中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童社区获得性肺炎管理指南(2013修订)(下)[J]. 中华儿科杂志, 2013, 51(11): 856-862. Subspecialty Group of Respiratory Diseases, Society of Pediatrics, Chinese Medical Association, Editorial Board, Chinese Journal of Pediatrics. Guidelines for management of community acquired pneumonia in children (the revised edition of 2013) (Ⅱ)[J]. Chin J Pediatr, 2013, 51(11): 856-862. DOI:10.3760/cma.j.issn.0578-1310.2013.11.012 |
| [23] |
Bodetti TJ, Timms P. Detection of Chlamydia pneumoniae DNA and antigen in the circulating mononuclear cell fractions of humans and koalas[J]. Infect Immun, 2000, 68(5): 2744-2747. DOI:10.1128/iai.68.5.2744-2747.2000 |
| [24] |
Marrie TJ. Epidemiology of mild pneumonia[J]. Semin Respir Infect, 1998, 13(1): 3-7. |
| [25] |
Gong C, Zhang TG, Luo M, et al. Distribution of the atypical pathogens of community-acquired pneumonia to disease severity[J]. J Thorac Dis, 2018, 10(11): 5991-6001. DOI:10.21037/jtd.2018.10.50 |
| [26] |
Haynes AK, Prill MM, Iwane MK, et al. Respiratory syncytial virus-United States, July 2012-June 2014[J]. MMWR Morb Mortal Wkly Rep, 2014, 63(48): 1133-1136. |
| [27] |
罗剑锋, 金欢, 李宝月, 等. 限制性立方样条在非线性回归中的应用研究[J]. 中国卫生统计, 2010, 27(3): 229-232. Luo JF, Jin H, Li BY, et al. The application of restricted cubic spline in nonlinear regression[J]. Chin J Health Stat, 2010, 27(3): 229-232. DOI:10.3969/j.issn.1002-3674.2010.03.002 |
| [28] |
Balis E, Boufas A, Iliopoulos I, et al. Severe community-acquired pneumonia with acute hypoxemic respiratory failure due to primary infection with Chlamydia pneumoniae in a previously healthy adult[J]. Clin Infect Dis, 2003, 36(12): e155-157. DOI:10.1086/375063 |
| [29] |
File TM, Tan JS. Chlamydia pneumoniae pneumonia[J]. Semin Respir Crit Care Med, 2000, 21(4): 285-294. DOI:10.1055/s-2000-9857 |
| [30] |
黄海辉, 张婴元, 汪复, 等. 亚洲地区肺炎支原体和肺炎衣原体在成人社区获得性肺炎中的流行病学研究[J]. 中国感染与化疗杂志, 2008, 8(2): 89-93. Huang HH, Zhang YY, Wang F, et al. A prevalence analysis of Mycoplasma pneumoniae and Chlamydia pneumoniae in Asian adults with community-acquired pneumonia[J]. Chin J Infect Chemother, 2008, 8(2): 89-93. DOI:10.3321/j.issn:1009-7708.2008.02.002 |
| [31] |
Phillips S, Quigley BL, Timms P. Seventy years of Chlamydia vaccine research-limitations of the past and directions for the future[J]. Front Microbiol, 2019, 10: 70. DOI:10.3389/fmicb.2019.00070 |
| [32] |
Mitchell CM, Hutton S, Myers GSA, et al. Chlamydia pneumoniae is genetically diverse in animals and appears to have crossed the host barrier to humans on (at least) two occasions[J]. PLoS Pathog, 2010, 6(5): e1000903. DOI:10.1371/journal.ppat.1000903 |
| [33] |
郑江花, 刘庆中, 刘佳强, 等. 人咽拭子中肺炎嗜衣原体基因型的初步鉴定[J]. 中南医学科学杂志, 2012, 40(4): 357-359, 372. Zheng JH, Liu QZ, Liu JQ, et al. Identification of ompA genetype of Chlamydophila pneumoniae in human nasopharyngeal swabs[J]. J Med Sci Central South China, 2012, 40(4): 357-359, 372. DOI:10.3969/j.issn.2095-1116.2012.04.007 |
 2021, Vol. 42
2021, Vol. 42