文章信息
- 姚明宏, 贾玉龙, 任燕, 刘艳梅, 邹康, 林凯, 朱宁, 孙鑫.
- Yao Minghong, Jia Yulong, Ren Yan, Liu Yanmei, Zou Kang, Lin Kai, Zhu Ning, Sun Xin
- 特许医疗政策下的药械真实世界数据研究常见设计及其关键考虑
- Real-world data studies of medical products in the context of special healthcare policy: study designs and key considerations
- 中华流行病学杂志, 2021, 42(7): 1306-1311
- Chinese Journal of Epidemiology, 2021, 42(7): 1306-1311
- http://dx.doi.org/10.3760/cma.j.cn112338-20210201-00085
-
文章历史
收稿日期: 2021-02-01
2. 海南真实世界数据研究与评价重点实验室/海南真实世界数据研究院/海南博鳌乐城真实世界数据研究创新中心, 琼海 571435;
3. 海南博鳌先行区药品不良反应监测中心, 琼海 571435;
4. 海南省药品监督管理局, 海口 570216
2. Key Laboratory for Real World Data Research and Evaluation in Hainan/Real World Data Research Institute of Hainan/Real World Data Research and Innovation Center of Boao Lecheng, Qionghai 571435, China;
3. Center for Adverse Drug Reaction Monitoring of Boao Pilot Zone, Qionghai 571435, China;
4. National Medical Produets Administration, Haikou 570216, China
真实世界数据研究(real-world data study,RWS)已对医疗卫生决策的各个领域产生了广泛而深远的影响。RWS产生的真实世界证据(real-world evidence,RWE)已越来越多用于药械监管决策,美国食品药品监督管理局等发达国家或地区的监管部门正在全面快速推进与布局[1]。近年来,我国药监部门大力推动RWE在药械监管决策的应用与发展。国家药监局于2019年启动了“监管科学行动计划”,并发布了真实世界数据(real-world data,RWD)用于药械研发及审评审批的系列指导原则。这些指导原则明确了RWD在药械审评审批中的适用条件,其内容覆盖药械研发和监管的全生命周期,对促进我国药械研发、评价与监管起到积极作用。
博鳌乐城国际医疗旅游先行区(博鳌乐城)在国家海南自贸港战略的总体布局下,基于国家给予的特殊政策支持,允许临床急需进口的特许创新药械在博鳌乐城医疗机构“先行先试”,实现了特许创新药械国内外同步使用。在此基础上,产生了这些医疗产品在中国人群独有的临床实际使用数据,为开展基于RWD的特许创新药械审评审批实践提供了重要的数据资源。探索建立博鳌乐城特许创新药械RWD的研究模式,有助于加速特许创新药械的审评审批过程,进一步惠及国内广大患者。
因此,笔者以博鳌乐城为例,在国内外相关研究进展和监管部门出台的有关RWS指导原则/技术规范的基础上,结合博鳌乐城特殊政策环境和前期研究经验,系统总结了博鳌乐城特许创新药械RWS的常见设计类型,探讨了各设计类型在博鳌乐城特殊医疗政策环境中的关键考虑,以期为推动我国及博鳌乐城特许创新药械的RWS提供借鉴参考。
1. 博鳌乐城RWD产生的特殊政策和医疗环境:
海南博鳌乐城于2013年由国务院批准设立,被赋予特许医疗、特许经营、特许研究及特许国际交流的优惠政策,允许在国外已注册而国内未注册上市的临床急需创新药械产品在博鳌乐城先行使用。2019年6月,国家药监局与海南省政府联合启动了海南临床RWD应用试点工作,通过在博鳌乐城使用临床急需进口创新药械,开展RWS,为全国药品医疗器械审评审批制度改革提供新的途径和方法。2019年9月,国家发展改革委、国家卫生健康委、国家中医药局、国家药监局联合发布《关于支持建设博鳌乐城国际医疗旅游先行区的实施方案》,明确指出:对博鳌乐城临床急需少量进口创新药械在使用过程中积累的RWD可作为在中国申请注册的依据。同月,海南省政府办公厅和国家药监局综合司联合印发《海南博鳌乐城先行区临床真实世界数据应用试点工作实施方案、领导小组方案及专家工作组方案》,进一步明确了博鳌乐城创新药械RWS应用试点的工作内容。2020年3月,国家药监局宣布美国艾尔建公司“青光眼引流管”的注册申请成功通过审查,成为我国首个使用了境内RWD并成功获批上市的医疗器械产品,表明RWE可作为临床证据来源用于支持医疗产品注册。
博鳌乐城不仅允许来自全国各地医疗机构推荐的患者在博鳌乐城医疗机构接受特许创新药械的治疗,也是全国唯一允许患者带合理自用量的进口药品离开先行区回居住地使用的地区,患者后期治疗的所有随访可在当地医疗机构完成[2]。在博鳌乐城接受治疗的患者,产生的RWD包括3个部分:①患者在博鳌乐城就诊时产生的诊疗数据;②患者后期随访数据;③患者既往在其他医疗机构就诊时所产生的数据。
2. 博鳌乐城RWS设计的总体考虑与常见研究设计类型:
博鳌乐城因特许创新药械的独有性、患者来源的广泛性、特许医疗实施地点的独特性,使其在患者招募、诊疗和随访等方面与传统的医疗实践存在明显差异,最终形成了博鳌乐城特许创新药械RWD产生的多样性。此外,博鳌乐城所开展RWS的特许创新药械已具有国外临床研究证据。但因特许创新药械在国外既往研究证据质量的差异,博鳌乐城所开展的特许创新药械RWS用于上市申请时所需要的证据等级存在不同。因此,特许创新药械用于上市申请时,博鳌乐城所产生的RWE不应独立于国外既有临床研究证据;研究设计时,也应考虑整合博鳌乐城RWE和国外既有临床研究证据,构建创新药械上市申请的证据链条。
博鳌乐城特许创新药械的RWS设计类型存在多样性,这一方面是由于数据产生环境导致,另一方面是基于特许创新药械对证据的需求[3]。参考国内外监管部门所发布的RWS指导原则或规范,结合博鳌乐城特许诊疗政策,在博鳌乐城开展RWS的设计类型可包括单组目标值的实效性试验或观察性研究、基于外对照的实效性试验、实效性临床试验,以及在此基础上与传统随机对照临床试验(randomized controlled trial,RCT)的融合设计。本研究的不同设计类型所产生的证据均假设获得高质量的真实世界数据。见图 1。
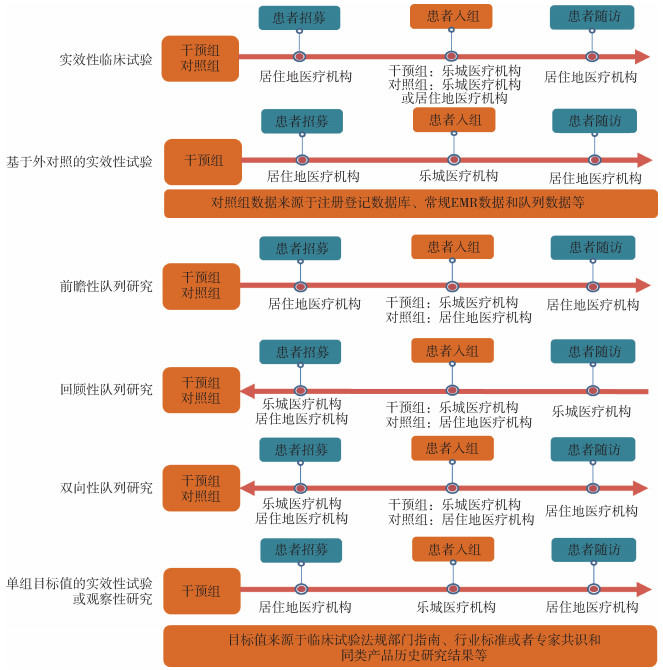
|
| 图 1 博鳌乐城真实世界数据研究常见设计类型示意图 |
3. 博鳌乐城RWS设计的常见类型与关键考虑:
(1)实效性临床试验的设计与关键考虑:实效性临床试验指在真实或接近真实医疗环境下的临床试验,包括实效性随机对照临床试验和实效性非随机对照临床试验,具备RWS的基本特征[4]。相较于传统的解释性临床试验,实效性临床试验因纳入标准更加宽泛,干预方式较为灵活,可同时设立多个对照,可采取随机或非随机的分组方式等设计,具有较高的外部效度[5]。绝大多数情况下,均会选择实效性随机临床试验以最大可能性控制混杂因素对结果的影响。试验组和对照组均采用前瞻性的方式收集,能较好处理其他因素对研究结果的影响,在单纯的RWS设计类型中,实效性临床试验所产生的证据等级最高。
当前博鳌乐城的患者由全国各地医疗机构推荐,患者必须在博鳌乐城医疗机构接受治疗,根据对照组接受处理的地点不同,博鳌乐城开展的实效性临床试验分为2种形式:一种是在当地医疗机构完成分组,干预组与对照组分别在博鳌乐城医疗机构和当地医疗机构接受治疗,该研究类型较为常见;另一种是对照组和干预组均在博鳌乐城完成分组和接受相应的治疗。
博鳌乐城开展RWS的特许创新药械均为国外已上市而国内未上市的药械,大部分为临床急需产品。为提高研究效率,使更多的患者获益,针对某些罕见疾病,因伦理问题和患者实际数量等因素的限制,可开展试验组与对照组样本比例为N∶1的实效性随机对照试验,因该设计的统计检验效能较低,在遵循严格的设计与统计分析后,可纳入符合研究设计方案的外部RWD作为对照[6]。
实效性随机对照临床试验综合了随机化和RWS的优势,当某特许创新药械需要开展实效性试验评价其有效性和安全性时,应首先考虑开展实效性随机对照临床试验[4]。实效性试验的顺利开展涉及多个关键部分,如纳入研究人群的代表性、研究的伦理、样本的大小、盲法的实施、干预措施的制定、登记数据库及多中心数据库链接、如何控制非随机实效性临床试验中基线不均衡对研究结局的影响、治疗方式和干预措施等是否符合常规临床实践等[4-5, 7]。传统的随机对照临床试验多采用意向性分析作为主要甚至唯一的统计分析,但实效性临床试验因研究人群的异质性较大、干预方式多样等原因,更易受到随机后混杂因素的影响[8],尤其当患者不依从的比例过高时,意向性分析在此情况下会逐渐偏离试验原本所关注的疗效并可能导致临床决策出现偏差[9]。因此,统计分析中应采用合适的统计分析方法如逆概率加权、g-估计和工具变量法等减少患者不依从对研究结果的影响[10]。但应注意各统计分析方法均有潜在的假设条件,评价各方法是否满足基本假设是不可忽略的环节,同时应制定敏感性分析计划,以评估研究结果的稳健性。
在博鳌乐城开展实效性临床试验,患者来自全国各地的医疗机构且必须在博鳌乐城医疗机构接受特许创新药械的诊疗,研究设计较难采用随机和盲法,应减少非随机和非盲法对研究结果的影响。如当采用非随机设计时,可采用倾向性评分方法减少试验组与对照组的某些基线变量不均衡对研究结果的影响[11];当采用非盲法干预时,尽可能选择客观指标对结局进行评价,如肿瘤的大小等。
(2)基于外对照的实效性试验的设计与关键考虑:该设计与实效性试验设计不同之处在于外对照数据的来源,该研究外对照可采用历史外部对照、平行外部对照、历史外部对照与平行外部对照相结合的方式。历史外部对照指该对照数据产生于单组实效性试验第一例患者入组之前,可来自历史研究的RWD或/和临床试验数据。平行外部对照则是指该对照数据产生于单组实效性试验第一例患者入组时或入组后,通常以单组实效性试验同期开展的疾病注册登记数据作为对照,平行对照数据可来自不同地区患者同期治疗所产生而收集的数据。采用平行外部对照时,可根据既往数据的有无和质量,平行外部对照数据的收集可采用双向性收集方式[12-13]。
针对历史外对照的单组实效性试验,首先应考虑历史数据的量与质,重点考虑的内容:历史研究数据人群与当前人群的可比性、代表性,历史研究数据与当前研究的相关性,数据中关键变量定义是否明确,记录和随访的完整性,干预措施是否明确,历史研究干预措施与当前研究干预措施的可比性,干预起点和终点定义与当前研究的等同性,安全性评价结果是否完整等[14]。安全性评价是药械评价的重要组成部分,因RWD中存在对非严重不良反应事件的错分和低报告率等问题[15],可考虑采用替代变量[16]或对某些典型的错分变量设立参考值[17]等方式评价安全性结果。针对平行外部对照的单组实效性试验,多采用数据登记的方式收集外对照数据,数据质量优于历史外对照[18]。平行外部对照应考虑对照组和干预组人群的可比性,采用相同的标准对两组人群进行随访和数据质量控制。最后,基于外对照的单组实效性试验,应采用恰当的统计分析方法,如倾向性得分、虚拟匹配对照方法等评估研究结果。应提前制订敏感性分析计划评价已测和/或未测的混杂因素以及不同模型假设对分析结果的影响。
(3)观察性研究的设计与关键考虑:博鳌乐城的医疗机构可申请使用特许进口创新药械,可根据临床实际使用的病例、医疗机构信息系统中的电子病历等数据的数量与质量,考虑采用观察性研究的类型。该观察性研究指包含对照的观察性研究,根据对照数据的来源,对照分为内对照和外对照。根据数据采集的时间,观察性研究分为前瞻性设计、回顾性设计和双向性设计。因该研究采用了对照,可一定程度排除其他因素对研究结果的影响。
针对前瞻性设计,数据收集方式以患者登记为主,数据库构建规范可参考已发表文献[18-19]。博鳌乐城患者的来源为全国各地医疗机构,应避免主观选择患者。针对回顾性设计,主要基于常规收集健康医疗数据构建研究型数据库,研究型数据库的构建规范可参考已发表文献[20]。观察性研究中存在大量偏倚,应在研究的设计阶段制订减少偏倚的措施,提前制订敏感性分析方法,评估研究结果的稳健性[21]。观察性研究因没有随机化机制,通常需要采用更复杂的统计分析方法如多变量分析方法和因果推断方法推断干预措施的疗效,常见的多变量分析方法有logistic回归、Cox回归、混合效应模型、广义估计方程等,常见的因果推断方法包括倾向性评分、边际结构模型、结构方程模型等。应根据研究目的、研究设计类型、暴露因素(或治疗方案)的特点、结局变量及混杂因素选择合适的统计分析方法,并仔细检验各自的适用条件是否满足[11]。另一方面,观察性研究存在大量未测量的混杂因素,应采用定量偏倚评价方法(如E-Value等)评价未测量混杂因素对研究结果的影响[22-23]。
(4)单组目标值的实效性试验或观察性研究的设计与关键考虑:某些特许创新药械可采用基于单组目标值的实效性试验或观察性研究。目标值的设定通常来源于临床研究法规部门指南、行业标准或专家共识、同类产品历史研究结果等资料。单组目标值的实效性试验与单组目标值的观察性研究的主要区别:①数据收集时间不同。单组目标值的实效性试验的数据收集为前瞻性收集,而单组目标值的观察性研究的数据可采用历史性、前瞻性和双向性方式收集。②干预方式。单组目标值的实效性试验具有严格定义的干预措施,单组目标值的观察性研究的暴露较为宽泛,更能反映临床实践。③纳入和排除标准。单组目标值的观察性研究的纳入和排除标准通常较单组目标值的实效性试验更为宽泛。
单组目标值研究因未设置对照组,该方法具有一切外部对照研究的局限性。常见的不适用于单组目标值法的情形主要包括主要终点为主观指标、自愈性疾病、安全性较低等。单组目标值的另一个关键是目标值的确定要有充分的依据,如果监管部门和学术界没有提出相应的目标值,目标值的设定通常来源于历史资料,一方面应考虑历史研究中的适应症、纳入标准、相关诊断标准、诊断方法等因素与当前的研究是否相同或相似,另一方面还应考虑目标值是否适合当前的临床医疗实践。最后,博鳌乐城主要针对的是国外已上市的特许创新药械,在研究设计时,应考虑如何整合国外已有的研究证据,以提高证据的等级。
(5)RWS与RCT的融合设计与关键考虑:特许创新药械的RWS还可考虑与RCT相结合的方式,研究的开展首先应与监管部门充分沟通,充分论证该设计审评审批所需要的条件。基于博鳌乐城的政策优势,特许创新药械可在博鳌乐城先行先用,积累RWD,可申请在博鳌乐城开展RWS。同时,可在除博鳌乐城以外的其他地区开展RCT研究。该设计综合了传统临床研究和RWS的优势,克服了两类研究各自的不足,可提供特许创新药械的外部和内部效度证据。
除上述的RWS设计所需考虑的因素外,该设计的关键考虑在于:①研究对象纳入与排除标准,RCT研究的纳入和排除标准较RWS严格,纳入和排除标准的差异,可能会导致研究的安全性和有效性结论存在差异;②结局指标的选择,RCT结局指标较为单一,RWE结局多采用临床意义的指标,更具有临床实用价值,二者相互补充,但结局指标的不同,样本量也存在差异;③当RWE和RCT的结果相似时,如何定量整合RWE和RCT证据,一般情况下RWE的证据等级低于RCT,证据整合时不能同等对待,可采用贝叶斯统计分析策略整合相关研究证据,如可将RWE转换为Power Prior,以RCT为观察到的数据,采用贝叶斯分析获得处理效应的后验分布[24];④RWE和RCT证据的相互解释[25],主要包括:RWE和RCT的结果相悖。RWE和RCT的结果相似,但效应量存在差异,此时应分析结果出现差异的原因如研究对象的纳入和排除标准、研究设计和统计分析方法等。
4. 结语:
特殊医疗环境使得博鳌乐城RWS具有自身特色。数据来源的广泛性不仅导致博鳌乐城RWD产生的复杂性增加,在研究设计方面,多样性也显著增加。博鳌乐城特许创新药械在开展RWS时通常已有国外临床研究数据,不应将特许创新药械在博鳌乐城使用中所产生的RWE与已有的国外临床研究证据孤立对待;在研究设计时应考虑国内外证据的整合,构建多元化证据评估特许创新药械在中国人群的有效性与安全性。在选择RWS的设计类型时,不仅应考虑国外既有研究证据的强度,也应提前进行充分评价拟开展研究设计所产生证据支持特许创新药械审评审批的适用性。当前,博鳌乐城特许创新药械的RWS处于先行先试阶段,还需进一步开展方法学实证研究不断完善相关理论研究方法。国内外RWS目前均处于探索起步阶段,应进一步创新其研究模式,在符合监管要求的前提下,加速特许创新药械的临床研究进程,进一步利好广大患者。
利益冲突 所有作者均声明不存在利益冲突
志谢 感谢博鳌乐城管理局和优时比贸易(上海)有限公司对本研究的大力支持
| [1] |
Bolislis WR, MPharm MF, Kühler TC. Use of real-world data for new drug applications and line extensions[J]. Clin Ther, 2020, 42(5): 926-938. DOI:10.1016/j.clinthera.2020.03.006 |
| [2] |
任燕, 梁远波, 刘密密, 等. 构建博鳌乐城创新药械真实世界数据研究体系: 基于我国首个使用境内真实世界数据获批上市的医疗器械研究的探讨[J]. 中国循证医学杂志, 2020, 20(10): 1117-1123. Ren Y, Liang YB, Liu MM, et al. Exploration and practice of real-world data studies on innovative medical products in Boao Lecheng: analysis based on Chinese first case of approved medical device using domestic real-world data[J]. Chin J Evid-Based Med, 2020, 20(10): 1117-1123. DOI:10.7507/1672-2531.202007133 |
| [3] |
任燕, 姚明宏, 姚晨, 等. 特许创新药械在博鳌乐城开展真实世界数据研究的模式探索[J]. 中国食品药品监管, 2020(11): 14-20. Ren Y, Yao MH, Yao C, et al. Exploration of framework for real world data studies on special innovative medical products in Boao Lecheng[J]. China Food Drug Admin Mag, 2020(11): 14-20. DOI:10.3969/j.issn.1673-5390.2020.11.002 |
| [4] |
温泽淮, 李玲, 刘艳梅, 等. 实效性随机对照试验的技术规范[J]. 中国循证医学杂志, 2019, 19(7): 794-802. Wen WH, Li L, Liu YM, et al. Technical guidance for pragmatic randomized controlled trials[J]. Chin J Evid-Based Med, 2019, 19(7): 794-802. DOI:10.7507/1672-2531.201904163 |
| [5] |
唐立, 康德英, 喻佳洁, 等. 实效性随机对照试验: 真实世界研究的重要设计[J]. 中国循证医学杂志, 2017, 17(9): 999-1004. Tang L, Kang DY, Yu JJ, et al. Pragmatic randomized controlled trial: an important design for real-world study[J]. Chin J Evid-Based Med, 2017, 17(9): 999-1004. DOI:10.7507/1672-2531.201708037 |
| [6] |
Schmidli H, Häring DA, Thomas M, et al. Beyond randomized clinical trials: use of external controls[J]. Clin Pharm Ther, 2020, 107(4): 806-816. DOI:10.1002/cpt.1723 |
| [7] |
何俏, 时景璞. 临床真实世界研究中的实验性研究设计[J]. 中华流行病学杂志, 2018, 39(4): 519-523. He Q, Shi JP. Realization of design regarding experimental research in the clinical real-world research[J]. Chin J Epidemiol, 2018, 39(4): 519-523. DOI:10.3760/cma.j.issn.0254-6450.2018.04.027 |
| [8] |
Hernán MA, Hernández-Díaz S, Robins JM. Randomized trials analyzed as observational studies[J]. Ann Intern Med, 2013, 159(8): 560-562. DOI:10.7326/0003-4819-159-8-201310150-00709 |
| [9] |
Hernán MA, Hernández-Díaz S. Beyond the intention-to-treat in comparative effectiveness research[J]. Clin Trials, 2012, 9(1): 48-55. DOI:10.1177/1740774511420743 |
| [10] |
石清阳, 李玲, 李舍予, 等. 实效性随机对照试验中的统计方法(Ⅰ): 解决依从性问题[J]. 中国循证医学杂志, 2020, 21(1): 117-124. Shi QY, Li L, Li SY, et al. Statistical methods in pragmatic randomized controlled trials (I): addressing noncompliance[J]. Chin J Evid-Based Med, 2020, 21(1): 117-124. DOI:10.7507/1672-2531.202010019 |
| [11] |
高培, 王杨, 罗剑锋, 等. 基于真实世界数据评价治疗结局研究的统计分析技术规范[J]. 中国循证医学杂志, 2019, 19(7): 787-793. Gao P, Wang Y, Luo JF, et al. Technical guidance for statistical analysis to assess therapeutic outcomes using realworld data[J]. Chin J Evid-Based Med, 2019, 19(7): 787-793. DOI:10.7507/1672-2531.201904179 |
| [12] |
Kluetz PG, O'Connor DJ, Soltys K. Incorporating the patient experience into regulatory decision making in the USA, Europe, and Canada[J]. Lancet Oncol, 2018, 19(5): e267-e274. DOI:10.1016/S1470-2045(18)30097-4 |
| [13] |
Kuehn CM. Patient experience data in US Food and Drug Administration (FDA) regulatory decision making: a policy process perspective[J]. Ther Innov Regul Sci, 2018, 52(5): 661-668. DOI:10.1177/2168479017753390 |
| [14] |
Burcu M, Dreyer NA, Franklin JM, et al. Real-world evidence to support regulatory decision-making for medicines: Considerations for external control arms[J]. Pharmacoepidemiol Drug Saf, 2020, 29(10): 1228-1235. DOI:10.1002/pds.4975 |
| [15] |
Golder S, Loke YK, Wright K, et al. Reporting of adverse events in published and unpublished studies of health care interventions: a systematic review[J]. PLoS Med, 2016, 13(9): e1002127. DOI:10.1371/journal.pmed.1002127 |
| [16] |
Stewart M, Norden AD, Dreyer N, et al. An exploratory analysis of real-world end points for assessing outcomes among immunotherapy-treated patients with advanced non-small-cell lung cancer[J]. JCO Clin Cancer Inform, 2019, 3: 1-15. DOI:10.1200/CCI.18.00155 |
| [17] |
Philip PA, Chansky K, LeBlanc M, et al. Historical controls for metastatic pancreatic cancer: benchmarks for planning and analyzing single-arm phase Ⅱ trials[J]. Clin Cancer Res, 2014, 20(16): 4176-4185. DOI:10.1158/1078-0432.CCR-13-2024 |
| [18] |
谭婧, 彭晓霞, 舒啸尘, 等. 患者登记数据库构建技术规范[J]. 中国循证医学杂志, 2019, 19(7): 771-778. Tan J, Peng XX, Shu XC, et al. Technical guidance for developing patient registry databases[J]. Chin J Evid-Based Med, 2019, 19(7): 771-778. DOI:10.7507/1672-2531.201904161 |
| [19] |
谭婧, 程亮亮, 王雯, 等. 患者登记研究的策划与患者登记数据库构建: 基于观察性设计的真实世界研究[J]. 中国循证医学杂志, 2017, 17(12): 1365-1372. Tan J, Cheng LL, Wang W, et al. Real world study using observational designs: plan for patient registry study and development of registry database[J]. Chin J Evid-Based Med, 2017, 17(12): 1365-1372. DOI:10.7507/1672-2531.201711112 |
| [20] |
王雯, 高培, 吴晶, 等. 构建基于既有健康医疗数据的研究型数据库技术规范[J]. 中国循证医学杂志, 2019, 19(7): 763-770. Wang W, Gao P, Wu J, et al. Technical guidance for developing research databases using existing health and medical data[J]. Chin J Evid-Based Med, 2019, 19(7): 763-770. DOI:10.7507/1672-2531.201904160 |
| [21] |
彭晓霞, 舒啸尘, 谭婧, 等. 基于真实世界数据评价治疗结局的观察性研究设计技术规范[J]. 中国循证医学杂志, 2019, 19(7): 779-786. Peng XX, Shu XC, Tan J, et al. Technical guidance for designing observational studies to assess therapeutic outcomes using real-world data[J]. Chin J Evid-Based Med, 2019, 19(7): 779-786. DOI:10.7507/1672-2531.201904164 |
| [22] |
Lash TL, Fox MP, Maclehose RF, et al. Good practices for quantitative bias analysis[J]. Int J Epidemiol, 2014, 43(6): 1969-1985. DOI:10.1093/ije/dyu149 |
| [23] |
Vanderweele TJ, Ding P. Sensitivity analysis in observational research: introducing the E-value[J]. Ann Intern Med, 2017, 167(4): 268-274. DOI:10.7326/M16-2607 |
| [24] |
Gray CM, Grimson F, Layton D, et al. A framework for methodological choice and evidence assessment for studies using external comparators from real-world data[J]. Drug Saf, 2020, 43(7): 623-633. DOI:10.1007/s40264-020-00944-1 |
| [25] |
Mamtani R, Lund J, Hubbard RA. Considering the totality of evidence: Combining real-world data with clinical trial results to better inform decision-making[J]. Pharmacoepidemiol Drug Saf, 2021, 30(6): 814-816. DOI:10.1002/pds.5218 |
 2021, Vol. 42
2021, Vol. 42


