文章信息
- 樊俊宁, 孙至佳, 余灿清, 郭彧, 孙点剑一, 裴培, 杜怀东, 陈君石, 陈铮鸣, 吕筠, 李立明, 代表中国慢性病前瞻性研究项目协作组.
- Fan Junning, Sun Zhijia, Yu Canqing, Guo Yu, Sun Dianjianyi, Pei Pei, Du Huaidong, Chen Junshi, Chen Zhengming, Lyu Jun, Li Liming, for the China Kadoorie Biobank Collaborative Group
- Fried表型和衰弱指数与死亡风险关联的比较分析
- Comparison of Fried phenotype and frailty index and their associations with risk of mortality
- 中华流行病学杂志, 2021, 42(7): 1179-1187
- Chinese Journal of Epidemiology, 2021, 42(7): 1179-1187
- http://dx.doi.org/10.3760/cma.j.cn112338-20210310-00192
-
文章历史
收稿日期: 2021-03-10
2. 中国医学科学院, 北京 100730;
3. 英国牛津大学医学研究委员会人口健康研究组/英国牛津大学临床与流行病学研究中心纳菲尔德人群健康系OX3 7LF;
4. 国家食品安全风险评估中心, 北京 100022
2. Chinese Academy of Medical Sciences, Beijing 100730, China;
3. Medical Research Council Population Health Research Unit at the University of Oxford/Clinical Trial Service Unit and Epidemiological Studies Unit, Nuffield Department of Population Health, University of Oxford, Oxford OX3 7LF, UK;
4. China National Center for Food Safety Risk Assessment, Beijing 100022, China
衰弱是机体受到强烈、有害刺激后难以维持内环境稳定的一种脆弱状态。随着个体衰老,多个生理系统的功能逐渐衰退,内稳态储备能力下降,最终即使很小的刺激也可以引发明显的健康损害[1]。衰弱评价最常用的两个指标是Fried表型(Fried’s phenotype,FP)和衰弱指数(frailty index,FI)。FP通过简单的5种身体表型来评价个体的衰弱状态[2];FI则基于累积缺陷理论,一般纳入30~40个变量来构建[3]。既往来自欧美人群的研究显示,2种指标在评价个体衰弱状态时有较好的一致性,都能有效预测不良结局[4-6]。而国内相关研究则比较匮乏且仅开展于老年人群[7]。此外,有研究者提出,构建FI的疾病缺陷数越多越稳健,但一般纳入30~40个变量足矣,具体纳入的变量数量对FI的预测效果影响不大[3]。但既往很少有研究在同一人群中比较基于不同数量的疾病缺陷构建的FI对不良结局的预测效果。
利用中国慢性病前瞻性研究(China Kadoorie Biobank,CKB)51万余人的基线调查数据,基于28个变量构建了FI,并证实该指数具有稳健性且能较好地预测死亡风险[8]。CKB项目在第二次重复调查时收集了更为丰富的表型信息。本研究旨在利用CKB队列参加第二次重复调查的研究对象信息,构建FP以及由不同数量的疾病缺陷构成的FI,比较3个指标对衰弱状态评价的一致性以及与死亡风险的前瞻性关联。
对象与方法1. 研究对象:CKB项目基线调查开展于2004-2008年,项目包括5个城市地区和5个农村地区,共募集研究对象51万余人。收集的信息包括问卷调查、体格指标测量和血标本采集。每隔4~5年,项目会对队列中仍保留的约5%的成员进行一次重复调查,第一次和第二次重复调查分别开展于2008年和2013-2014年。第二次重复调查在基线调查内容的基础上新增了手握力、心电图等指标。关于CKB队列详细信息可参考既往文献[9-11]。本研究纳入参加第二次重复调查的研究对象,利用第二次重复调查及之后结局随访的数据。在分析中剔除FI构成条目或FP构成条目有任一缺失者(n=1 624),共纳入23 615名研究对象。
2. 研究内容和定义:第二次重复调查时,一般社会人口学特征(年龄、性别、文化程度)、生活方式特征(吸烟、饮酒、体力活动、饮食习惯等)、疾病史(卒中、恶性肿瘤、糖尿病、哮喘等)、症状(睡眠问题、便秘、身体隐痛或不适等)等通过问卷调查获得。身高、体重、腰围、臀围、血压、心率、骨密度等由经过培训的调查员测量获得。BMI(kg/m2)定义为体重(kg)与身高(m)平方的比值,腰臀比(WHR)定义为腰围与臀围之比。骨密度的测量使用GE Achilles EXP Ⅱ定量超声骨密度仪,测定研究对象左右足跟的跟骨骨密度,取左右足跟骨密度均值进行分析。手握力采用Jamar J00105液压手握力测量仪测量,左右手分别测量一次,取左右手握力均值进行分析[12]。第一秒用力呼气容积(FEV1)和用力肺活量(FVC)采用肺功能仪(Vitalograph 6800)测量获得。另外,采集研究对象血液进行血糖和血脂检测,采集尿液进行生化指标检测。
(1)FP构建:参考Fried等[2]研究者于2001年提出的标准,结合本项目收集的信息,定义5种表型:①非自主的体重下降:自报在过去一年内体重下降≥2.5 kg,且未通过节食或服药等措施来减轻体重;②虚弱无力:将手握力值分性别按BMI的四分位分层后,手握力处于同层人群最低的20%;③自我感觉疲乏:在本研究的性格特征量表(NS量表)中,自报“常常感到厌倦”或“经常感到无精打采或无故疲劳”;④步行缓慢:自报和健康同龄人一起以正常速度在平地行走时,因气短或胸部不适而减速;⑤体力活动水平低:问卷调查中询问研究对象工作相关、交通相关、家务相关和休闲相关体力活动的频率和持续时间[13]。参考2011年更新的体力活动概要中对各项活动代谢当量(metabolic equivalent of task,MET)赋值方法,结合个体报告的体力活动累计时间,计算研究对象总体力活动水平(MET-h/d),按性别分层,处于同层人群最低的20%。5种表型中,个体存在≥3种表型时定义为衰弱,存在1~2种表型时定义为衰弱前期,均不存在则为无衰弱状态。
(2)FI构建:构建FI的变量或疾病缺陷需满足以下条件[3]:①与健康状况相关,包含多个身体系统,可以是疾病、症状、体格检查指标或生化检查指标等;②疾病或缺陷的患病率一般随年龄增长而增加;③不能过早达到饱和,要求疾病或缺陷的患病率在50岁时应 < 80%;④疾病或缺陷在人群中的患病率不能太低,应 > 0.5%;⑤变量缺失值比例应≤5%。
在前期研究中基于基线调查收集的信息,筛选出28种疾病或缺陷来构建FI,包括14种疾病、10种症状或体征和4个体格测量指标[8];基于这些变量在第二次重复调查信息中构建的FI被命名为FI-28。第二次重复调查时新增了一些调查内容,额外筛选出12个变量;利用合计40种疾病或缺陷构建的FI被命名为FI-40。两种FI的构成变量及其赋值见表 1。FI等于个体符合的疾病或缺陷数除以纳入的疾病或缺陷总数(即28或40)。参照既往研究[14-15],进一步将衰弱状况分为3组:无衰弱(FI≤0.10),衰弱前期(0.10 < FI < 0.25)和衰弱(FI≥0.25)。衰弱率指衰弱的人数占总人数的百分比。
(3)结局随访:队列成员随访过程中的死亡信息主要通过当地疾病监测点(disease surveillance points,DSP)死亡登记系统获取,并辅以主动的定向监测。死因分类采用国际疾病分类第十版(ICD-10)。本研究用到的死亡结局为全死因死亡。
3. 统计学分析:分别按FP、FI-28和FI-40进行衰弱状况分组,比较不同衰弱状况组人群在第二次重复调查时的特征差异。连续型变量采用一般线性模型,分类变量采用logistic回归模型,报告调整年龄、性别和地区后的均数或构成比。当协变量是年龄、性别或地区时,不进行调整,报告原始值。计算Spearman相关系数来判断3种指标间的相关性,计算加权Kappa系数来衡量3种指标对人群衰弱状态分类的一致性。绘制直方图展示不同性别及年龄组(5岁一组)的衰弱率。
随访人年数从研究对象完成第二次重复调查之日开始算起,至最早出现以下事件之一的时间为止:死亡、失访或2017年12月31日。采用Cox比例风险模型,计算衰弱状态与死亡的关联,报告风险比(hazard ratio,HR)及其95%CI。当分析FP时,按三分类的衰弱状态(无衰弱、衰弱前期、衰弱)变量纳入模型;当分析FI-28或FI-40时,分别按三分类的衰弱状态(无衰弱、衰弱前期、衰弱)变量、FI五分位变量、以及FI每增加0.1个单位的变量形式纳入模型。模型以年龄为时间尺度,并按年龄(5岁一组)、地区(10个地区)和性别进行联合分层,逐步调整以下混杂因素。模型1:仅调整年龄;模型2:在模型1基础上增加调整文化程度;模型3:在模型2基础上增加调整吸烟状况、饮酒状况、每周蔬菜、水果和红肉的摄入频率。分析分别在全人群、不同年龄组(< 60岁和≥60岁)、不同性别(男、女)、不同地区(城市、农村)和不同文化程度(小学及以下、中学及以上)进行,采用似然比检验比较不同年龄、性别、地区和文化程度组的效应是否存在差异。采用Stata 15.0软件进行统计分析,使用双侧检验,P < 0.05为差异有统计学意义。
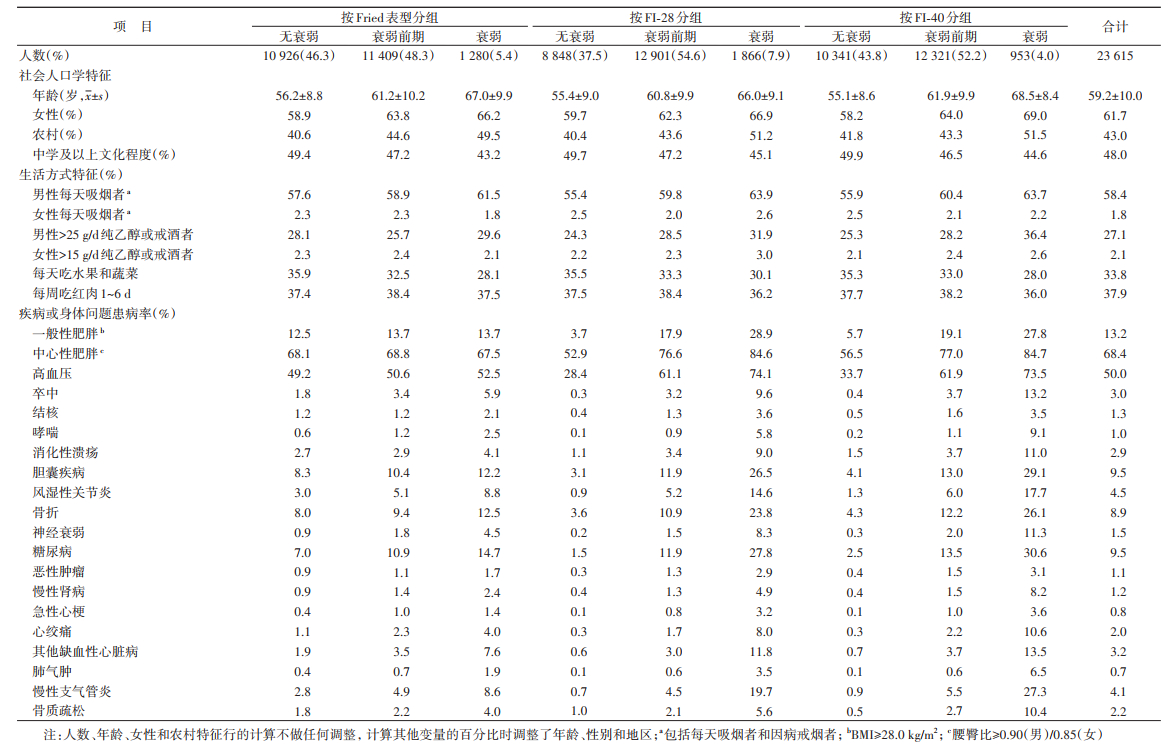
结果1. 基本情况:共纳入23 615名研究对象进行分析,年龄为(59.2±10.0)岁(范围为38~87岁),女性占61.7%,农村占43.0%,文化程度为中学及以上者占48.0%。
2. 衰弱特征:按照FP、FI-28和FI-40计算的衰弱率分别为5.4%、7.9%和4.0%;FI-28与FI-40的均值分别为(0.132±0.074)和(0.115±0.064)。从相关性来看,FP与FI-28和FI-40的Spearman相关系数分别为0.523和0.571,FI-28与FI-40的Spearman相关系数为0.933(均P < 0.001)。从3种指标对衰弱状态分类的一致性来看,FP与FI-28和FI-40的加权Kappa系数分别为0.357和0.408,FI-28与FI-40的加权Kappa系数为0.712(均P < 0.001)。
尽管3种评价指标存在差异,但研究对象在不同衰弱状态组的基本特征分布类似。相比于无衰弱组,衰弱组的人群更倾向于年长、女性、居住在农村、文化程度低、且每天吃水果和蔬菜的比例较低。衰弱组人群的疾病或身体问题的患病率相对较高(趋势检验均P < 0.05)(表 2)。基于FP、FI-28和FI-40的衰弱率均随年龄增长而增加,且女性的衰弱率高于男性(趋势检验均P < 0.05)(图 1)。

|
| 图 1 不同年龄和性别的衰弱率 |
3. 衰弱状态与死亡的关联:经过(3.9±0.5)年的随访,死亡755人。当采用FP时,与无衰弱组相比,衰弱前期和衰弱组的死亡风险均增加,多因素调整后的HR值(95%CI)分别为1.60(1.32~1.94)和2.90(2.25~3.73)(表 3)。采用FI-28时,衰弱前期和衰弱组的死亡HR值(95%CI)分别为1.71(1.39~2.11)和2.52(1.95~3.27);以最低五分位为参照组,死亡风险随着分位数的增加而增高,最高五分位的死亡风险为2.89(2.07~4.04);FI-28每增加0.1个单位,死亡风险增加54%(HR=1.54,95%CI:1.40~1.68)。采用FI-40时,衰弱前期和衰弱组的死亡HR值(95%CI)分别为1.98(1.60~2.44)和3.71(2.80~4.91);类似地,以最低五分位为参照组,死亡风险随着分位数的增加而增高,最高五分位的死亡风险为2.90(2.07~4.06);FI-40每增加0.1个单位,死亡风险增加85%(HR=1.85,95%CI:1.67~2.06)。
4. 不同年龄、性别间衰弱状态与死亡的关联:采用FP时,衰弱状态与死亡风险的关联在不同年龄组间存在差异(交互作用P < 0.001),< 60岁和≥60岁的HR值(95%CI)分别为5.05(2.85~8.94)和3.03(2.28~4.04)(表 4)。采用FI-28时,当纳入变量为衰弱状态三分组或FI-28每增加0.1个单位时,死亡风险比存在年龄差异(交互作用P < 0.05)。FI-28每增加0.1个单位,在 < 60岁和≥60岁的HR值(95%CI)分别为2.08(1.67~2.61)和1.46(1.33~1.61)。当采用FI-40时,结果与FI-28类似,FI-40每增加0.1个单位,在 < 60岁和≥60岁的HR值(95%CI)分别为2.53(1.94~3.30)和1.78(1.59~1.99)。衰弱状态与死亡风险的关联在不同性别、地区、文化程度之间差异无统计学意义(交互作用P > 0.05;结果未展示)。
本研究利用CKB队列中近2.4万人参加第二次重复调查及之后的随访数据,构建FP以及分别由28个和40个指标构成的FI,3个衰弱评价指标表现出较好的一致性,衰弱率都随年龄增长而增加,女性衰弱率高于男性。3种指标都能有效预测死亡风险,且在 < 60岁人群中衰弱与死亡风险的关联强度高于≥60岁人群。
本研究中,基于FP和FI分别划分个体的衰弱状态,FI-28得出的衰弱率最高(7.9%),其次是FP(5.4%),FI-40得出的衰弱率最低(4.0%)。在分组一致性上,FP与FI-28和FI-40的Kappa系数分别为0.357和0.408。既往研究显示,FI和FP存在中等程度的一致性,但FI得出的衰弱率远高于FP得出的衰弱率。比如,美国国家健康与营养调查(NHANES)研究纳入4 096名50岁以上的研究对象,由46个变量构建的FI和FP得出的衰弱率分别为34.0%和3.6%,二者的Kappa系数为0.116[4]。欧洲健康、老龄化与退休调查(SHARE)研究纳入27 527名50~104岁的研究对象,由70个变量构建的FI和FP得出的衰弱率分别为21.6%和11.0%,二者的Kappa系数为0.51[16]。中国如皋健康与老龄化研究在70~84岁老年人中,采用由45个变量构建的FI和FP得出的衰弱率分别为27.5%和9.5%,得到的Kappa系数为0.310[14]。单从FI来看,我们的结果显示FI纳入的条目越多,衰弱率越低。英国的一项研究也显示,FI-40得出的衰弱率高于FI-70得出的衰弱率(31.2% vs. 25.3%)[17]。
本研究发现,FP、FI-28和FI-40都能较好地预测死亡风险,与无衰弱个体相比,衰弱或衰弱前期状态的死亡风险增加,与既往研究结果一致。2018年的一篇纳入19项前瞻性研究的Meta分析中,各研究都采用FI评价方法,结果显示,FI每增加0.1个单位,死亡风险增加28%(HR=1.28,95%CI:1.26~1.31)[18]。另一项采用FP的Meta分析也显示,与无衰弱的老年人相比,衰弱前期和衰弱的死亡HR值(95%CI)分别为1.34(1.26~1.41)和2.00(1.73~2.32)[19]。
本研究中3种指标定义的衰弱与死亡的关联强度存在差异,FI-40与死亡风险的关联强度最大,FP和FI-28较为接近。有研究者利用美国心血管健康研究的数据,同时构建了FI和FP,研究中将FP转换成0~1之间的数值(即0、0.2、0.4、0.6、0.8、1),两种指标每增加1%,FI(RR=1.035,95%CI:1.026~1.045)与死亡的关联强度高于FP与死亡的关联强度(RR=1.014,95%CI:1.009~1.019)[20]。欧洲男性老龄化研究对2 929名40~79岁男性随访4.3年后发现,与无衰弱者相比,纳入39个条目的FI和FP定义的衰弱状态与死亡的关联强度HR值分别为4.00(95%CI:2.51~6.37)和3.84(95%CI:2.24~6.60)[21]。在SHARE研究中,研究者比较了8种衰弱测量指标(FP、FI、临床衰弱量表等)对死亡的预测效果,结果发现,FI和FP对5年死亡风险预测的AUC值分别为0.75(95%CI:0.74~0.77)和0.70(0.68~0.71)[16]。而一项来自爱尔兰的随访2年的研究分别基于33个自报指标、33个检测指标和66个上述自报和检测合计的指标构建FI,FI每增加0.01个单位,三者与死亡风险的关联强度HR值分别为1.036(95%CI:1.011~1.061)、1.059(95%CI:1.031~1.088)和1.072(95%CI:1.040~1.106)[22]。
FP和FI在衰弱率以及与死亡风险的关联强度上存在差异,这种差异可能是由于FP和FI在概念和构建方法上的不同导致的。FP基于5种表型构建,操作相对简单方便,适于对人群进行初始风险分层,但是对肌肉力量和步行速度的测量,可能会受到握力计、空间或时间的限制。FI基于累积缺陷的原理,需要评价更多的内容,随着医疗保健信息化发展,我们还可以利用体检、就诊等常规医疗保健数据库来构建FI。此外,相比FP,FI本身为连续型变量,能更有效地识别衰弱程度较低的人群,如中年人群。两种指标并非简单的孰优孰劣,有学者提出两种指标互为补充,在临床实践和风险评估中应综合考虑[23]。
既往研究发现,衰弱与死亡风险的关联强度在不同年龄段人群存在差异,表现为在相对低年龄组中效应更为明显。英国生物银行50万人的研究结果显示,FI每增加0.1个单位,死亡风险增加65%,该增加幅度随年龄增长而降低。FI每增加0.1个单位,在40~、50~、60~、> 65岁组的死亡风险分别增加87%、77%、60%、59%[24]。基于CKB队列基线51万人随访十余年的研究结果显示,FI与全因死亡和死因别死亡的关联强度在低年龄组成年人中高于高年龄组[8]。本研究进一步证实,不管采用哪种指标,因衰弱导致的死亡风险增加,< 60岁人群中的相对危险度高于≥60岁人群。这提示我们,在中年人中应用FI或FP这类指标评价个体未来死亡风险、识别高危人群并及早开展干预的价值与在老年人中同样重要。
本研究为前瞻性研究,样本量大,收集的变量信息丰富。采用3种(FP、FI-28和FI-40)衰弱评价指标探究人群衰弱状态的分布以及与死亡的关联,是首次在中国人群中开展的指标比较性研究。本研究也存在局限性:首先,构建FI的变量中疾病占的比重较大,且未纳入老年人日常功能性评价指标。不过既往研究提示,只要构建FI的变量能反映多个器官系统的功能,变量数量远比变量内容更重要[25]。另外,构建FP的条目中,步行缓慢和自我感觉疲乏的定义与原研究并不完全一致。不过既往很多研究在构建FP时都结合自身数据库情况,对某些表型进行了修改与调整,并证实修改后的FP能有效评价衰弱状况[4, 26]。
本研究发现,FP和基于不同数量的变量构建的FI都能较好地预测未来一段时期的死亡风险。随着衰弱程度的增加,死亡风险随之增加。中年人群中衰弱与死亡的关联效应高于老年人群。在临床实践上,可根据实际情况选择方便可得的变量(如疾病、症状、体格检查指标、实验室检测值等)来构建衰弱评价指标,对中老年人群进行未来死亡风险评价,识别高危人群,及早开展干预,降低过早死亡率,提高人群的健康期望寿命。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Clegg A, Young J, Iliffe S, et al. Frailty in elderly people[J]. Lancet, 2013, 381(9868): 752-762. DOI:10.1016/s0140-6736(12)62167-9 |
| [2] |
Fried LP, Tangen CM, Walston J, et al. Frailty in older adults: evidence for a phenotype[J]. J Gerontol A Biol Sci Med Sci, 2001, 56(3): M146-157. DOI:10.1093/gerona/56.3.M146 |
| [3] |
Searle SD, Mitnitski A, Gahbauer EA, et al. A standard procedure for creating a frailty index[J]. BMC Geriatr, 2008, 8: 24. DOI:10.1186/1471-2318-8-24 |
| [4] |
Blodgett J, Theou O, Kirkland S, et al. Frailty in NHANES: Comparing the frailty index and phenotype[J]. Arch Gerontol Geriatr, 2015, 60(3): 464-470. DOI:10.1016/j.archger.2015.01.016 |
| [5] |
Rockwood K, Andrew M, Mitnitski A. A comparison of two approaches to measuring frailty in elderly people[J]. J Gerontol A Biol Sci Med Sci, 2007, 62(7): 738-743. DOI:10.1093/gerona/62.7.738 |
| [6] |
Ensrud KE, Ewing SK, Taylor BC, et al. Comparison of 2 frailty indexes for prediction of falls, disability, fractures, and death in older women[J]. Arch Intern Med, 2008, 168(4): 382-389. DOI:10.1001/archinternmed.2007.113 |
| [7] |
Zhu YS, Liu ZY, Wang Y, et al. Agreement between the frailty index and phenotype and their associations with falls and overnight hospitalizations[J]. Arch Gerontol Geriatr, 2016, 66: 161-165. DOI:10.1016/j.archger.2016.06.004 |
| [8] |
Fan JN, Yu CQ, Guo Y, et al. Frailty index and all-cause and cause-specific mortality in Chinese adults: a prospective cohort study[J]. Lancet Public Health, 2020, 5(12): e650-660. DOI:10.1016/s2468-2667(20)30113-4 |
| [9] |
Chen ZM, Chen JS, Collins R, et al. China Kadoorie Biobank of 0.5 million people: survey methods, baseline characteristics and long-term follow-up[J]. Int J Epidemiol, 2011, 40(6): 1652-166. DOI:10.1093/ije/dyr120 |
| [10] |
Chen ZM, Lee L, Chen JS, et al. Cohort profile: the Kadoorie study of chronic disease in China (KSCDC)[J]. Int J Epidemiol, 2005, 34(6): 1243-1249. DOI:10.1093/ije/dyi174 |
| [11] |
李立明, 吕筠, 郭彧, 等. 中国慢性病前瞻性研究: 研究方法和调查对象的基线特征[J]. 中华流行病学杂志, 2012, 33(3): 249-255. Li LM, Lv J, Guo Y, et al. The China Kadoorie Biobank: related methodology and baseline characteristics of the participants[J]. Chin J Epidemiol, 2012, 33(3): 249-255. DOI:10.3760/cma.j.issn.0254-6450.2012.03.001 |
| [12] |
吴曼, 魏玉虾, 余灿清, 等. 中国10个地区成年人骨骼肌质量和手握力的描述性分析[J]. 中华流行病学杂志, 2019, 40(4): 376-381. Wu M, Wei YX, Yu CQ, et al. Levels of skeletal muscle mass and handgrip strength in adults from 10 regions of China[J]. Chin J Epidemiol, 2019, 40(4): 376-381. DOI:10.3760/cma.j.issn.0254-6450.2019.04.002 |
| [13] |
Du H, Bennett D, Li L, et al. Physical activity and sedentary leisure time and their associations with BMI, waist circumference, and percentage body fat in 0.5 million adults: the China Kadoorie Biobank study[J]. Am J Clin Nutr, 2013, 97(3): 487-496. DOI:10.3945/ajcn.112.046854 |
| [14] |
Shi GP, Ma T, Zhu YS, et al. Frailty phenotype, frailty index and risk of mortality in Chinese elderly population-Rugao longevity and ageing study[J]. Arch Gerontol Geriatr, 2019, 80: 115-119. DOI:10.1016/j.archger.2018.11.001 |
| [15] |
Hoogendijk EO, Afilalo J, Ensrud KE, et al. Frailty: implications for clinical practice and public health[J]. Lancet, 2019, 394(10206): 1365-1375. DOI:10.1016/S0140-6736(19)31786-6 |
| [16] |
Theou O, Brothers TD, Mitnitski A, et al. Operationalization of frailty using eight commonly used scales and comparison of their ability to predict all-cause mortality[J]. J Am Geriatr Soc, 2013, 61(9): 1537-1551. DOI:10.1111/jgs.12420 |
| [17] |
Aguayo GA, Donneau AF, Vaillant MT, et al. Agreement between 35 published frailty scores in the general population[J]. Am J Epidemiol, 2017, 186(4): 420-434. DOI:10.1093/aje/kwx061 |
| [18] |
Kojima G, Iliffe S, Walters K. Frailty index as a predictor of mortality: a systematic review and Meta-analysis[J]. Age Ageing, 2018, 47(2): 193-200. DOI:10.1093/ageing/afx162 |
| [19] |
Chang SF, Lin PL. Frail phenotype and mortality prediction: a systematic review and Meta-analysis of prospective cohort studies[J]. Int J Nurs Stud, 2015, 52(8): 1362-1374. DOI:10.1016/j.ijnurstu.2015.04.005 |
| [20] |
Kulminski AM, Ukraintseva SV, Kulminskaya IV, et al. Cumulative deficits better characterize susceptibility to death in elderly people than phenotypic frailty: lessons from the Cardiovascular Health Study[J]. J Am Geriatr Soc, 2008, 56(5): 898-903. DOI:10.1111/j.1532-5415.2008.01656.x |
| [21] |
Ravindrarajah R, Lee DM, Pye SR, et al. The ability of three different models of frailty to predict all-cause mortality: results from the European Male Aging Study (EMAS)[J]. Arch Gerontol Geriatr, 2013, 57(3): 360-368. DOI:10.1016/j.archger.2013.06.010 |
| [22] |
Theou O, O'Connell MDL, King-Kallimanis BL, et al. Measuring frailty using self-report and test-based health measures[J]. Age Ageing, 2015, 44(3): 471-477. DOI:10.1093/ageing/afv010 |
| [23] |
Cesari M, Gambassi G, van Kan GA, et al. The frailty phenotype and the frailty index: different instruments for different purposes[J]. Age Ageing, 2014, 43(1): 10-12. DOI:10.1093/ageing/aft160 |
| [24] |
Williams DM, Jylhävä J, Pedersen NL, et al. A frailty index for UK Biobank participants[J]. J Gerontol A, 2019, 74(4): 582-587. DOI:10.1093/gerona/gly094 |
| [25] |
Rockwood K, Mitnitski A, Song XW, et al. Long-term risks of death and institutionalization of elderly people in relation to deficit accumulation at age 70[J]. J Am Geriatr Soc, 2006, 54(6): 975-979. DOI:10.1111/j.1532-5415.2006.00738.x |
| [26] |
Hanlon P, Nicholl BI, Jani BD, et al. Frailty and pre-frailty in middle-aged and older adults and its association with multimorbidity and mortality: a prospective analysis of 493737 UK Biobank participants[J]. Lancet Public Health, 2018, 3(7): e323-332. DOI:10.1016/s2468-2667(18)30091-4 |
 2021, Vol. 42
2021, Vol. 42