文章信息
- 王捷, 丁玲, 吕元婧, 孟丹, 刘虹, 宋丽, 祁卓, 贾海霞, 裴蕊欣, 田志强, 郝敏, 王金桃.
- Wang Jie, Ding Ling, Lyu Yuanjing, Meng Dan, Liu Hong, Song Li, Qi Zhuo, Jia Haixia, Pei Ruixin, Tian Zhiqiang, Hao Min, Wang Jintao
- 高危型HPV感染状态下阴道微环境因子联合检测对低度宫颈上皮内瘤变诊断的优化模式研究
- The optimal model of diagnosis to low-grade cervical intraepithelial neoplasia by combined detecting vaginal micro-environmental factors, based on the high-risk HPV infection
- 中华流行病学杂志, 2021, 42(6): 1108-1112
- Chinese Journal of Epidemiology, 2021, 42(6): 1108-1112
- http://dx.doi.org/10.3760/cma.j.cn112338-20200808-01045
-
文章历史
收稿日期: 2020-08-08
2. 山西医科大学口腔医院, 太原 030001;
3. 山西医科大学第二医院妇产科, 太原 030001
2. Somatological Hospital of Shanxi Medical University, Taiyuan 030001, China;
3. Department of Obstetrics and Gynecology, Second Hospital of Shanxi Medical University, Taiyuan 030001, China
宫颈癌作为严重威胁女性健康的恶性肿瘤,其发生发展是多因素、多步骤长期作用的结果[1]。低度宫颈上皮内瘤变(CIN Ⅰ)为宫颈病变的早期阶段,如未及时发现和治疗,具有恶性转化的倾向[2],CIN Ⅰ的早期筛查与诊断对宫颈癌及癌前病变的预防具有重要意义。高危型HPV(HR-HPV)持续感染是宫颈癌发生的必要因素,但不是唯一因素。近年来,阴道微生态与宫颈癌的关系备受关注,阴道pH值、白细胞酯酶等微环境因子可从阴道酸碱度、炎性反应等方面反映阴道微生态的状况。本课题组前期研究发现,阴道微环境因子异常可增加罹患CIN Ⅰ的风险[3],但在HR-HPV感染不同状态下,阴道微环境因子联合检测对CIN Ⅰ的诊断意义尚待确定。本研究旨在探讨HR-HPV感染状态下阴道微环境因子联合检测对CIN Ⅰ的诊断效果及最佳组合,以期为宫颈病变的筛查及早期诊断策略的制定提供新的科学依据。
对象与方法1.研究对象:从本课题组于2014年6-12月在山西省介休市建立的社区队列人群中,选取液基细胞学(TCT)筛查异常并经病理学确诊的正常宫颈(NC)女性(623人)和CIN Ⅰ患者(303人)作为研究对象。所有研究对象排除妊娠期与哺乳期女性、有子宫切除史、其他恶性肿瘤、免疫系统和精神疾病的患者。在获得患者知情同意和山西医科大学伦理委员会批准的情况下实施研究。
2.资料和标本的收集:采用统一的结构式问卷对研究对象进行面对面调查,收集一般人口学特征及宫颈病变相关因素等资料。由专业妇科大夫采集阴道分泌物和宫颈脱落细胞,分别用于阴道微环境因子和HPV的检测。
3.实验检测:阴道微环境因子检测严格按照需氧菌性阴道炎/细菌性阴道病五项联合测定试剂盒说明书操作,阴性为正常,阳性为异常[3]。采用导流杂交法检测HPV感染状态,清晰可见蓝紫色圆点为HPV阳性。本研究将HR-HPV中任意一种或多种阳性判定为HR-HPV阳性。
4.统计学分析:采用SAS 9.2与SPSS 23.0软件进行数据分析。以病理诊断结果为金标准,评价不同阴道微环境因子单独及联合检测对CIN Ⅰ的诊断价值。首先以病理诊断结果为因变量,以阴道微环境因子为协变量纳入logistic回归方程,获得每个研究对象的预测患病概率,随后应用受试者工作特征曲线(ROC曲线)分析方法,以预测患病概率值为“检验变量”,以病理诊断结果为“结果变量”,获得一系列不同的截断值及其对应的灵敏度与特异度,进而绘制ROC曲线并获得最佳截断值[4]。采用逼近理想排序法(TOPSIS)进行不同HR-HPV感染状态下阴道微环境因子联合检测对CIN Ⅰ诊断的优化分析[5]。检验水准为α=0.05。
结果1.一般人口学特征:NC和CIN Ⅰ组的年龄分别为(48.02±9.15)岁和(49.17±9.30)岁。两组在年龄(χ2=2.746)、文化程度(χ2=1.085)、婚姻状况(χ2=0.568)、年收入(χ2=0.007)、吸烟(χ2=0.003)、洗澡方式(χ2=0.006)、洗阴频率(χ2=0.553)、经期性生活(χ2=0.086)、绝经(χ2=2.269)等方面均衡可比(P>0.05),但HR-HPV感染差异有统计学意义(χ2=9.076,P < 0.05)。
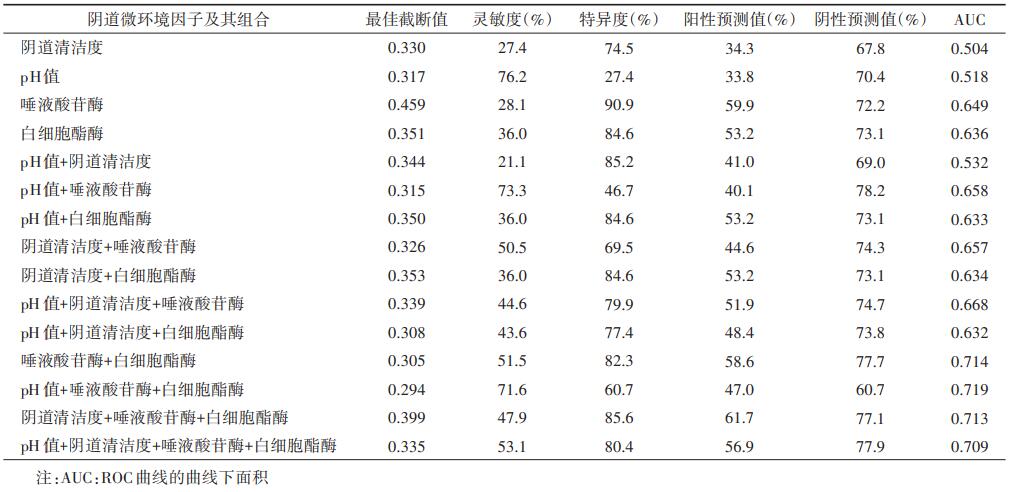
2.主要阴道微环境因子的筛选:采用主成分分析法,将阴道清洁度、pH值、H2O2、β-葡萄糖醛酸苷酶、凝固酶、唾液酸苷酶及白细胞酯酶7个阴道微环境因子进行降维分析。根据特征值>1确定主成分的原则[5],获得主成分Z1、Z2、Z3,其累计贡献率为71.5%。由表 1可见,Z1主成分综合阴道微环境因子的能力最强,故本研究以阴道清洁度、pH值、唾液酸苷酶、白细胞酯酶为阴道微环境因子的特征因子进行后续分析。
3.阴道微环境因子单独及联合检测对CIN Ⅰ的诊断价值:对上述确定的4种因子及不同的联合检测模式,在应用logistic回归方法获得研究对象预测患病概率的基础上,进行ROC曲线分析。结果显示,灵敏度以pH(76.2%)最高,特异度以唾液酸苷酶(90.9%)最高,联合检测以唾液酸苷酶+白细胞酯酶、pH值+唾液酸苷酶+白细胞酯酶、阴道清洁度+唾液酸苷酶+白细胞酯酶和pH值+阴道清洁度+唾液酸苷酶+白细胞酯酶4种模式ROC曲线的曲线下面积(AUC)较大(>0.7)。见表 2。
4.HR-HPV感染状态下阴道微环境因子联合检测对CINⅠ的诊断价值:考虑到HR-HPV为宫颈病变的主要病因,参照文献[5],采用TOPSIS法对HR-HPV感染状态下AUC>0.7的唾液酸苷酶+白细胞酯酶(P1)、pH值+唾液酸苷酶+白细胞酯酶(P2)、阴道清洁度+唾液酸苷酶+白细胞酯酶(P3)和pH值+阴道清洁度+唾液酸苷酶+白细胞酯酶(P4)4种组合模式的诊断价值进行评价。结果显示,HR-HPV阳性组各阴道微环境因子联合检测对CIN Ⅰ的诊断价值高于阴性组,联合检测的最佳模式在HR-HPV阳性组为P2,HR-HPV阴性组为P3(表 3,图 1)。

|
| 注:Ci表示不同组合模式与理想最优解的接近程度 图 1 HR-HPV阳性(A)和阴性(B)状态下阴道微环境因子联合检测的ROC曲线及Ci值 |
宫颈癌是全球女性第二大妇科肿瘤,严重威胁着女性健康[6]。CIN Ⅰ作为宫颈癌的早期阶段,早期识别对宫颈癌的预防具有重要意义。多年来实施的HPV、液基细胞学(TCT)联合筛查方案,很大程度上减少了宫颈癌的发病率[7],但是仍缺乏早期发现宫颈癌前病变的方法。研究发现,阴道微环境因子紊乱与宫颈癌的发生有关[8],但对CIN Ⅰ的诊断价值如何目前尚不明确。
主成分分析利用降维的思想,将多个变量转化为少数几个互不相关的主成分,并且根据因子载荷找出影响各主成分的主要因子。本研究通过主成分分析筛选出阴道清洁度、pH值、唾液酸苷酶和白细胞酯酶为阴道微环境因子的特征因子。正常情况下,乳酸杆菌通过分泌乳酸维持阴道的酸性环境[9],阴道pH值升高[10-11]、清洁度异常[12]均可增加宫颈病变的风险。唾液酸苷酶主要由阴道加德纳菌等致病菌分泌,该酶被抑制可使宫颈上皮细胞免受加德纳菌侵袭[13]。白细胞酯酶异常为阴道黏膜受损的炎性标志[14],与HPV入侵阴道黏膜进而导致宫颈病变的发生有关。这一系列研究均提示,阴道清洁度、pH值、唾液酸苷酶、白细胞酯酶等阴道微环境因子异常与宫颈病变关系密切,而在本研究中发现,这些因子在CIN Ⅰ中诊断价值各有优势与不足,探究阴道微环境主要特征因子的优化组合对于CIN Ⅰ的诊断具有重要意义。
本研究利用基于多变量logistic回归模型的ROC曲线分析[4],对上述主要因子的组合模式进行了诊断效应评价,结果显示,唾液酸苷酶+白细胞酯酶、pH值+唾液酸苷酶+白细胞酯酶、阴道清洁度+唾液酸苷酶+白细胞酯酶和pH值+阴道清洁度+唾液酸苷酶+白细胞酯酶4种模式的AUC均>0.7,提示阴道微环境因子的联合检测,在一定程度上避免了单一因子检测灵敏度低或特异性不强的弊端,提高了对CIN Ⅰ的诊断价值。
TOPSIS法是一种逼近于理想解的排序法,其基本原理为通过计算备选方案与理想最优解、最劣解的距离,进而获得备选方案中的最佳方案[15]。鉴于HR-HPV感染在宫颈病变中具有重要病因作用的生物学特征,本研究利用TOPSIS法获得在不同HR-HPV感染状态下,阴道微环境因子联合检测对CIN Ⅰ诊断的最佳模式,结果提示,无论HR-HPV感染与否,反映阴道菌群和炎性状况的唾液酸苷酶和白细胞酯酶对于CIN Ⅰ均有重要诊断意义,对于HR-HPV阳性和阴性女性,分别增加阴道pH和清洁度的检测,对提高CIN Ⅰ的诊断效率更为重要。
本研究基于社区人群评价阴道微环境因子对CIN Ⅰ的诊断价值,具有良好的代表性。利用TOPSIS法获得不同HR-HPV感染状况下阴道微环境因子对CIN Ⅰ的最佳联合诊断模式,为CIN Ⅰ诊断决策的制定提供了科学依据,对临床精准诊断方案的建立开拓了新的思路。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Mo LZ, Song HL, Wang JL, et al. Pap smear combined with HPV testing: a reasonable tool for women with high-grade cervical intraepithelial Neoplasia Treated by LEEP[J]. Asian Pac J Cancer Prev, 2015, 16(10): 4297-4302. DOI:10.7314/apjcp.2015.16.10.4297 |
| [2] |
El-Zein M, Cheishvili D, Gotlieb W, et al. Genome-wide DNA methylation profiling identifies two novel genes in cervical neoplasia[J]. Int J Cancer, 2020, 147(5): 1264-1274. DOI:10.1002/ijc.32880 |
| [3] |
Li L, Ding L, Gao T, et al. Association between vaginal micro-environment disorder and cervical intraepithelial Neoplasia in a community based population in China[J]. J Cancer, 2020, 11(2): 284-291. DOI:10.7150/jca.35022 |
| [4] |
刘润幸. 使用SPSS作多变量观察值的ROC曲线分析[J]. 中国公共卫生, 2003, 19(9): 1151-1152. Liu RX. SPSS was used for the ROC curve analysis of multivariate observed values[J]. Chin J Public Health, 2003, 19(9): 1151-1152. DOI:10.3321/j.issn:1001-0580.2003.09.078 |
| [5] |
孙振球, 徐勇勇. 医学统计学[M]. 4版. 北京: 人民卫生出版社, 2014. Sun ZQ, Xu YY. Medical statistics[M]. 4th ed. Beijing: People's Medical Publishing House, 2014. |
| [6] |
Almeida AM, Queiroz JA, Sousa F, et al. Cervical cancer and HPV infection: ongoing therapeutic research to counteract the action of E6 and E7 oncoproteins[J]. Drug Discov Today, 2019, 24(10): 2044-2057. DOI:10.1016/j.drudis.2019.07.011 |
| [7] |
US Preventive Services Task Force. Screening for cervical cancer: US preventive services task force recommendation statement[J]. JAMA, 2018, 320(7): 674-686. DOI:10.1001/jama.2018.10897 |
| [8] |
Mitra A, MacIntyre DA, Lee YS, et al. Cervical intraepithelial neoplasia disease progression is associated with increased vaginal microbiome diversity[J]. Sci Rep, 2015, 5: 16865. DOI:10.1038/srep16865 |
| [9] |
Petrova MI, Lievens E, Malik S, et al. Lactobacillus species as biomarkers and agents that can promote various aspects of vaginal health[J]. Front Physiol, 2015, 6: 81. DOI:10.3389/fphys.2015.00081 |
| [10] |
Clarke MA, Rodriguez AC, Gage JC, et al. A large, population-based study of age-related associations between vaginal pH and human papillomavirus infection[J]. BMC Infect Dis, 2012, 12: 33. DOI:10.1186/1471-2334-12-33 |
| [11] |
Łaniewski P, Barnes D, Goulder A, et al. Linking cervicovaginal immune signatures, HPV and microbiota composition in cervical carcinogenesis in non-Hispanic and Hispanic women[J]. Sci Rep, 2018, 8(1): 7593. DOI:10.1038/s41598-018-25879-7 |
| [12] |
Klomp JM, Boon ME, van Haaften M, et al. Cytologically diagnosed Gardnerella vaginalis infection and cervical (pre) neoplasia as established in population-based cervical screening[J]. Am J Obstetr Gynecol, 2008, 199(5): 480.e1-480.e5. DOI:10.1016/j.ajog.2008.04.036 |
| [13] |
Govinden G, Parker JL, Naylor KL, et al. Inhibition of sialidase activity and cellular invasion by the bacterial vaginosis pathogen Gardnerella vaginalis[J]. Arch Microbiol, 2018, 200(7): 1129-1133. DOI:10.1007/s00203-018-1520-4 |
| [14] |
Zheng NN, Guo RY, Yao YY, et al. Lactobacillus iners is associated with vaginal dysbiosis in healthy pregnant women: a preliminary study[J]. BioMed Res Int, 2019, 2019: 6079734. DOI:10.1155/2019/6079734 |
| [15] |
Sindhu MS, Rashid T, Kashif A. Modeling of linear programming and extended TOPSIS in decision making problem under the framework of picture fuzzy sets[J]. PLoS One, 2019, 14(8): e0220957. DOI:10.1371/journal.pone.0220957 |
 2021, Vol. 42
2021, Vol. 42