文章信息
- 孟丹, 宋丽, 祁卓, 王捷, 刘虹, 吕元婧, 贾海霞, 丁玲, 郝敏, 田志强, 王金桃.
- Meng Dan, Song Li, Qi Zhuo, Wang Jie, Liu Hong, Lyu Yuanjing, Jia Haixia, Ding Ling, Hao Min, Tian Zhiqiang, Wang Jintao
- 高危型人乳头瘤病毒感染的转归特点及阴道微环境因子对其转归影响的研究
- Prognosis of high-risk HPV infection and its influences by vaginal micro-environmental factors
- 中华流行病学杂志, 2021, 42(6): 1103-1107
- Chinese Journal of Epidemiology, 2021, 42(6): 1103-1107
- http://dx.doi.org/10.3760/cma.j.cn112338-20200829-01107
-
文章历史
收稿日期: 2020-08-29
2. 山西医科大学第二医院妇产科, 太原 030001;
3. 山西医科大学口腔医院, 太原 030001
2. Department of Obstetrics and Gynecology, Second Hospital of Shanxi Medical University, Taiyuan 030001, China;
3. Stomatological Hospital of Shanxi Medical University, Taiyuan 030001, China
子宫颈癌位居全球女性恶性肿瘤第四位,对女性健康构成严重威胁[1]。高危型HPV(HR-HPV)持续感染是子宫颈癌发生的主要病因[2],女性一生中感染HR-HPV的概率较高,但只有不到10%的感染者发生持续感染,甚至进展为子宫颈癌[3]。因此,明确影响HR-HPV感染转归的因素并采取针对性的干预措施,对于降低子宫颈癌的发病率至关重要。鉴于子宫颈与阴道密切的生理关系,阴道微环境变化与HR-HPV的关系逐渐受到关注。已有研究表明阴道微环境紊乱可增加HR-HPV感染的风险[4-5],但阴道微环境紊乱对HR-HPV感染转归的影响目前尚不清楚。本研究基于社区队列采用巢式病例对照研究的方法,旨在研究阴道微环境因子对HR-HPV感染转归的影响,以期为HR-HPV持续感染的预测和早期干预提供一定依据。
对象与方法1.研究对象:从本课题组于2014年6-12月在山西省介休市、阳曲县建立的社区已婚女性队列中,选取HR-HPV感染、经病理学诊断为正常宫颈的421名女性为研究对象,进行了24个月的随访,并于随访结束时对研究对象再次行HPV检测。研究对象的纳入排除标准参照本课题组前期研究[6],本研究通过山西医科大学医学伦理委员会审查,研究对象均签署知情同意书。
2.基线资料和标本的收集:由经过严格培训的调查员采用统一的结构式问卷面对面收集研究对象的一般人口学特征、月经、婚育史、卫生习惯等基线资料。由临床医生使用扩阴器暴露宫颈,用无菌棉棒于阴道侧壁上1/3处采集分泌物,按课题组前期操作方法制备所需的分泌物样本液[6],用于阴道微环境因子的检测。同时用宫颈刷于宫颈口处顺时针旋转3~5圈收集宫颈脱落细胞,将其放入专用细胞保存液中,用于HPV的分型检测。
3.随访与分组:与基线HPV检测结果比较,将24个月后HR-HPV转为阴性者归为HR-HPV感染转阴,仍为阳性者归为HR-HPV持续感染。对HR-HPV持续感染者进一步将两次检测结果为相同型别或多重感染中至少有一种型别相同者归为同型持续感染,两次检测结果为不同型别者归为异型持续感染。
4.实验方法:
(1)HPV检测:应用导流杂交技术,采用HPV-DNA提取试剂盒及凯普21种HPV分型检测试剂盒对基线及随访24个月时采集的宫颈脱落细胞进行HPV的分型检测,其中HR-HPV包括HPV16、18、31、33、35、39、45、51、52、53、56、58、59、66和68。
(2)阴道微环境因子检测:参照课题组前期建立的方法[6],对基线收集的阴道分泌物进行阴道微环境因子的检测。阴道pH值采用pH精密试纸检测,pH值≤4.5判断为正常,pH值>4.5判断为异常;阴道清洁度Ⅰ~Ⅱ度判定为正常,Ⅲ~Ⅳ度判定为异常[7];阴道分泌物预成酶谱采用北京中生金域需氧菌性阴道炎/细菌性阴道病五项联合测定试剂盒检测,阴性或疑似阳性判断为正常,阳性判断为异常。
5.统计学分析:EpiData 3.1软件录入问卷,进行双录入和双核查。采用SPSS 22.0和GraphPad Prism 8.0.2软件进行统计学分析和作图。定量资料采用M(P25,P75)表示,定性资料采用频数及构成比(%)表示。组间各因素比较采用χ2检验、Fisher精确检验;采用非条件logistic回归模型计算OR值及95%CI。检验水准为α=0.05(双侧)。
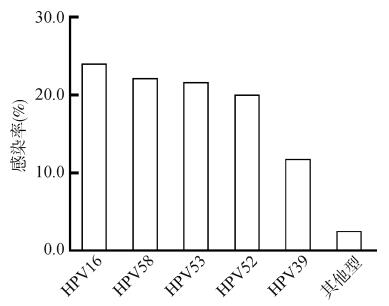
结果1.HR-HPV感染的转归特点:421名HR-HPV感染的女性中,390名(92.6%)完成了24个月的随访,且失访组与未失访组在一般人口学特征方面差异均无统计学意义(P>0.05)。基线资料显示,390名HR-HPV感染的女性中,位居前4位的型别分别为HPV16(22.3%)、HPV58(9.2%)、HPV52(7.7%)和HPV53(5.9%)。随访24个月后,有268名(68.7%)HR-HPV感染者转阴,122名(31.3%)发生持续感染,其中64名(64/122,52.5%)为同型持续感染。进一步以不同型别HR-HPV基线感染者为基数,对同型持续感染情况分析显示,HR-HPV持续感染率居前5位的型别依次为HPV16(21/87,24.1%)、HPV58(8/36,22.2%)、HPV53(5/23,21.7%)、HPV52(6/30,20.0%)和HPV39(2/17,11.8%)。见图 1。
|
| 图 1 HR-HPV持续感染的型别分布 |
2.HR-HPV感染转归的相关因素:HR-HPV感染转阴组和持续感染组的年龄分别为46(40,53)岁和51(41,56)岁,两组在年龄、文化程度、职业、婚姻状况、家庭年收入、洗澡频率、换内裤频率、性生活后清洗、非经期使用护垫、月经史、产次、流产史等方面均衡可比(P>0.05),而在洗阴频率(χ2=6.80,P=0.033)、绝经(χ2=5.12,P=0.024)方面差异有统计学意义。进一步对HR-HPV感染转阴组、同型持续感染组、异型持续感染组比较后发现,3组在洗阴频率(χ2=14.59,P=0.006)、绝经(χ2=7.45,P=0.024)方面差异仍有统计学意义。
3.阴道微环境因子与HR-HPV感染转归的关系:阴道pH值、唾液酸苷酶、白细胞酯酶的异常率在HR-HPV感染转阴组与持续感染组差异均有统计学意义(P < 0.05),阴道pH值、唾液酸苷酶和白细胞酯酶异常的女性发生HR-HPV持续感染的风险增大(表 1)。
4.阴道微环境因子与同型及异型HR-HPV持续感染的关系:唾液酸苷酶、白细胞酯酶异常率在HR-HPV感染转阴组、同型持续感染组、异型持续感染组差异有统计学意义(P < 0.05),唾液酸苷酶、白细胞酯酶异常均可增加同型和异型HR-HPV持续感染的风险(表 2)。
HR-HPV持续感染是导致子宫颈癌及癌前病变的最主要病因,本研究结果显示,随访24个月后有31.3%的女性发生了HR-HPV持续感染,以HPV16的持续感染率最高,其次为HPV58、53、52、39。Bulkmans等[8]的研究显示HPV16的清除率最低,其次为HPV31、33、18,Nielsen等[9]的研究表明HPV16、58、31相对于其他型别更容易发生持续感染。提示,尽管不同国家和地区HPV持续感染的型别有所不同,但HPV16容易发生持续感染为共同特征,特别值得注意的是,当地女性HPV58、53、52感染后也容易发生持续感染,在子宫颈癌变中的作用不容忽视。
阴道微生态是一个以乳杆菌为优势菌、pH值为3.8~4.5的酸性微环境,阴道清洁度、pH值、过氧化氢、唾液酸苷酶和白细胞酯酶作为重要的阴道微环境因子,对维持阴道微环境的平衡起着重要作用[10]。我们课题组前期研究发现阴道微环境因子紊乱可增加宫颈病变的发生风险[11],Clarke等[12]也发现阴道pH值升高可使HPV感染的风险增加,但有关阴道微环境因子对HR-HPV感染转归影响的研究甚少。本次基于巢式病例对照研究发现,阴道pH值、白细胞酯酶、唾液酸苷酶异常可增加HR-HPV持续感染的风险,提示阴道微环境因子的异常可作为HR-HPV持续感染的预警标志。
有研究显示,同型HR-HPV持续感染12个月的妇女阴道过氧化氢、唾液酸苷酶、白细胞酯酶的异常率均高于健康人群[13]。本研究在关注同型持续感染的同时,对异型持续感染也进行了分析,发现唾液酸苷酶、白细胞酯酶异常既可增加同型HR-HPV持续感染的风险,也可促进异型HR-HPV持续感染的发生。唾液酸苷酶可降解阴道黏液中的黏液蛋白,破坏阴道黏膜的物理屏障[14],增加HPV和上皮细胞的接触机会,容易导致HR-HPV的持续感染。白细胞酯酶异常作为阴道黏膜受损的标志[15],可通过破坏阴道黏膜屏障使HR-HPV入侵和持续感染的风险增大。同时,我们发现阴道pH值异常率在同型和异型HR-HPV持续感染组基本相近,但均较阴转组为高,而阴道过氧化氢这一乳酸菌分泌的主要产物异常更易增加异型HR-HPV持续感染的风险。提示保持阴道微环境的酸性状态,维持阴道乳酸菌的优势地位,恢复过氧化氢的正常比例,对于预防HR-HPV的持续感染具有重要意义。
本研究基于社区队列描述了HR-HPV感染转归的特点,获得当地容易发生持续感染的主要型别,揭示出唾液酸苷酶、白细胞酯酶在同型和异型HR-HPV持续感染中具有重要作用,为HR-HPV及不同型别的转归研究提供了重要证据,从阴道微环境因子的角度为HR-HPV持续感染的预测及早期干预开拓了新思路。然而,鉴于阴道微环境的多变性和HPV感染影响因素的复杂性,阴道微环境因子对HR-HPV感染转归的作用机制有待进一步研究。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359-386. DOI:10.1002/ijc.29210 |
| [2] |
Wang HY, Park S, Lee D, et al. Prevalence of type-specific oncogenic human papillomavirus infection assessed by HPV E6/E7 mRNA among women with high-grade cervical lesions[J]. Int J Infect Dis, 2015, 37: 135-142. DOI:10.1016/j.ijid.2015.06.018 |
| [3] |
Fajardo-Ramírez OR, Barboza-Cerda MC, Ortiz-López R, et al. Prevalence and 3-year persistence of human papillomavirus serotypes in asymptomatic patients in Northern Mexico[J]. Int J Gynecol Obstet, 2017, 136(1): 40-46. DOI:10.1002/ijgo.12009 |
| [4] |
张展, 张岱, 肖冰冰, 等. 高危型HPV感染与阴道菌群及子宫颈菌群关系的初步研究[J]. 中华妇产科杂志, 2018, 53(7): 471-480. Zhang Z, Zhang D, Xiao BB, et al. Primary study on the relationship between high-risk HPV infection and vaginal cervical microbiota[J]. Chin J Obstet Gynecol, 2018, 53(7): 471-480. DOI:10.3760/cma.j.issn.0529-567x.2018.07.006 |
| [5] |
Mongelos P, Mendoza LP, Rodriguez-Riveros I, et al. Distribution of human papillomavirus (HPV) genotypes and bacterial vaginosis presence in cervical samples from Paraguayan indigenous[J]. Int J Infect Dis, 2015, 39: 44-49. DOI:10.1016/j.ijid.2015.08.007 |
| [6] |
Li L, Ding L, Gao T, et al. Association between vaginal micro-environment disorder and cervical intraepithelial neoplasia in a community based population in China[J]. J Cancer, 2020, 11(2): 284-291. DOI:10.7150/jca.35022 |
| [7] |
中华人民共和国卫生部医政司. 全国临床检验操作规程[M]. 3版. 南京: 东南大学出版社, 2006: 234. Department of Medical Administration, Ministry of Health of the People's Republic of China. National guide to clinical laboratory procedures[M]. 3rd ed. Nanjing: Southeast University Press, 2006: 234. |
| [8] |
Bulkmans NWJ, Berkhof J, Bulk S, et al. High-risk HPV type-specific clearance rates in cervical screening[J]. Br J Cancer, 2007, 96(9): 1419-1424. DOI:10.1038/sj.bjc.6603653 |
| [9] |
Nielsen A, Kjaer SK, Munk C, et al. Persistence of high-risk human papillomavirus infection in a population-based cohort of Danish women[J]. J Med Virol, 2010, 82(4): 616-623. DOI:10.1002/jmv.21750 |
| [10] |
中华医学会妇产科学分会感染性疾病协作组. 阴道微生态评价的临床应用专家共识[J]. 中华妇产科杂志, 2016, 51(10): 721-723. Infectious Diseases Cooperative Group, Gynecology and Obstetrics Branch, Chinese Medical Association. Expert consensus on clinical application of vaginal microecological evaluation[J]. Chin J Obstet Gynecol, 2016, 51(10): 721-723. DOI:10.3760/cma.j.issn.0529-567x.2016.10.001 |
| [11] |
李俐, 丁玲, 吕元婧, 等. 阴道微环境改变与HPV16感染在宫颈上皮内瘤变中的作用及其交互效应[J]. 中华流行病学杂志, 2018, 39(11): 1486-1490. Li L, Ding L, Lyu YJ, et al. Interaction between vaginal micro-environment alterations and HPV16 infection in cervical intraepithelial neoplasia[J]. Chin J Epidemiol, 2018, 39(11): 1486-1490. DOI:10.3760/cma.j.issn.0254-6450.2018.11.013 |
| [12] |
Clarke MA, Rodriguez AC, Gage JC, et al. A large, population-based study of age-related associations between vaginal pH and human papillomavirus infection[J]. BMC Infect Dis, 2012, 12(1): 33. DOI:10.1186/1471-2334-12-33 |
| [13] |
廖婵婵, 瞿微微, 吕杰强. 高危型人乳头瘤病毒持续感染妇女阴道微生态状态分析[J]. 中国微生态学杂志, 2020, 32(5): 594-597. Liao CC, Qu WW, Lyu JQ. Clinical analysis of vaginal microecology in women with high risk HPV infection[J]. Chin J Microecol, 2020, 32(5): 594-597. DOI:10.13381/j.cnki.cjm.202005022 |
| [14] |
Lewis WG, Robinson LS, Gilbert NM, et al. Degradation, foraging, and depletion of mucus sialoglycans by the vagina-adapted Actinobacterium gardnerella vaginalis[J]. J Biol Chem, 2013, 288(17): 12067-12079. DOI:10.1074/jbc.M113.453654 |
| [15] |
Yue XA, Chen P, Tang Y, et al. The dynamic changes of vaginal microecosystem in patients with recurrent vulvovaginal candidiasis: a retrospective study of 800 patients[J]. Arch Gynecol Obstet, 2015, 292(6): 1285-1294. DOI:10.1007/s00404-015-3774-2 |
 2021, Vol. 42
2021, Vol. 42