文章信息
- 肖艳慧, 常少英, 白霜, 赵润毛, 王洁红, 王学秋, 杨云凯, 马燕丽, 刘小琴, 罗林云, 吕敏, 陈海平.
- Xiao Yanhui, Chang Shaoying, Bai Shuang, Zhao Runmao, Wang Jiehong, Wang Xueqiu, Yang Yunkai, Ma Yanli, Liu Xiaoqin, Luo Linyun, Lyu Min, Chen Haiping
- 4~6岁儿童接种麻疹-流行性腮腺炎-风疹联合减毒活疫苗加强免疫的免疫原性与安全性研究
- Immunogenicity and safety of a boost dose of measles, mumps, and rubella combined vaccine for 4-6 years old children
- 中华流行病学杂志, 2021, 42(6): 1086-1091
- Chinese Journal of Epidemiology, 2021, 42(6): 1086-1091
- http://dx.doi.org/10.3760/cma.j.cn112338-20200409-00541
-
文章历史
收稿日期: 2020-04-09
2. 山西省疾病预防控制中心, 太原 030012;
3. 北京市疾病预防控制中心 100013;
4. 乌兰察布市卫生健康委员会 012000;
5. 运城市盐湖区疾病预防控制中心 044000;
6. 和林格尔县疾病预防控制中心 011599;
7. 北京生物制品研究所有限责任公司 100176
2. Shanxi Provincial Center for Disease Control and Prevention, Taiyuan 030012, China;
3. Beijing Center for Disease Control and Prevention, Beijing 100013, China;
4. Ulan Qab Municipal Health Commission, Ulan Qab 012000, China;
5. Yanhu Center for Disease Control and Prevention, Yuncheng 044000, China;
6. Horinger Center for Disease Control and Prevention, Horinger 011599, China;
7. Beijing Institute of Biological Products Company Limited, Beijing 100176, China
麻疹、风疹以及流行性腮腺炎是由麻疹病毒、风疹病毒、腮腺炎病毒引起的,具有高度传染性的疾病,也是我国的主要公共卫生问题之一。自2005年WHO提出消灭麻疹计划以来,我国在消除麻疹方面取得了巨大进展,近几年的麻疹病例,发病率和暴发率均处于历史低位[1]。目前,麻疹-流行性腮腺炎-风疹联合减毒活疫苗(measles,mumps and rubella combined vaccine,MMR)和麻疹-风疹联合减毒活疫苗(measles and rubella combined vaccine,MR)是我国使用最普遍的含麻疹成分疫苗,已被证实具有良好的免疫原性与安全性[2-4]。在我国高疫苗接种覆盖率的情况下,仍有麻疹、流行性腮腺炎以及风疹的小范围流行[5-7],提示需要探讨第3剂含麻疹成分疫苗接种的必要性。本研究将来自山西省、内蒙古自治区以及北京市的535名儿童,在4~6岁时接种1剂MMR疫苗,进行免疫原性与安全性研究,为进一步探索MMR疫苗免疫程序提供依据。
材料与方法1.样本量估计:采用样本量计算公式: 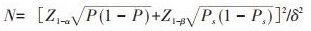
2.研究对象:本研究与山西省、内蒙古自治区、北京市CDC合作开展。2016年6-12月,分别在3个省招募4~6岁儿童进行MMR疫苗加强免疫研究。研究组1(4岁组):在山西省招募150名曾于8、18月龄分别接种过1剂MR疫苗和MMR疫苗的4岁儿童为观察对象,接种1剂MMR疫苗,剂量0.5 ml,接种前与接种后35~42 d各采血标本3 ml。研究组2(5岁组):在内蒙古自治区招募150名曾于8、18月龄分别接种过1剂MR疫苗和MMR疫苗的5岁儿童为观察对象,接种1剂MMR疫苗,剂量0.5 ml,接种前与接种后35~42 d各采血标本3 ml。研究组3(6岁组):在北京市共招募150名曾于8、18月龄分别接种过1剂MR疫苗和MMR疫苗的6岁儿童为观察对象,接种1剂MMR疫苗,剂量0.5 ml,接种前与接种后35~42 d各采血标本3 ml。
3.纳入与排除标准:纳入标准:其监护人知情同意,并签署知情同意书;既往未患麻疹、流行性腮腺炎、风疹;1个月内未接种其他预防制品;腋下体温≤37 ℃者;本地户籍人口或流动性较小人口。排除标准:已知对研究疫苗中的任何成分过敏者;患急性疾病、严重慢性疾病、慢性疾病的急性发作者;在过去1个月内曾有过出疹性疾病感染者;在过去4周内曾接受其他疫苗或免疫球蛋白注射、任何研究性药物者;免疫缺陷、免疫功能低下或正在接受免疫抑制治疗者。
通过体格检查,符合纳入与排除标准的研究对象,其监护人在阅读并完全理解知情同意书的内容后,签署知情同意书。本研究通过北京市CDC伦理委员会的伦理审批。临床试验注册于ClinicalTrials.gov,注册编号NCT03160820。
4.研究疫苗:本研究使用的研究疫苗为北京生物制品研究有限责任公司(原北京天坛生物制品股份有限公司)生产的麻腮风联合减毒活疫苗。该疫苗通过用麻疹病毒沪191减毒株和腮腺炎病毒S79减毒株分别接种原代鸡胚细胞,用风疹病毒BRDⅡ减毒株接种MRC-5株人二倍体细胞,经培养、分别收获3种病毒液,按比例混合配制,加稳定剂冻干制成。主要成分为减毒的麻疹活毒株(≥3.0 lgCCID50)、减毒的腮腺炎活毒株(≥3.7 lgCCID50)和减毒的风疹活毒株(≥3.0 lgCCID50)和辅料。本次研究疫苗经中国药品生物制品检定所检定合格,批号为201512045,有效期至2017年6月8日。
5.抗体检测:所有采集到的血标本及时进行血清分离,分成2份保存于-20℃冰箱。血清使用ELISA法进行麻疹、腮腺炎、风疹的IgG抗体滴度检测,检测试剂盒由德国维润赛润研发有限公司生产。麻疹抗体滴度≥200 mIU/ml为保护性抗体阳性界值;风疹抗体滴度≥20 IU/ml为保护性抗体阳性界值;腮腺炎抗体滴度≥100 IU/ml为保护性抗体阳性界值。所有检测均在江苏省CDC实验室开展。
6.安全性监测:在疫苗接种后30 min、1 d、2 d、3 d及4~12 d,对研究对象进行不良事件的主动监测。疫苗接种后的13~42 d,采用被动监测与每周定期随访相结合。所有搜集到的不良事件和体征由负责随访的医师记录在麻腮风减毒活疫苗预防接种日记卡。
7.质量控制:研究实施前,对所有工作人员根据其参与的工作性质与内容分别进行培训,经考核合格后参与本研究,3个临床现场中心的岗前培训标准统一,以确保各中心的工作实施质量。在研究期间,对临床研究进行全程监督,确保现场操作与流程符合方案要求。病例报告表的数据通过EpiData 3.0软件进行双录入,确保数据库信息准确。
8.统计学分析:使用Stata 15软件进行统计分析。本研究观察对象的麻疹、腮腺炎和风疹抗体浓度以几何平均浓度(geometric mean concentration,GMC)及其95%CI表示。当GMC符合正态分布时,3个研究组间比较统计方法采用方差分析,若不符合正态分布,统计方法采用非参数检验。对于抗体阳性率及不良事件发生率的组间比较,采用χ2检验,当最小理论频数 < 1时,采用Fisher确切概率法。P < 0.05为差异有统计学意义。
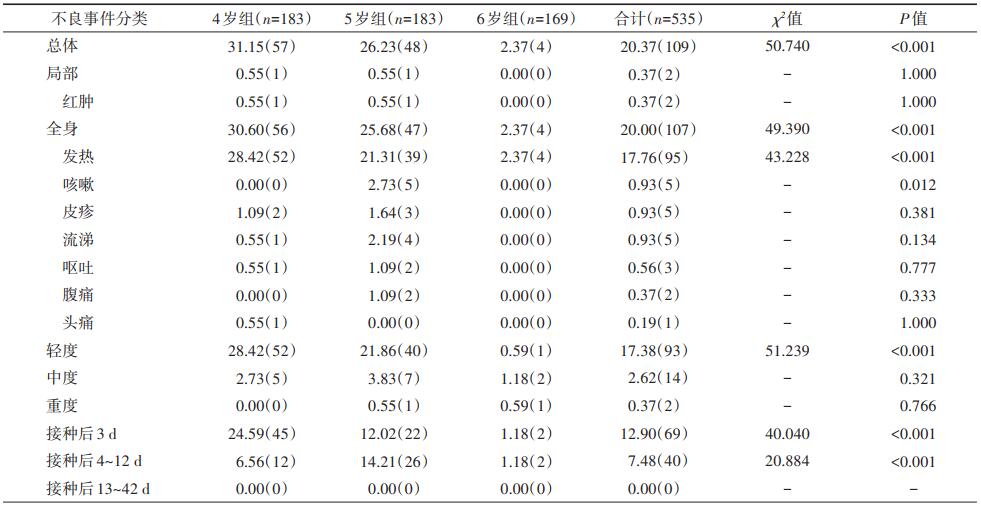
结果1.基本情况:共551名儿童入组并完成免前采血和疫苗接种,500名儿童(90.74%)完成免后采血,依从性良好,535名儿童的安全性数据纳入统计分析。见表 1。
2.安全性结果:本研究总体不良事件发生率为20.37%,4、5、6岁组不良事件发生率分别为31.15%、26.23%、2.37%,组间发生率差异有统计学意义(P < 0.001);全身不良事件发生率分别为30.60%、25.68%、2.37%,组间发生率差异有统计学意义(P < 0.001),其中以发热症状为主,其次为咳嗽、皮疹、流涕等。按照不良事件严重程度级别进行分析,轻度(1级)最多(17.38%),中度(2级)和重度(3级)反应的发生率分别为2.62%和0.37%。从不良事件发生的时间分析,4、5、6岁组均为接种后3 d内的不良事件发生率最高,分别为24.59%、12.02%、1.18%,其次为接种后4~12 d,各组在接种后13~42 d均无不良事件发生。见表 2。
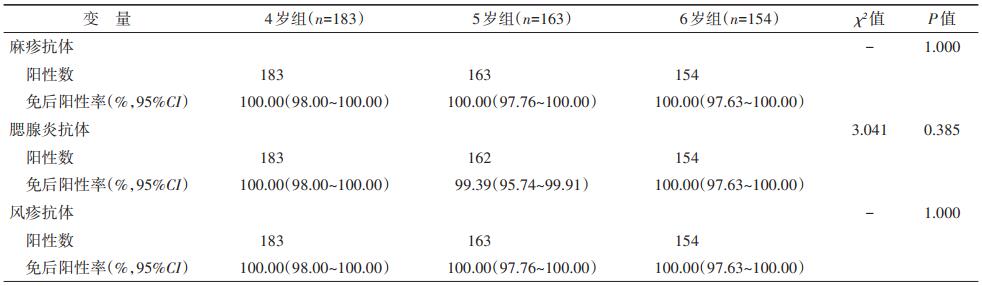
3.免疫原性结果:在4、5、6岁进行1剂MMR疫苗加强免疫后,麻疹抗体、腮腺炎抗体与风疹抗体阳性率均 > 99%,组间阳性率差异无统计学意义。见表 3。
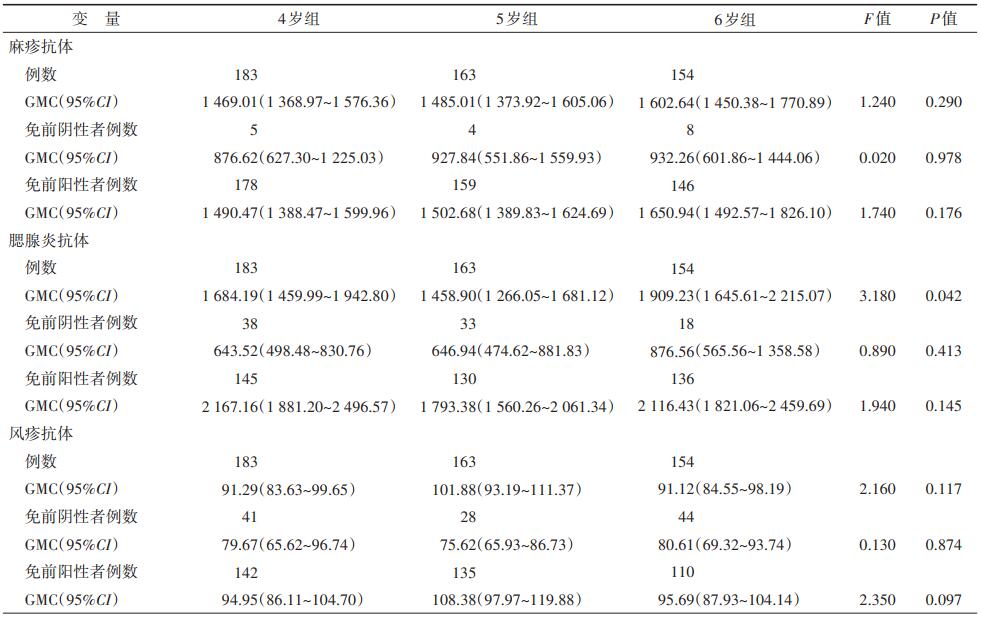
在4、5和6岁进行1剂MMR疫苗加强免疫后的麻疹、风疹抗体GMC组间差异无统计学意义,腮腺炎抗体GMC组间差异有统计学意义(P=0.042);对于免前阴性者及免前阳性者,3种抗体的组间差异也均无统计学意义,且免前阴性者的抗体GMC均低于免前阳性者。见表 4。
2008年我国实施8月龄接种MR疫苗,18月龄接种MMR疫苗的国家免疫规划程序,北京、上海等部分省份在此程序基础上,增加4~6岁儿童1剂MMR疫苗的加强接种。目前在4、5和6岁时进行MMR疫苗加强接种后的免疫效果及安全性是否存在差异尚不清楚。本研究将已完成MR疫苗和MMR疫苗接种的4~6岁儿童分成3个研究组,结果显示4、5和6岁组进行MMR疫苗加强接种后均具有良好的免疫原性与安全性。总体不良事件发生率为20.37%,具有严重程度以轻度为主,症状以发热为主,发生时间以接种后3 d内为主的特征,这与其他研究结果一致[2, 4, 10]。本研究中6岁组的不良事件发生率显著低于4、5岁组,可能是由于6岁组儿童的耐受性好,但仍需进一步研究验证是否6岁组的不良反应低于4、5岁组。
国内相关研究结果显示[11],4岁儿童接种1剂MMR疫苗后,麻疹、腮腺炎与风疹抗体的免后阳性率均在99%以上,抗体GMC分别为1 172.73、1 512.63和115.89,与本研究结果一致,表明MMR疫苗加强免疫后可产生较好的免疫效果。本研究的结果进一步发现,3组接种1剂MMR疫苗后的阳性率与抗体GMC水平,在组间无显著差异,提示在4~6岁期间进行MMR疫苗加强免疫可产生相近的免疫效果。
对于加强免疫之前麻疹抗体为阴性的4~6岁儿童,在完成加强免疫后抗体虽转为阳性(麻疹抗体滴度≥200 mIU/ml),但麻疹抗体GMC水平仍显著低于加强免疫前为阳性的儿童,这一规律在腮腺炎与风疹抗体的结果中也存在。LeBaron等[12]研究发现,对于完成基础免疫后抗体高于平均水平的人,再次加强免疫后的抗体水平通常会升至更高,并维持在较高的水平。这可能是由于机体的内在调节过程维持着特定的抗体水平,提示遗传因素可能在影响不同个体产生抗体的最佳稳定状态中起着重要作用。一些国外研究结果显示,在接种含麻疹成分疫苗后,刺激机体产生的麻疹、腮腺炎与风疹抗体水平与人类白细胞抗原基因(HLA)、Wilms肿瘤蛋白基因(WT1)等多种基因有关,例如HLA纯合子与麻疹、腮腺炎特异性抗体水平降低有关[13-16]。
国内相关研究表明,2剂腮腺炎疫苗对流行性腮腺炎发病的保护效果优于单剂,对于仅接种1剂含腮腺炎成分疫苗的儿童,在小学阶段的腮腺炎抗体已明显下降,而在学龄前儿童中加强1剂MMR疫苗能显著提高腮腺炎抗体水平[11, 17-19]。为了进一步消除麻疹,防控腮腺炎与风疹疫情,自2020年我国将8月龄接种MMR疫苗纳入国家免疫规划程序。建议在综合考虑成本效益、财政支持等因素下,尽早对已经完成8月龄MR疫苗与18月龄MMR疫苗接种的4~6岁儿童进行1剂MMR疫苗加强免疫。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Ma C, Rodewald L, Hao LX, et al. Progress toward measles elimination -China, January 2013-June 2019[J]. MMWR Morb Mortal Wkly Rep, 2019, 68(48): 1112-1116. DOI:10.15585/mmwr.mm6848a2 |
| [2] |
刘国华, 方悍华, 冯子健, 等. 冻干麻疹-腮腺炎-风疹三联活疫苗免疫安全性及免疫学效果观察[J]. 中华流行病学杂志, 2002, 23(6): 435-437. Liu GH, Fang HH, Feng ZJ, et al. Studies on the safety and immunogenicity of lyophilized live attenuated measles-mumps-rubella combined vaccine[J]. Chin J Epidemiol, 2002, 23(6): 435-437. DOI:10.3760/j.issn:0254-6450.2002.06.007 |
| [3] |
徐宏基, 李微, 夏建华, 等. 国产冻干麻疹腮腺炎风疹联合减毒活疫苗的接种反应和免疫原性观察[J]. 中国生物制品学杂志, 2008, 21(12): 1111-1114. Xu HJ, Li W, Xia JH, et al. Adverse reaction and immunogenicity induced by domestic freeze-dried live attenuated measles-mumps-rubella combined vaccine[J]. Chin J Biol, 2008, 21(12): 1111-1114. DOI:10.13200/j.cjb.2008.12.84.xuhj.011 |
| [4] |
He HQ, Chen EF, Chen HP, et al. Similar immunogenicity of measles-mumps-rubella (MMR) vaccine administrated at 8 months versus 12 months age in children[J]. Vaccine, 2014, 32(31): 4001-4005. DOI:10.1016/j.vaccine.2014.04.044 |
| [5] |
蒋蕊鞠, 殷琼洲, 徐明珏, 等. 2004-2018年全国流行性腮腺炎发病特征及重点防控人群分析[J]. 中国当代儿科杂志, 2019, 21(5): 441-444. Jiang RJ, Yin QZ, Xu MJ, et al. Epidemiological characteristics of mumps in mainland China from 2004 to 2018 and key population for prevention and control[J]. Chin J Contemp Pediatr, 2019, 21(5): 441-444. DOI:10.7499/j.issn.1008-8830.2019.05.008 |
| [6] |
马超, 郝利新, 苏琪茹, 等. 中国2014年麻疹流行病学特征分析[J]. 疾病监测, 2015, 30(10): 818-823. Ma C, Hao LX, Su QR, et al. Measles epidemiology in China, 2014[J]. Dis Surveill, 2015, 30(10): 818-823. DOI:10.3784/j.issn.1003-9961.2015.10.006 |
| [7] |
赵苗苗, 苏琪茹, 马超, 等. 中国2005-2016年风疹突发公共卫生事件流行病学特征[J]. 中国疫苗和免疫, 2019, 25(3): 243-247. Zhao MM, Su QR, Ma C, et al. Epidemiological characteristics of rubella public health emergency events in China, 2005-2016[J]. Chin J Vacc Immun, 2019, 25(3): 243-247. |
| [8] |
A'Hern RP. Sample size tables for exact single-stage phase Ⅱ designs[J]. Stat Med, 2001, 20(6): 859-866. DOI:10.1002/sim.721 |
| [9] |
唐欣然, 黄耀华, 王杨, 等. 单组目标值试验样本量计算方法的比较研究[J]. 中华疾病控制杂志, 2013, 17(11): 993-996. Tang XR, Huang YH, Wang Y, et al. Comparison of sample size calculation methods for single arm OPC trials[J]. Chin J Dis Control Prev, 2013, 17(11): 993-996. |
| [10] |
Meng FY, Sun Y, Shen YG, et al. Safety of measles-containing vaccines in post-marketing surveillance in Anhui, China[J]. PLoS One, 2017, 12(2): e0172108. DOI:10.1371/journal.pone.0172108 |
| [11] |
何寒青, 严睿, 马燕丽, 等. 4岁儿童麻疹-流行性腮腺炎-风疹联合减毒活疫苗加强免疫的安全性和免疫原性观察[J]. 中华微生物学和免疫学杂志, 2018, 38(1): 62-66. He HQ, Yan R, Ma YL, et al. Immunogenicity and safety of a booster dose of live attenuated measles-mumps-rubella vaccine for 4-year-old children[J]. Chin J Microbiol Immunol, 2018, 38(1): 62-66. DOI:10.3760/cma.j.issn.0254-5101.2018.01.010 |
| [12] |
LeBaron CW, Beeler J, Sullivan BJ, et al. Persistence of measles antibodies after 2 doses of measles vaccine in a postelimination environment[J]. Arch Pediatr Adolesc Med, 2007, 161(3): 294-301. DOI:10.1001/archpedi.161.3.294 |
| [13] |
St Sauver JL, Ovsyannikova IG, Jacobson RM, et al. Associations between human leukocyte antigen homozygosity and antibody levels to measles vaccine[J]. J Infect Dis, 2002, 185(11): 1545-1549. DOI:10.1086/340573 |
| [14] |
Ovsyannikova IG, Jacobson RM, Vierkant RA, et al. Associations between human leukocyte antigen (HLA) alleles and very high levels of measles antibody following vaccination[J]. Vaccine, 2004, 22(15/16): 1914-1920. DOI:10.1016/j.vaccine.2003.11.016 |
| [15] |
St Sauver JL, Dhiman N, Ovsyannikova IG, et al. Extinction of the human leukocyte antigen homozygosity effect after two doses of the measles-mumps-rubella vaccine[J]. Hum Immunol, 2005, 66(7): 788-798. DOI:10.1016/j.humimm.2005.03.008 |
| [16] |
Voigt EA, Haralambieva IH, Larrabee BL, et al. Polymorphisms in the wilms tumor gene are associated with interindividual variations in rubella virus-specific cellular immunity after measles-mumps-rubella Ⅱ vaccination[J]. J Infect Dis, 2018, 217(4): 560-566. DOI:10.1093/infdis/jix538 |
| [17] |
马蕊, 卢莉, 索罗丹, 等. 从免疫原性角度初探北京市儿童6岁龄接种麻腮风联合减毒活疫苗的必要性[J]. 中国疫苗和免疫, 2018, 24(2): 156-159. Ma R, Lu L, Suo LD, et al. Immunogenicity-based study on the necessity of measles, mumps and rubella combined attenuated live revaccination of 6-year-old children in Beijing[J]. Chin J Vacc Immun, 2018, 24(2): 156-159. |
| [18] |
Zhang L, Wang ZG, Hu Y, et al. Application of a mixture model to assess the effect of measles-mumps-rubella vaccine on the mumps epidemic in children from kindergarten to early school age in Jiangsu Province, China[J]. Human Vaccin Immunother, 2018, 14(11): 2654-2659. DOI:10.1080/21645515.2018.1480239 |
| [19] |
Sun X, Tang FY, Hu Y, et al. High risk of mumps infection in children who received one dose of mumps-containing vaccine: waning immunity to mumps in children aged 2-5 years from kindergartens in Jiangsu Province, China[J]. Human Vaccin Immunother, 2020, 16(7): 1738-1742. DOI:10.1080/21645515.2019.1708162 |
 2021, Vol. 42
2021, Vol. 42