文章信息
- 辛鹏, 江国虹, 郑文龙, 范莉莉, 李昌昆, 王德征.
- Xin Peng, Jiang Guohong, Zheng Wenlong, Fan Lili, Li Changkun, Wang Dezheng
- 天津市吸烟成年人膳食平衡指数及与血尿酸关系的研究
- Study on the diet balance index and its relationship with blood uric acid of smoking adults in Tianjin
- 中华流行病学杂志, 2021, 42(6): 1076-1079
- Chinese Journal of Epidemiology, 2021, 42(6): 1076-1079
- http://dx.doi.org/10.3760/cma.j.cn112338-20200806-01029
-
文章历史
收稿日期: 2020-08-06
膳食营养因素在慢性非传染性疾病的发生与发展中扮演着非常重要的角色,而吸烟人群的膳食情况相较于普通成年人更加不合理,以往研究显示吸烟可引起味觉和体内代谢变化,从而导致饮食习惯的改变,如脂肪摄入过多、蔬菜水果摄入减少等[1]。
为了全面科学地评价居民膳食摄入情况,世界各国依据国情建立了多种膳食质量评价指数。我国何宇纳等[2]以中国居民膳食指南及平衡膳食宝塔为依据,于2005年建立了中国膳食平衡指数(diet balance index,DBI),在2016年根据新版《中国居民膳食指南》相应修订了中国DBI_16。相比于国外的膳食评价体系,DBI_16更符合中国居民膳食特点,能更好地反映中国居民的膳食结构与营养状况。目前广东等省份基于该DBI方法评价该地区膳食质量[3],但少有研究对吸烟人群的膳食与血尿酸关系进行分析。
对象与方法1. 研究对象:根据原国家卫生和计划生育委员会组织的“2015年中国成年人慢性病与营养监测”重大项目,2015年9-12月在天津市7个区(河西、南开、红桥、武清、津南、宝坻、蓟州)对成年人常住居民进行调查,排除戒烟者后,共收集到有完整吸烟信息与3 d膳食数据者1 478人,研究通过了中国CDC伦理审查委员会的审查(审批号:201519-B)。
2. 研究方法:
(1)问卷调查:采用一对一面对面访谈,收集个人基本信息(性别、年龄、吸烟情况等)。
(2)膳食调查:通过连续3天24小时膳食回顾调查收集居民膳食信息。通过3 d调味品称重调查获得每日盐、油摄入量。
(3)DBI的计算:按照DBI_16的计算方法[2],对每名调查对象的7个指标的食物摄入量进行赋值和计算,分别为谷类食物、蔬菜水果、奶类及大豆类、动物性食物、纯能量食物(烹调油、酒精饮料)、调味品(添加糖、食盐)、摄入食物种类。当各指标达到推荐量时赋值为0。膳食指南中强调“多吃”或“常吃”的食物,赋负值,重点评价摄入不足。膳食指南中要求少吃的食物,重点评价过量,赋正值。指南中强调适量食用的食物,取正负值,既评价摄入不足也评价摄入过量。再计算出每名调查对象的正端分(high bound score,HBS-DBI)、负端分(low bound score,LBS-DBI)和膳食质量距(diet quality distance,DQD-DBI)的分值。
HBS-DBI:将所有指标中的正分相加的绝对值,代表膳食摄入过量的程度。无摄入过量(0分)、较适宜(1~分)、低度摄入过量(10~分)、中度摄入过量(19~分)、高度摄入过量(> 27分)。
LBS-DBI:将所有指标中的负分相加的绝对值,代表膳食摄入不足的程度。无摄入不足(0分)、较适宜(1~分)、低度摄入不足(13~分)、中度摄入不足(25~分)、高度摄入不足(> 36分)。
DQD-DBI:每个指标得分的绝对值相加,综合反映膳食摄入质量的均衡情况,摄入均衡(0分)、较适宜(1~分)、低度膳食失衡(20~分)、中度膳食失衡(39~分)、高度膳食失衡(> 57分)。在研究吸烟情况、DQD-DBI与血尿酸的关系中,将DQD-DBI的“较适宜”情况归为“较适宜”,将“低度膳食失衡、中度膳食失衡、高度膳食失衡”归为“非适宜”。
(4)血尿酸检测:采用空腹静脉血重组尿酸氧化酶法测定血尿酸值。
3. 统计学分析:用SPSS 18.0软件进行统计描述和统计推断。各种食物摄入量、血尿酸及DBI各分值用M(P25,P75)表示,样本的M差异比较用Kruskal-Wallis检验进行统计学分析,计算χ2值。检验水准α=0.05。
结果1. 基本情况:调查对象中有吸烟者409例,不吸烟者1 069例,吸烟比例为27.7%。吸烟者与不吸烟者的性别、年龄、城乡分布见表 1。
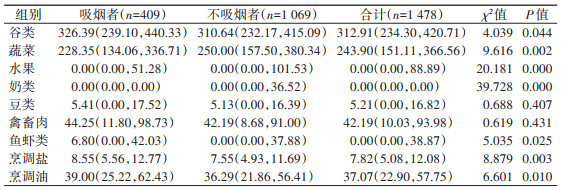
2. 各类食物的摄入情况:天津市吸烟者蔬菜、水果、奶类摄入量均低于不吸烟者,烹调盐、烹调油、谷类、鱼虾类均高于不吸烟者;而豆类、禽畜肉摄入量在两组间的差异无统计学意义。见表 2。
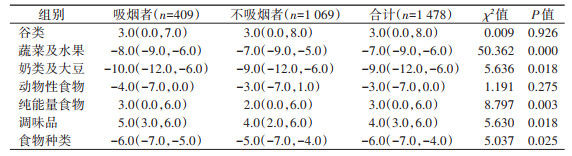
3. 各类食物DBI_16评分:天津市吸烟者蔬菜水果、食物种类、奶类及大豆类评分均低于不吸烟者,而纯能量食物及调味品评分高于不吸烟者。谷类、动物性食物评分在两组间差异无统计学意义。见表 3。
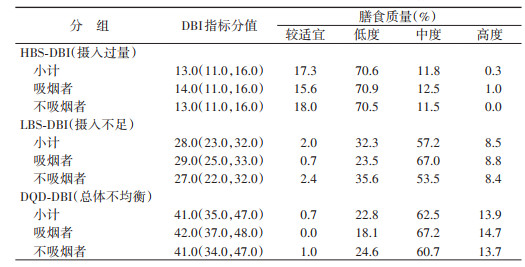
4. DBI指标分值分布:吸烟者与不吸烟者HBS-DBI得分的M分别为14.0、13.0,两组人群均有约71%的人存在低度膳食摄入过量问题。吸烟者与不吸烟者LBS-DBI得分的M分别为29.0、27.0,吸烟者有67.0%的人存在中度摄入不足问题,高于不吸烟者的53.5%。吸烟者与不吸烟者DQD-DBI得分M分别为42.0、41.0,吸烟者有67.2%的人存在中度摄入不均衡问题,高于不吸烟者的60.7%。见表 4。
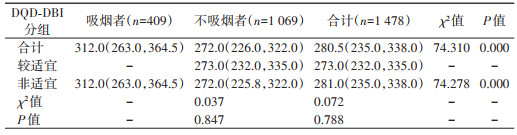
5. 不同DQD-DBI分组与血尿酸的关系:吸烟者的血尿酸为312.0 μmol/L,明显高于不吸烟者的272.0 μmol/L。将DQD-DBI按分值分为两大组(较适宜与非适宜),发现吸烟者中不存在“较适宜”情况;而在“非适宜”情况下,吸烟者的血尿酸亦明显高于非吸烟者。见表 5。
人们对营养问题的关注逐步从单个营养素和食物,开始转变为对整体膳食情况的评价,这种基于公共卫生宏观视角的评价体系,可以更加全面、科学地了解人群膳食结构均衡与否。DBI能够反映膳食中各大类食物的摄入情况,评价食物摄入过量或摄入不足的情况,以针对膳食问题提出相应的改善建议[2]。
吸烟是导致多种疾病的独立危险因素,尤其是对心脑血管疾病[4]。除此之外,吸烟者的膳食情况往往也不容乐观,如成年人吸烟与蔬菜水果消费量呈负相关[5]。以往研究提示,吸烟本身就可以增加罹患心脑血管疾病的风险,再加上吸烟者膳食结构又不合理,可能会成为慢性病发生发展的双重危险因素。
本研究发现天津地区居民摄入不足和摄入过量问题同时存在,摄入不足问题表现在蔬菜、水果、奶类、豆类、鱼虾类,摄入过量问题则表现在烹调盐、烹调油方面。
利用DBI_16对天津市吸烟与不吸烟成年人膳食平衡情况进行分析,发现吸烟人群纯能量食物与调味品的摄入均过量,得分高于不吸烟者;蔬菜水果、食物种类和奶类及大豆类明显存在摄入不足,得分低于不吸烟者。以上结果提示吸烟人群呈现出较不吸烟者更为不均衡的膳食情况。
再以HBS-DBI、LBS-DBI、DQD-DBI对膳食情况进行综合评价,发现天津市吸烟人群同时存在中度膳食失衡、低度摄入过量和中度摄入不足状态,表现出摄入不足问题相较于摄入过量更为严重,这与前述结果相印证;在DQD-DBI膳食质量分布中,可以看到吸烟人群没有“较适宜”者,大部分人群处于“中度”的膳食失衡,这与全国研究结果基本一致[3]。
尿酸升高不仅是引起痛风的重要生化基础,还是多种慢性病发生发展的独立危险因素[6]。烟草可促进尿酸的生成[7],而戒烟可预防尿酸的升高[8]。已有研究证明,多吃新鲜蔬菜或水果是高尿酸的保护因素[9],而肉类、海产品等食物摄入过多,乳制品摄入减少,是尿酸升高的危险因素[10]。
本研究结果显示,吸烟人群尿酸明显高于不吸烟者,与以往研究结果类似[11],这可能是吸烟和膳食不均衡共同作用所致。将DQD-DBI按分值分为“较适宜”与“非适宜”两类,发现吸烟者中不存在“较适宜”情况,直接证明了吸烟者膳食结构亟待改善。本研究为横断面调查,未考虑药物的使用所造成的影响,且某些被调查者的饮食习惯可能会改变,这些都可能会掩盖膳食因素与血尿酸间的关系。
综上所述,天津市吸烟人群膳食结构相比于不吸烟者,膳食结构更加不合理,存在低度摄入过量、中度摄入不足和中度摄入失衡状况,且吸烟人群血尿酸高于不吸烟者,需要加强对吸烟人群的平衡膳食健康指导。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
King G, Grizeau D, Bendel R, et al. Smoking behavior among French and American women[J]. Prev Med, 1998, 27(4): 520-529. DOI:10.1006/pmed.1998.0332 |
| [2] |
何宇纳, 房玥晖, 夏娟. 中国膳食平衡指数的修订: DBI_16[J]. 营养学报, 2018, 40(6): 526-530. He YN, Fang YH, Xia J. Update of the Chinese diet balance index: DBI_16[J]. Acta Nutrim Sin, 2018, 40(6): 526-530. DOI:10.13325/j.cnki.acta.nutr.sin.2018.06.003 |
| [3] |
徐宁, 纪桂元, 效拟, 等. 膳食平衡指数评价广东省成年居民膳食质量[J]. 华南预防医学, 2020, 46(2): 116-119, 124. Xu N, Ji GY, Xiao N, et al. Evaluation of dietary quality of adults using revised dietary balance index in Guangdong Province[J]. South China J Prev Med, 2020, 46(2): 116-119, 124. DOI:10.12183/j.scjpm.2020.0116 |
| [4] |
吴寿岭, 钟吉文, 王丽晔, 等. 高血压前期人群中心脑血管事件发生情况及影响因素[J]. 中华高血压杂志, 2012, 20(3): 247-251. Wu SL, Zhong JW, Wang LY, et al. The incidence of cardiovascular events and its related risk factors in prehypertensive population[J]. Chin J Hypertens, 2012, 20(3): 247-251. DOI:10.16439/j.cnki.1673-7245.2012.03.013 |
| [5] |
Haibach JP, Homish GG, Collins RL, et al. An evaluation of fruit and vegetable consumption and cigarette smoking among youth[J]. Nicotine Tob Res, 2015, 17(6): 719-726. DOI:10.1093/ntr/ntu215 |
| [6] |
Zhu YY, Pandya BJ, Choi HK. Comorbidities of gout and hyperuricemia in the US general population: NHANES 2007-2008[J]. Am J Med, 2012, 125(7): 679-687. DOI:10.1016/j.amjmed.2011.09.033 |
| [7] |
Hsu PF, Chuang SY, Cheng HM, et al. Associations of serum uric acid levels with arterial wave reflections and central systolic blood pressure[J]. Int J Cardiol, 2013, 168(3): 2057-2063. DOI:10.1016/j.ijcard.2013.01.164 |
| [8] |
Teng GG, Tan CS, Santosa A, et al. Serum urate levels and consumption of common beverages and alcohol among Chinese in Singapore[J]. Arthritis Care Res (Hoboken), 2013, 65(9): 1432-1440. |
| [9] |
Lyu LC, Hsu CY, Yeh CY, et al. A case-control study of the association of diet and obesity with gout in Taiwan[J]. Am J Clin Nutr, 2003, 78(4): 690-701. DOI:10.1093/ajcn/78.4.690 |
| [10] |
Choi HK, Liu SM, Curhan G. Intake of purine-rich foods, protein, and dairy products and relationship to serum levels of uric acid: the Third national health and nutrition examination survey[J]. Arthritis Rheum, 2005, 52(1): 283-289. DOI:10.1093/ajcn/78.4.690 |
| [11] |
万晋迪, 仲怀琴, 关国跃, 等. 吸烟对某地区居民血尿酸水平的影响研究[J]. 中国预防医学杂志, 2020, 21(3): 245-248. Wan JD, Zhong HQ, Guan GY, et al. Effect of smoking on blood uric acid level of residents in a community[J]. Chin Prev Med, 2020, 21(3): 245-248. DOI:10.16506/j.1009-6639.2020.03.002 |
 2021, Vol. 42
2021, Vol. 42