文章信息
- 杜慧, 王伟, 丛艳丽, 张敬坡, 郭玉, 张振国, 李琦.
- Du Hui, Wang Wei, Cong Yanli, Zhang Jingpo, Guo Yu, Zhang Zhenguo, Li Qi
- 河北省D8基因型麻疹病毒输入性疫情监测及基因型特征分析
- Surveillance and genetic characteristics of imported cases of measles virus of D8 genotype in Hebei province
- 中华流行病学杂志, 2021, 42(6): 1012-1017
- Chinese Journal of Epidemiology, 2021, 42(6): 1012-1017
- http://dx.doi.org/10.3760/cma.j.cn112338-20200904-01128
-
文章历史
收稿日期: 2020-09-04
2. 河北医科大学第一医院肝胆胰脾外科, 石家庄 050000
2. Department of Hepatic-biliary-pancreatic-splenic Surgery, The First Hospital of Hebei Medical University, Shijiazhuang 050000, China
麻疹是由麻疹病毒引起的一种急性、全身性、出疹性呼吸道传染病,严重威胁我国儿童健康。自有监测记录以来,河北省流行的麻疹病毒均为H1基因型[1-2],2019年11月河北省监测到了1例6岁儿童D8基因型麻疹散发病例,1个多月后又监测到多例D8基因型麻疹病例,自2020年1月9日至2月18日共发现确诊病例35例。河北省由D8基因型麻疹病毒引起的感染病例全部集中在邯郸市成安县、邯山区等8个县(区),共确诊病例36例。本研究分析河北省D8基因型麻疹病毒输入性疫情流行及基因型特征,为加强麻疹病毒分子流行病学监测,及时制定麻疹防控策略提供参考依据。
资料与方法1.资料来源:中国疾病预防控制信息系统麻疹监测信息报告管理系统D8基因型麻疹病毒病例数据(2019年1月1日至2020年6月30日)。
2.麻疹病例相关定义[3]:① 监测病例:发热、出疹,伴咳嗽、卡他性鼻炎、结膜炎、淋巴结肿大、关节炎/关节痛症状之一者,或传染病责任疫情报告人怀疑为麻疹的病例;②确诊病例:监测病例病原学标本检测结果为麻疹病毒核酸阳性或分离到麻疹病毒。
3.流行病学调查:按《全国麻疹监测方案》要求,报告单位所在地的县级CDC负责组织开展监测病例的流行病学个案调查,通过对其密切接触者进行监测等途径查找病例,了解传播情况。
4.样品采集和检测:病例所在地的医疗单位负责对就诊的监测病例采集病原学标本,市级CDC负责病毒核酸检测,核酸检测阳性标本再送省级CDC进行病毒分离培养、荧光定量RT-PCR鉴定及核苷酸序列测定和分析。
5.咽拭子标本的实验室检测:咽拭子标本进行荧光定量PCR鉴定:使用QIAamp Viral RNA Mini Kit试剂盒(上海生物技术有限公司)提取咽拭子标本悬液中的病毒核酸,使用麻疹风疹荧光定量PCR试剂盒(江苏硕世生物科技有限公司)进行荧光定量RT-PCR检测,依据试剂盒说明书进行结果判定,阳性结果判定为麻疹确诊病例。将麻疹病毒核酸阳性的咽拭子标本接种至Vero/SLAM细胞(由中国CDC国家麻疹实验室提供)进行麻疹病毒的分离培养,盲传三代观察细胞病变发生情况。阳性标本进行核苷酸序列扩增及测定,所用引物,扩增参数,反应体系等条件见文献[4]。
6.生物信息学分析:将标本序列与WHO麻疹病毒各基因型参考株序列[5]基于编码N基因羧基末端的450个核苷酸构建基因亲缘性关系树,序列整理使用Sequencher 4.0.5软件;多序列比对、氨基酸和核苷酸同源性分析使用BioEdi 7.0软件分析;基因亲缘性关系树使用Mega 6.0软件中的邻接法构建,建树的可靠性通过1 000 bootstrap来评估。基因型参考序列信息从GenBank获得。
结果1.基本情况:共报告病例36例,均为实验室确诊病例,无死亡病例报告。首发病例为2013年出生的学龄前儿童,女性,邯郸市成安县人。2019年11月14日出现发热、咳嗽,临床诊断为“发热待查”入院观察治疗,11月17日出疹后采集病原学标本,11月20日经实验室检测,确诊为麻疹后隔离治疗。患者发热前7~21 d无外出史,无医疗机构就诊史,与发热出疹性患者无明确接触史,未进行麻疹疫苗免疫。
2.流行特征:
(1)时间和地区分布:流行时间为2019年11月及2020年1月9日至2月18日共报告36例病例。本次疫情共波及邯郸市8个县(区),21例病例来自成安县(58.33%,21/36),邯山区7例、丛台区3例、涉县1例、鸡泽县1例、广平县1例、肥乡区1例、永年区1例。
(2)人群、职业分布和医疗机构就诊情况:≤2岁病例20例(55.55%,20/36),< 8月龄病例5例,8月龄至2岁病例15例,≥30岁病例2例,其余14例年龄范围2~12岁。人群分布以散居、托幼儿童和学生为主(94.44%,34/36)。有2例≥30岁病例分别为工人和农民。有27例在发病前7~21 d有医疗机构就诊史,4例为密切接触传播,5例无就诊史。
(3)含麻疹成分疫苗(MCV)免疫史:不详2例,均为≥30岁。明确MCV免疫史有3例,其中2例最后1剂次接种与发病时间间隔分别为 > 2年和 > 7年,另有1例最后一剂次接种与发病时间间隔8 d;无MCV免疫史病例31例(86.11%,31/36)。儿童病例中,无MCV免疫史占91.18%(31/34)。
(4)临床症状:均出现发热和出疹症状,均无淋巴结肿大和关节疼痛,发热与出疹时间间隔为0~6 d,平均发热2 d后出现出疹症状,伴有咳嗽和柯氏斑症状35例,伴有呼吸道卡他症状和结膜炎30例,并发肺炎的15例均为儿童(44.12%,15/34)。
3.实验室检测情况:
(1)病原学检测结果:36份病例咽拭子标本经荧光定量PCR检测,麻疹病毒核酸均为阳性,经细胞分离培养,分离出麻疹毒株12株。
(2)麻疹病毒基因型确定:对12份麻疹毒株核酸及24份咽拭子标本的麻疹病毒核酸进行序列测定并绘制基因亲缘性关系树,结果显示,36份标本的基因型在亲缘性关系树上与WHO D8基因型参考株(MVi/Manchester.GBR/30.94/D8)同在一个分支,可信度为99%,麻疹病毒属于D8基因型(图 1)。对首发病例D8基因型麻疹病毒与国内外的同期流行及周边省份既往流行的D8基因型麻疹病毒株构建核苷酸亲缘性关系树分析发现,监测到的首例标本的基因型与同期流行于泰国、越南、柬埔寨和中国香港地区D8基因型同在一个分支,与我国山东省和辽宁省2018年D8基因型流行株、北京市2019年D8基因型流行株相距较远(图 2)。
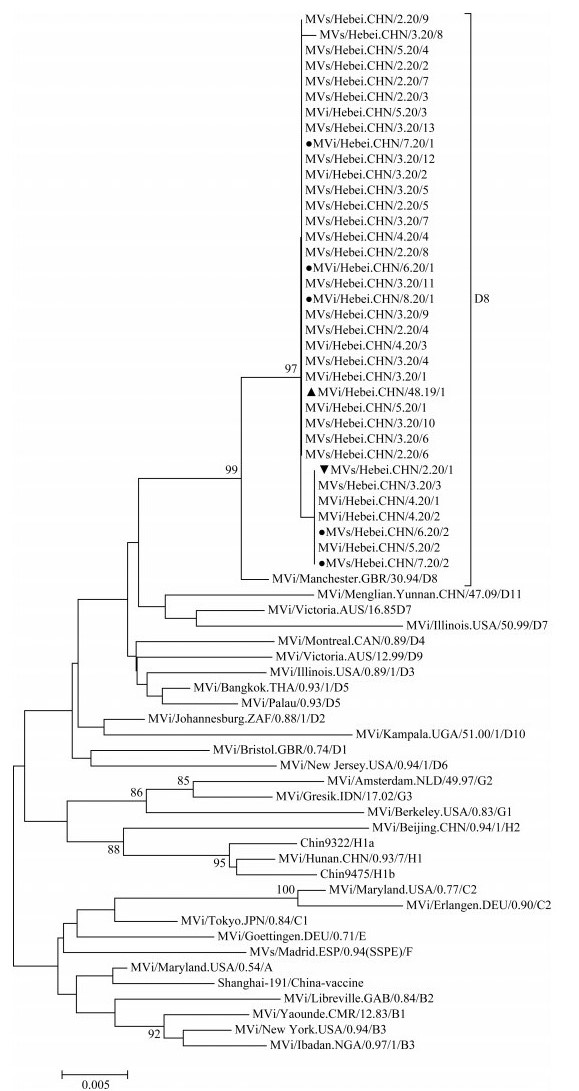
|
| 注:▲2019年麻疹D8基因型首发病例;▼2020年麻疹D8基因型首例病例;●2020年邯山区麻疹D8基因型病例 图 1 河北省D8基因型麻疹病毒株与WHO参考株构建的核苷酸亲缘性关系树 |
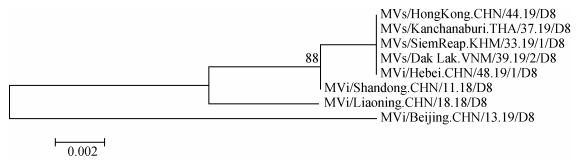
|
| 图 2 河北省D8基因型麻疹病毒株与国内外同期流行及周边省份既往流行的D8基因型麻疹病毒株构建核苷酸亲缘性关系树 |
(3)核苷酸序列和氨基酸同源性分析:将36株麻疹病毒序列与WHO D8基因型参考株序列进行N基因羧基端450个核苷酸和150个氨基酸序列同源性分析,结果显示,其核苷酸序列同源性为98.4%~98.6%,氨基酸序列同源性为97.3%;与我国本土H1基因型参考株核苷酸和氨基酸同源性分别为92.8%~93.1%和93.3%;36株麻疹病毒序列之间的核苷酸序列和氨基酸序列同源性分别为99.7%~100.0%和100.0%。首例病例麻疹病毒序列与2019年流行于泰国、越南、柬埔寨和中国香港地区麻疹毒株核苷酸和氨基酸同源性均为100.0%,与我国山东省、辽宁省和北京市监测到的麻疹毒株核苷酸同源性分别为99.7%、98.8%和97.1%,氨基酸同源性分别为99.3%、97.3%和97.3%。
讨论麻疹病毒属于副黏病毒科麻疹病毒属RNA病毒。麻疹病毒分子流行病学研究靶点是N基因COOH端负责编码150个氨基酸的450个核苷酸序列,也是麻疹病毒基因变异最大的区域,WHO基于该段区域核苷酸片段的同源性,将麻疹病毒分为8个组24个基因型[6-7],H1基因型被认为是我国本土基因型[8]。自进行麻疹病毒分离培养以来,通过河北省12个城市连续26年的监测显示,流行于河北省的麻疹基因型均为H1基因型。本次疫情为河北省监测到的由输入性麻疹病毒引发的感染疫情。
通过基因亲缘性关系树分析及核苷酸和氨基酸变异分析得知,河北省鉴定的D8基因型序列与WHO D8基因型参考株亲缘性较近,而与我国本土H1基因型参考株核苷酸和氨基酸差异均 > 6.7%,因此,此次疫情为D8基因型野毒株感染所致。
麻疹病毒在不同的国家或地区有不同的基因型分布,据文献报道,D8基因型主要流行于东南亚等地区,其他国家和地区曾有报道输入性D8基因型麻疹疫情[9-12]。2012年上海市监测到D8基因型的散发病例[13],与河北省毗邻的北京市、山东省和辽宁省陆续出现了D8基因型麻疹病毒感染疫情[14-16],这对河北省麻疹防控工作是很大挑战。本研究发现,首发病例无MCV免疫史,发病前无外出史和就诊史,与发热出疹病例无明确接触史,感染来源不明,通过基因亲缘性分析发现,其基因序列与同时期流行于东南亚以及中国香港地区的麻疹毒株核苷酸和氨基酸同源性均为100.0%,基因序列完全一致,但与河北省毗邻地区既往流行的D8基因型麻疹序列存在差异,结合当地前往东南亚打工人员较为密集的情况,初步判定,此次疫情为东南亚输入河北省D8基因型麻疹疫情。
河北省输入性麻疹疫情发生地点主要集中在邯郸市的8个县(区),以成安县发病人数最多,2019年监测的首发病例现住址亦为成安县,推测本次疫情由成安县始发,逐渐波及邻近的县(区)。通过对麻疹专病监测报告系统的监测数据进行排查发现,2019年河北省监测到的首例病例发病时间与2020年麻疹流行的发生相隔50 d,超出麻疹最长潜伏期,期间未监测到二代病例,但不能排除有漏报的可能,因此,导致2020年发生麻疹流行的原因,也有可能是2019年首例病例造成的输入性D8基因型在河北省本土循环所致。
典型的麻疹患者前驱期症状为发热、咳嗽、流涕和结膜炎,前驱期可见柯氏斑,随后特征性的红斑疹和斑丘疹会首先出现在面部和耳后,逐渐蔓延至躯干和四肢[17]。麻疹患者中约有10%~40%会出现并发症,以呼吸道并发症如肺炎最为常见[18]。孙丙虎等[19]对3 431例麻疹患病儿童的临床特征分析,指出儿童患麻疹后的并发症以肺炎为主,本次D8基因型麻疹疫情以发热和出疹症状为主要临床表现,绝大多数病例伴有咳嗽、柯氏斑、呼吸道卡他症状和结膜炎,患病儿童中有44.12%并发肺炎,由于肺炎的发生多为继发病毒或细菌感染所致,或者由于麻疹病毒本身引起,容易引起营养不良儿童病情恶化。
本次疫情以儿童为主,其原因:①秋冬季节呼吸道疾病高发,儿科人员聚集,在就诊过程中未得到MCV保护的患病儿童,一旦与麻疹患者存在接触,易发生感染。儿童病例中,无MCV免疫史者占儿童病例数的91.18%,说明免疫空白的存在是儿童发生麻疹感染的主要原因,这和Hao等[20]的研究结果一致。②部分基层的医疗机构对麻疹的警惕性不高,对麻疹疑似病例未做好预检分诊和有效防护,易发生交叉感染,导致疫情进一步蔓延[21-22]。疫情发生后,邯郸市及时开展0~6岁人群查漏补种工作,最大限度地消除儿童免疫空白人群,通过加强疑似病例监测、落实预检分诊、隔离疑似病例、治疗确诊病例等措施,及时控制了疫情。其余县(区)未监测到D8基因型感染病例,但是,还需要实验室证据证实,是否已经阻断了输入性D8基因型麻疹病毒在河北省的传播和扩散。
本研究存在不足。输入性疫情发生后虽然对首例病例进行流行病学调查,但调查信息不完善导致传播链条不明晰,无法明确其感染来源和追踪溯源,只能通过有限的调查信息结合分子流行病学结果进行判断和分析。
综上所述,D8基因型麻疹病毒输入性疫情已造成河北省内的本土传播,需要进一步加强麻疹病毒的分子流行病学监测,及早发现和处置疫情,提高适龄儿童麻疹类疫苗的覆盖率和及时接种率,避免院内交叉感染。
利益冲突 所有作者均声明不存在利益冲突
志谢 感谢中国CDC张燕、王慧玲,山东省CDC王常银,北京市CDC陈萌,辽宁省CDC王艳提供部分基因序列
| [1] |
杜慧, 郭玉, 张振国, 等. 2007-2009年河北省麻疹实验室监测分析[J]. 预防医学情报杂志, 2011, 27(6): 432-434. Du H, Guo Y, Zhang ZG, et al. Laboratory surveillance of measles in Hebei Province, 2007-2009[J]. J Prev Med Inf, 2011, 27(6): 432-434. |
| [2] |
杜慧, 刘岩, 王晶辉, 等. 2010-2013年河北省麻疹疑似病例病原学检测结果分析[J]. 预防医学情报杂志, 2015, 31(11): 854-858. Du H, Liu Y, Wang JH, et al. Etiology characteristics of suspected measles cases in Hebei, 2010-2013[J]. J Prev Med Inf, 2015, 31(11): 854-858. |
| [3] |
中国疾病预防控制中心. 全国麻疹监测方案[J]. 中国疫苗和免疫, 2014, 20(4): 364-375. Chinese Center for Disease Control and Prevention. National measels surveillance guideline[J]. Chin J Vacc Immun, 2014, 20(4): 364-375. |
| [4] |
Bankamp B, Byrd-Leotis LA, Lopareva EN, et al. Improving molecular tools for global surveillance of measles virus[J]. J Clin Virol, 2013, 58(1): 176-182. DOI:10.1016/j.jcv.2013.05.018 |
| [5] |
World Health Organization. Update of the nomenclature for describing the genetic characteristics of wild-type measles viruses:new genotypes and reference strains[J]. Wkly Epidemiol Rec, 2003, 78(27): 229-232. |
| [6] |
World Health Organization. Measles virus nomenclature update:2012[J]. Wkly Epidemiol Rec, 2012, 87(9): 73-81. |
| [7] |
World Health Organization. Genetic diversity of wild-type measles viruses and the global measles nucleotide surveillance database (MeaNS)[J]. Wkly Epidemiol Rec, 2015, 90(30): 373-380. |
| [8] |
Zhang Y, Xu ST, Wang HL, et al. Single endemic genotype of measles virus continuously circulating in China for at least 16 years[J]. PLoS One, 2012, 7(4): e34401. DOI:10.1371/journal.pone.0034401 |
| [9] |
Mulders MN, Truong AT, Muller CP. Monitoring of measles elimination using molecular epidemiology[J]. Vaccine, 2001, 19(17/19): 2245-2249. DOI:10.1016/S0264-410X(00)00453-9 |
| [10] |
Rota PA, Brown K, Mankertz A, et al. Global distribution of measles genotypes and measles molecular epidemiology[J]. J Infect Dis, 2011, 204(Suppl 1): S514-523. DOI:10.1093/infdis/jir118 |
| [11] |
Roggendorf H, Santibanez S, Mankertz A, et al. Two consecutive measles outbreaks with genotypes D8 and D4 in two mainly unvaccinated communities in Germany[J]. Med Microbiol Immuno, 2012, 201(3): 349-355. DOI:10.1007/s00430-012-0240-7 |
| [12] |
Kalaycioglu AT, Yolbakan S, Guldemir D, et al. Towards measles elimination:phylogenetic analysis of measles viruses in turkey (2012-2013) and identification of genotype D8[J]. J Med Virol, 2016, 88(11): 1867-1873. DOI:10.1002/jmv.24548 |
| [13] |
李淑华, 汤显, 钱晓华, 等. 2012年上海市虹口区麻疹流行株基因特征分析[J]. 中华流行病学杂志, 2014, 35(4): 429-432. Li SH, Tang X, Qian XH, et al. Genetic characterization of the isolates of measles viruses in Hongkou district of Shanghai, China in 2012[J]. Chin J Epidemiol, 2014, 35(4): 429-432. DOI:10.3760/cma.j.issn.0254-6450.2014.04.019 |
| [14] |
李娟, 卢莉, 马蕊, 等. 北京市2013年新发现D8基因型麻疹病例的流行病学调查[J]. 中华流行病学杂志, 2013, 34(11): 1111-1114. Li J, Lu L, Ma R, et al. Investigation on measles cases of new genotype D8 in Beijing, 2013[J]. Chin J Epidemiol, 2013, 34(11): 1111-1114. DOI:10.3760/cma.j.issn.0254-6450.2013.011.015 |
| [15] |
刘晓东, 杨峰, 房学强, 等. 山东省首例输入性D8基因型麻疹病例的流行病学调查[J]. 中国疫苗和免疫, 2019, 25(1): 21-23. Liu XD, Yang F, Fang XQ, et al. Epidemiological investigation of the first imported D8 genotype measles case in Shandong province[J]. Chin J Vacc Immun, 2019, 25(1): 21-23. |
| [16] |
王艳, 郝爽, 王文思, 等. 辽宁省首例D8基因型麻疹病毒的分离与鉴定[J]. 中华实验和临床病毒学杂志, 2018, 32(5): 484-487. Wang Y, Hao S, Wang WS, et al. Isolation and identification of the first D8 genotype measles virus in Liaoning province[J]. Chin J Exp Chin Virol, 2018, 32(5): 484-487. DOI:10.3760/cma.j.issn.1003-9279.2018.05.007 |
| [17] |
世界卫生组织. 疫苗接种的免疫学基础——麻疹、风疹、流行性腮腺炎[M]. 北京: 人民卫生出版社, 2013: 3-4. World Health Organization. The immunological basis for immunization series-Measles, Rubella and Mumps[M]. Beijing: People's Medical Publishing House, 2013: 3-4. |
| [18] |
Perry RT, Halsey NA. The clinical significance of measles:a review[J]. J Infect Dis, 2004, 189: S4-16. DOI:10.1086/377712 |
| [19] |
孙丙虎, 王晓康, 胡志亮, 等. 3431例麻疹患儿流行病学和临床特征分析[J]. 临床儿科杂志, 2017, 35(8): 589-591. Sun BH, Wang XK, Hu ZL, et al. Analysis on epidemiology and clinical characteristics of 3431 pediatric patients with measles[J]. J Clin Pediatr, 2017, 35(8): 589-591. DOI:10.3969/j.issn.1000-3606.2017.08.007 |
| [20] |
Hao LX, Ma C, Wannemuehler KA, et al. Risk factors for measles in children aged 8 months-14 years in China after nationwide measles campaign:A multi-site case-control study, 2012-2013[J]. Vaccine, 2016, 34(51): 6545-6552. DOI:10.1016/j.vaccine.2016.02.005 |
| [21] |
徐晶影, 周剑惠, 田鑫, 等. 吉林省2015年某医院一起麻疹暴发传播链调查[J]. 中国疫苗和免疫, 2016, 22(5): 515-518. Xu JY, Zhou JH, Tian X, et al. Investigation of a measles outbreak in a hospital in Jilin province, 2015[J]. Chin J Vacc Immun, 2016, 22(5): 515-518. |
| [22] |
严睿, 何奔, 姚凤燕, 等. 浙江省平湖市2017年由D8基因型麻疹病毒引起的暴发调查[J]. 中华流行病学杂志, 2018, 39(3): 333-336. Yan R, He B, Yao FY, et al. Investigation of a measles outbreak caused by genotype D8 virus in Pinghu city of Zhejiang province, 2017[J]. Chin J Epidemiol, 2018, 39(3): 333-336. DOI:10.3760/cma.j.issn.0254-6450.2018.03.016 |
 2021, Vol. 42
2021, Vol. 42


