文章信息
- 沈理通, 段振华, 陈泽辉, 杨天赐, 林涛, 张荣秋, 蒋丽娜, 曾小红, 温慧欣, 詹钦勇, 苏迎盈, 张雅丽, 彭质斌, 郑建东, 郑蓉蓉, 秦颖, 袁权, 陈长荣.
- Shen Litong, Duan Zhenhua, Chen Zehui, Yang Tianci, Lin Tao, Zhang Rongqiu, Jiang Lina, Zeng Xiaohong, Wen Huixin, Zhan Qinyong, Su Yingying, Zhang Yali, Peng Zhibin, Zheng Jiandong, Zheng Rongrong, Qin Ying, Yuan Quan, Chen Changrong
- 厦门市实施“14+7隔离”与“核酸+总抗体筛查”策略对发现境外输入性新型冠状病毒感染者的作用分析
- Effectiveness of the "14 plus 7 day quarantine" and "nucleic acid plus total antibody testing" strategy for screening imported patients with COVID-19 in Xiamen
- 中华流行病学杂志, 2021, 42(6): 1002-1007
- Chinese Journal of Epidemiology, 2021, 42(6): 1002-1007
- http://dx.doi.org/10.3760/cma.j.cn112338-20210128-00076
-
文章历史
收稿日期: 2021-01-28
2. 成都市疾病预防控制中心新发突发传染病防治工作站 610041;
3. 厦门市疾病预防控制中心检验科 361021;
4. 厦门大学附属中山医院临床检验中心 361004;
5. 厦门市卫生健康委员会 361003;
6. 厦门市疾病预防控制中心 361021;
7. 厦门大学公共卫生学院, 国家传染病诊断试剂与疫苗工程技术研究中心 361102;
8. 中国疾病预防控制中心传染病监测预警重点实验室, 传染病管理处, 北京 102206
2. Chengdu Workstation for Emerging Infectious Disease Control and Prevention, Chengdu Center for Disease Control and Prevention, Chengdu 610041, China;
3. Laboratory, Xiamen Center for Disease Control and Prevention, Xiamen 361021, China;
4. Clinical Laboratory Center, Zhongshan Hospital Affiliated to Xiamen University, Xiamen 361004, China;
5. Xiamen Municipal Health Commission, Xiamen 361003, China;
6. Xiamen Center for Disease Control and Prevention, Xiamen 361021, China;
7. National Institute of Diagnostics and Vaccine Development in Infectious Disease, Xiamen University, Xiamen 361102, China;
8. Division of Infectious Disease, Key Laboratory of Infectious Disease Surveillance and Early-warning, Chinese Center for Disease Control and Prevention, Beijing 102206, China
2019年12月新型冠状病毒(新冠病毒)感染疫情发生以来,已成为近百年来人类遭遇的全球影响范围最广的传染病[1]。2020年3月起我国本土疫情基本清零,但境外疫情持续快速增长,我国进入境外输入相关疫情为主的防控阶段。目前各地对入境人员采取隔离14 d及核酸筛查的防控措施为主。近期北京市、沈阳市分别报告了入境人员14 d集中隔离期核酸阴性但解除隔离后导致社区传播的案例[2-4]。考虑到新冠病毒感染者具有间歇排毒、首次核酸阳性(潜隐期)或潜伏期时间较长、采样部位影响检测结果等特点,单次、单标本的核酸筛查容易漏检,国内外均有报道新冠病毒感染者血清抗体检测与核酸检测相结合具有较好互补性[5-7]。2020年3月17日厦门市重新开通入境客运航班,4月21日开始对入境人员采取14 d集中隔离与7 d集中或居家隔离(“14+7”隔离)以及多次核酸和血清总抗体筛查(“核酸+总抗体筛查”)的(联合筛查策略),已筛查出多例核酸阳性的入境人员。本研究分析厦门市实施联合筛查策略对发现境外输入性新型冠状病毒感染者的作用,为优化调整境外输入疫情防控策略提供参考依据。
对象与方法1.研究对象:2020年3月17日至12月31日厦门市入境人员、7月18日至12月31日外地隔离不足21 d的入境人员。相关资料来自入境人员健康登记卡。
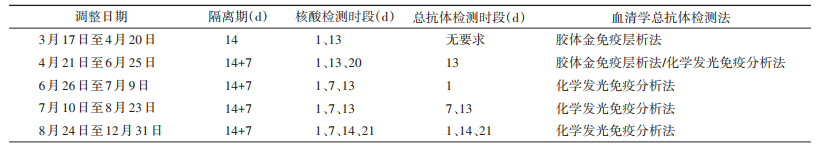
2.联合筛查策略及调整情况:4月20日以前实施的是入境人员隔离第1天、第13天核酸检测,但未要求抗体检测,4月21日起实施联合筛查策略,调整情况见表 1。
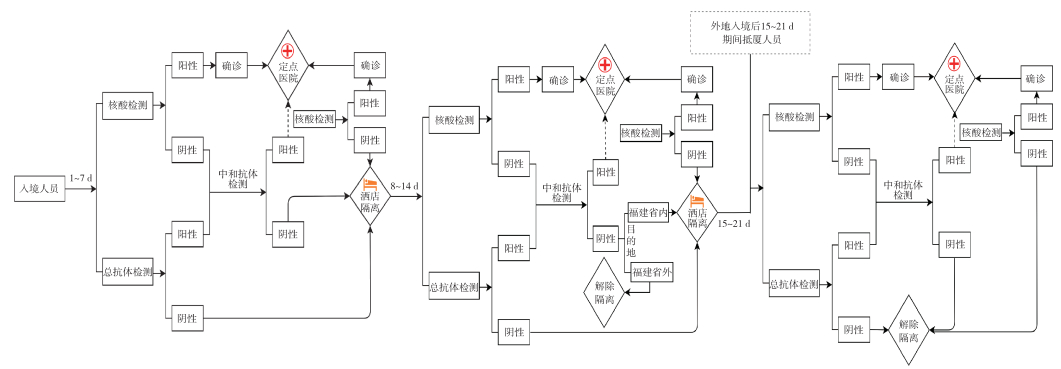
3.总抗体阳性后处置流程:总抗体检测阳性标本,增加核酸检测频次、增加采样部位或转送定点医院排查。第1天检测结果为核酸阴性、总抗体阳性,进行中和抗体检测;第14天检测结果为核酸阴性、总抗体阳性,进行中和抗体检测;第21天进行常规核酸和总抗体检测,均为阴性者则解除隔离,总抗体阳性,则转送定点医院排查。见图 1。
|
| 图 1 厦门市实施“14+7隔离”与“核酸+总抗体筛查”策略发现境外输入性新型冠状病毒感染者处置流程 |
4.核酸检测和抗体检测法:核酸检测采用上海之江生物科技股份有限公司、中山大学达安基因股份有限公司的新冠病毒ORF1ab、E和N基因检测试剂盒(荧光定量PCR法)。总抗体检测采用厦门万泰凯瑞生物技术有限公司的新冠病毒抗体检测试剂盒;IgM和IgG抗体检测采用郑州安图生物工程有限公司生产的新冠病毒IgM/IgG抗体检测试剂盒。中和抗体检测采用基于水疱性口炎病毒/慢病毒的新冠假病毒中和检测法[8-9]。总抗体阳性者均进行中和抗体、IgG/IgM抗体检测,用于比较不同“核酸+总抗体筛查”方法差异。
5.相关定义:
(1)隔离 > 14 d发现的新冠病毒感染者[10]:入境14 d集中隔离期内,在第1、13、14天采样至少2次核酸检测结果均为阴性,但第15天及以后为阳性。
(2)真阳性与真阴性结果判断:①真阳性:核酸阳性且抗体阳性,核酸阴性但抗体阳性则为假阳性;②真阴性:核酸阴性且抗体阴性,核酸阳性但抗体阴性则为假阴性。
(3)荧光到达预先设定阈值的循环数(Ct值):用于新冠病毒核酸检测(荧光定量PCR法)结果判读,荧光定量PCR仪检测出Ct值与病毒核酸浓度有关,病毒核酸浓度越高,Ct值越小。①阳性:Ct值< 37;②阴性:无Ct值或Ct≥40;③灰度区:Ct值37~40,重复检测Ct值< 40,扩增曲线有明显起峰,判断为阳性,否则为阴性。
(4)新冠病毒核酸检测阳性:2个靶标(ORF1ab和N基因)检测,同一份标本需满足双靶标阳性,或重复检测为单靶标阳性,或2种标本同时满足单靶标阳性。
6.统计学分析:采用Excel 2019软件整理数据,采样SAS 9.4软件进行数据分析。以最终核酸检测结果为金标准,进行抗体灵敏度、特异度、阳性预测值及阴性预测值的计算。
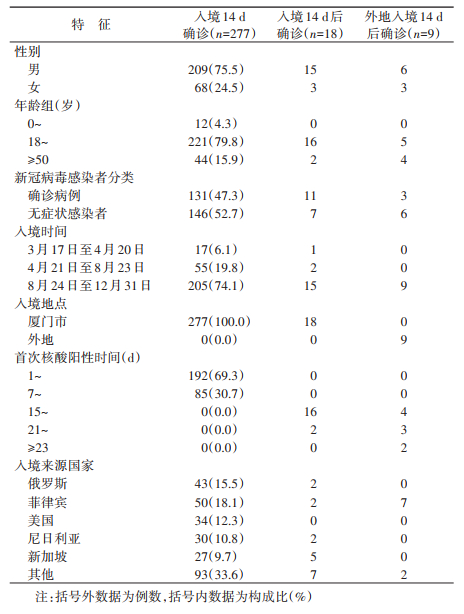
结果1.输入性感染者基本情况:在174 628名入境人员和943名外地入境人员中,共发现304例境外输入性新冠病毒感染者,其中确诊病例145例(47.7%)、无症状感染者159例(52.3%)。277例(91.1%)在14 d内首次核酸阳性,27例(8.9%)在入境14 d后首次核酸阳性,其中18例为厦门市入境,9例为外地入境(表 2)。
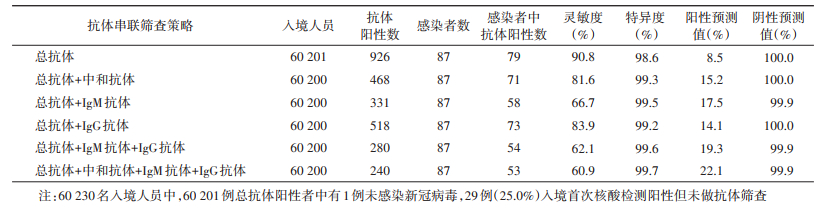
2.联合筛查策略实施作用分析:304例境外输入性新冠病毒感染者中,其中163例(53.6%)为总抗体阳性后经多次及多部位核酸检测确诊,22例(7.2%)为同时发现总抗体阳性与核酸阳性,81例(26.6%)入境后首次核酸检测阳性;20例(6.6%)入境“14 d隔离”核酸检测阳性前为总抗体阴性;其余18例(5.9%)为4月份以前入境未做总抗体检测。27例(8.9%)入境14 d后首次核酸阳性,136例入境“14 d隔离”首次核酸检测阳性,仅8例在总抗体阳性后的首次核酸检测阳性,128例在平均2.3次(最高6次)核酸检测阴性后转为核酸阳性(表 3)。如果未做总抗体检测,第14天做1次常规核酸检测仅能检出8例,仍有128例(42.0%)无法在入境“14 d隔离”被检出。据此估算,联合筛查策略比“14 d隔离+核酸筛查”策略可以多检出155例,占境外输入性新冠病毒感染者的51.0%,即联合筛查策略提高检出率约1倍。
10月1日至12月31日60 230名入境人员中,确诊病例116例(包括无症状感染者32例),新冠病毒感染率为0.19%。其中29例(25.0%)入境首次核酸检测阳性但未做抗体筛查,7例(6.0%)同时发现总抗体阳性与核酸阳性,72例(62.1%)为总抗体阳性经多次检测后为核酸阳性,其余8例(6.9%)在“14 d隔离”为总抗体阴性后检测核酸阳性。
以总抗体筛查作为唯一抗体筛查指标的灵敏度最高(90.8%),阳性预测值为8.5%;串联中和抗体、IgM/IgG抗体筛查的灵敏度分别下降至81.6%、66.7%和83.9%,而筛查假阳性率降低约50.0%,抗体阳性预测值提高至15.2%(表 4)。
3.入境14 d后确诊新冠病毒感染者的核酸和抗体检测情况:以厦门市为第一入境点入境“14 d隔离”后总抗体阳性后首次核酸检测确诊的18例感染者中,新冠病毒ORF1ab和N基因Ct值均 > 33的占88.9%(16/18)。核酸检测次数为4~8次(平均6次),有7例在14 d内核酸检测出现单靶标阳性,但未满足确诊标准。有14例是在入境3 d内首次总抗体检测阳性,其余4例为入境第6、7、13、13天。入境“14 d隔离”内的总抗体阳性率为100.0%(18/18),而IgM/IgG抗体均存在漏检,其中IgM、IgG抗体单阳性率分别为50.0%(9/18)、66.7%(12/18),IgM/IgG抗体双阳性率为50.0%(9/18),IgM/IgG抗体双阴性率为33.3%(6/18)。
4.引起续发病例的情况:截至2021年2月26日,厦门市尚未发现入境人员与解除隔离后引起的社区续发感染。
讨论我国境外输入疫情的防控压力持续增大,提高入境“14 d隔离”的拦截率对防控至关重要[11-14]。厦门市4月21日起对入境人员实施联合筛查策略,共发现304例境外输入性新冠病毒感染者,入境14 d隔离期内首次核酸阳性占91.1%,在入境14 d后首次核酸阳性占8.9%,提示常规14 d隔离容易出现漏检,采取“14+7”隔离筛查策略可提高拦截率。
新冠病毒感染者在感染2~3周后,血清抗体阳转率约为100.0%,并可持续超过6个月,是核酸检测的良好补充[5-6, 15-16]。在隔离期间,核酸检测和抗体检测相结合,并对抗体阳性者进行多时点、多部位采样检测,结合临床表现和肺部影像检查判断,可提高境外输入性新冠病毒感染者的拦截率。相关研究发现,新冠病毒感染者血清总抗体阳转平均时间比IgM/IgG抗体更早,感染早期的阳性率明显高于IgM/IgG抗体,是初筛的合适指标[5-6, 17-18]。本研究发现,在入境人员14 d隔离期后,总抗体阳性经多次检测后为核酸阳性者占62.1%,常规核酸检测阳性者仅占37.9%;入境“14 d隔离”后总抗体阳性后首次核酸检测阳性者,核酸检测次数为4~8次(平均6次)。目前厦门市入境人员新型冠状病毒感染率极低,提高特异度并提高阳性预测值,可减少筛查工作量,探索合适的总抗体阳性后中和抗体/IgG/IgM抗体串联检测策略,很有必要。本研究发现,入境14 d隔离期内总抗体阳性者IgM/IgG抗体双阴性率为33.3%,虽然该串联策略的抗体阳性预测值由8.5%提高至15.2%,但灵敏度损失较大,对提高拦截率的防控工作得不偿失。
本研究结果显示,无症状感染者占境外输入性新冠病毒感染者的52.3%,核酸检测的Ct值> 33的占88.9%。有研究发现,随着Ct值变大,新冠病毒传染性随之减弱,当Ct值> 33时,病毒培养无法检出活病毒[19-20]。提示入境人员“14 d隔离”后的确诊病例及无症状感染者总体传染性较低。但在冬春季节,尤其是较为寒冷的北方地区,适宜新冠病毒生存,加上人群室内聚集活动机会增多,传播风险明显提高[21]。2020年秋冬季节,我国北方地区已发生多起入境人员解除隔离后的聚集性疫情,2020年12月北京市顺义区发生一起单一传播链导致的聚集性疫情,传染源是1例入境14 d隔离期后的无症状感染者,入境30 d时核酸阴性但IgM抗体阳性,31 d时核酸检测首次阳性[3]。本研究发现,联合筛查策略比“14 d隔离+核酸筛查”策略可能多检出155例,占入境感染者总数的51.0%,即联合筛查策略提高感染者检出率约1倍,具有较好的成本效益。
本研究存在不足。未经过筛查策略对比研究的严谨设计,无法进行更深入地资料分析。
综上所述,厦门市对入境人员实施联合筛查策略,可有效筛查入境14 d后转为核酸阳性的新冠病毒感染者,与“14 d隔离+核酸筛查”策略相比,有效提高检出率,降低境外输入引起续发传播的风险。根据我国“外防输入、内防反弹”疫情防控形势,在高风险季节对入境人员实施联合筛查策略,可有效减少漏检和降低输入风险。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
中国政府网.抗击新冠肺炎疫情的中国行动[EB/OL]. (2020-06-07)[2021-01-01]. http://www.gov.cn/zhengce/2020-06/07/content_5517737.htm. www.gov.cn. China's Action against the COVID-19 Outbreak[EB/OL]. (2020-06-07)[2021-01-01]. http://www.gov.cn/zhengce/2020-06/07/content_5517737.htm. |
| [2] |
搜狐网.顺义区局部聚集性疫情为单一传播链!源头初步锁定![EB/OL]. (2020-12-30)[2021-01-01]. https://www.sohu.com/a/441489587_100081921. Sohu.com. Shunyi District local aggregated outbreak as a single transmission chain! The source is initially locked![EB/OL]. (2020-12-30)[2021-01-01]. https://www.sohu.com/a/441489587_100081921. |
| [3] |
搜狐网.北京市新冠肺炎疫情防控工作第209场新闻发布会[EB/OL]. (2021-01-13)[2021-01-20]. https://www.sohu.com/a/444329769_120209831. Sohu.com. The 209th press conference on COVID-19 prevention and control in Beijing[EB/OL]. (2021-01-13)[2021-01-20]. https://www.sohu.com/a/444329769_120209831. |
| [4] |
搜狐网.沈阳、大连疫情源头查明![EB/OL]. (2021-01-13)[2021-01-20]. https://www.sohu.com/a/444211034_120711264. Sohu.com. The source of the epidemic was identified in Shenyang and Dalian[EB/OL]. (2021-01-13)[2021-01-20]. https://www.sohu.com/a/444211034_120711264. |
| [5] |
Zhao JJ, Yuan Q, Wang HY, et al. Antibody responses to SARS-CoV-2 in patients with novel coronavirus disease 2019[J]. Clin Infect Dis, 2020, 71(16): 2027-2034. DOI:10.1093/cid/ciaa344 |
| [6] |
Lou B, Li TD, Zheng SF, et al. Serology characteristics of SARS-CoV-2 infection after exposure and post-symptom onset[J]. Eur Respir J, 2020, 56(2): 2000763. DOI:10.1183/13993003.00763-2020 |
| [7] |
Deeks JJ, Dinnes J, Takwoingi Y, et al. Antibody tests for identification of current and past infection with SARS-CoV-2[J]. Cochrane Database Syst Rev, 2020, 6(6): CD013652. DOI:10.1002/14651858.Cd013652 |
| [8] |
Xiong HL, Wu YT, Cao JL, et al. Robust neutralization assay based on SARS-CoV-2 S-protein-bearing vesicular stomatitis virus (VSV) pseudovirus and ACE2-overexpressing BHK21 cells[J]. Emerg Microbes Infect, 2020, 9(1): 2105-2113. DOI:10.1080/22221751.2020.1815589 |
| [9] |
Chang L, Hou WH, Zhao L, et al. The prevalence of antibodies to SARS-CoV-2 among blood donors in China[J]. Nat Commun, 2021, 12(1): 1383. DOI:10.1038/s41467-021-21503-x |
| [10] |
国家卫生健康委员会办公厅, 国家中医药管理局办公室.新型冠状病毒肺炎诊疗方案(试行第八版)[EB/OL]. (2020-08-18)[2021-01-01].http://www.nhc.gov.cn/yzygj/s7653p/202008/0a7bdf12bd4b46e5bd28ca7f9a7f5e5a.shtml. General Office of the National Health Commission, Office of the State Administration of Traditional Chinese Medicine. Protocol of diagnosis and treatment for COVID-19(trial version 8)[EB/OL]. (2020-08-18)[2021-01-01]. http://www.nhc.gov.cn/yzygj/s7653p/202008/0a7bdf12bd4b46e5bd28ca7f9a7f5e5a.shtml. |
| [11] |
World Health Organization. WHO Coronavirus Disease (COVID-19) dashboard[EB/OL]. (2021-01-16)[2021-01-01]. https://covid19.who.int/.
|
| [12] |
沈思鹏, 魏永越, 赵杨, 等. 全球新型冠状病毒肺炎疫情对我国的输入风险评估[J]. 中华流行病学杂志, 2020, 41(10): 1582-1587. Shen SP, Wei YY, Zhao Y, et al. Risk assessment of global COVID-19 imported cases into China[J]. Chin J Epidemiol, 2020, 41(10): 1582-1587. DOI:10.3760/cma.j.cn112338-20200415-00577 |
| [13] |
方绮雯, 宫霄欢, 肖文佳, 等. 上海市新型冠状病毒肺炎早期境外输入病例流行特征及防控措施分析[J]. 中华流行病学杂志, 2020, 41(12): 2034-2039. Fang QW, Gong XH, Xiao WJ, et al. Epidemiological characteristics and measures of prevention and control of imported COVID-19 cases in early phase in Shanghai[J]. Chin J Epidemiol, 2020, 41(12): 2034-2039. DOI:10.3760/cma.j.cn112338-20200413-00566 |
| [14] |
甄若楠, 黄勇, 李意兰, 等. 广州市新型冠状病毒肺炎境外输入病例流行特征分析[J]. 中华流行病学杂志, 2020, 41(11): 1786-1790. Zhen RN, Huang Y, Li YL, et al. Epidemiological characteristics of imported COVID-19 cases in Guangzhou[J]. Chin J Epidemiol, 2020, 41(11): 1786-1790. DOI:10.3760/cma.j.cn112338-20200413-00569 |
| [15] |
Gaebler C, Wang ZJ, Lorenzi JCC, et al. Evolution of antibody immunity to SARS-CoV-2[J]. Nature, 2021, 591(7851): 639-644. DOI:10.1038/s41586-021-03207-w |
| [16] |
黄悦, 庄春兰, 葛胜祥, 等. 2019新型冠状病毒感染血清学检测的临床和公共卫生意义探讨[J]. 病毒学报, 2020, 36(3): 537-540. Huang Y, Zhuang CL, Ge SX, et al. The values of serological test for SARS-CoV-2 infection in clinical and public health practices[J]. Chin J Virol, 2020, 36(3): 537-540. DOI:10.13242/j.cnki.bingduxuebao.003678 |
| [17] |
Gudbjartsson DF, Norddahl GL, Melsted P, et al. Humoral immune response to SARS-CoV-2 in iceland[J]. N Engl J Med, 2020, 383(18): 1724-1734. DOI:10.1056/NEJMoa2026116 |
| [18] |
GeurtsvanKessel CH, Okba NMA, Igloi Z, et al. An evaluation of COVID-19 serological assays informs future diagnostics and exposure assessment[J]. Nat Commun, 2020, 11(1): 3436. DOI:10.1038/s41467-020-17317-y |
| [19] |
Jefferson T, Spencer EA, Brassey J, et al. Viral cultures for COVID-19 infectious potential assessment-a systematic review[J]. Clin Infect Dis, 2020. DOI:10.1093/cid/ciaa1764.[Onlineaheadofprint |
| [20] |
La Scola B, Le Bideau M, Andreani J, et al. Viral RNA load as determined by cell culture as a management tool for discharge of SARS-CoV-2 patients from infectious disease wards[J]. Eur J Clin Microbiol Infect Dis, 2020, 39(6): 1059-1061. DOI:10.1007/s10096-020-03913-9 |
| [21] |
McClymont H, Hu WB. Weather variability and COVID-19 transmission:a review of recent research[J]. Int J Environ Res Public Health, 2021, 18(2): 396. DOI:10.3390/ijerph18020396 |
 2021, Vol. 42
2021, Vol. 42