文章信息
- 中华预防医学会, 中华预防医学会疫苗与免疫分会.
- Chinese Preventive Medicine Association, Vaccine and Immunology Branch of the Chinese Preventive Medicine Association
- 中国百日咳行动计划专家共识
- Expert consensus on the China Pertussis Initiative
- 中华流行病学杂志, 2021, 42(6): 955-965
- Chinese Journal of Epidemiology, 2021, 42(6): 955-965
- http://dx.doi.org/10.3760/cma.j.cn112338-20210308-00186
-
文章历史
收稿日期: 2021-03-08
百日咳是由百日咳鲍特菌引起的急性呼吸道传染病,常表现为反复剧烈咳嗽,可持续1~2个月甚至更长时间。百日咳曾是全球婴幼儿死亡的重要原因之一。目前,即便在百日咳白喉破伤风联合疫苗(百白破疫苗)接种率较高的国家,百日咳仍是一个备受关注的公共卫生问题[1]。特别是自20世纪80年代以来,在美国[2]、加拿大[3]、澳大利亚[4]等高疫苗覆盖率的国家,百日咳发病率在保持多年低水平后再次呈上升趋势,部分地区甚至出现暴发疫情,国际上称之为百日咳再现(pertussis resurgence)。对此,中国专家高度关注,在进入21世纪之后中国百日咳报告发病率尚处于较低水平时,中华预防医学会曾于2010年召开百日咳专题会议,并于2011年出台《百日咳免疫预防专家共识》[5]。此后,中国医疗卫生机构加强百日咳防治工作,部分省份积极开展监测工作,全国百日咳报告发病率呈现上升趋势[6]。2019年全国百日咳报告病例数超过3万例,与20世纪80年代末报告水平相当,报告病例以婴幼儿为主。近年来,中华预防医学会多次组织专家对百日咳流行趋势进行研讨,认为国内存在百日咳大范围流行或集中暴发以及婴幼儿因百日咳致死增多的潜在风险。面对这一新形势,中华预防医学会参考国外提出的“全球百日咳行动计划”(Global Pertussis Initiative,GPI)工作模式,于2017年发起“中国百日咳行动计划”(China Pertussis Initiative,CPI),组织相关专家研究形势,分析问题,提出对策,重点对近些年来百日咳研究的最新进展、流行趋势和免疫策略进行讨论和研究,形成本专家共识。
1、多种因素导致百日咳再现,中国也潜在百日咳再现的风险 1.1 国外发达国家百日咳再现由来已久从时间轴上可以清楚地看到国外发达国家百日咳发病及其免疫史的演变。随着早期百日咳疫苗从无到有,接种率从低到高,百日咳发病率很快大幅下降,并持续保持较长时间处于低发状态。这种情形与大多数国家免疫规划疫苗引入之后,疫苗针对疾病的发病得到快速控制的结果是一致的,也是疫苗作为预防传染病最特异、最有效措施的成效和意义所在。令人关注的是,在医疗卫生条件和预防接种可及性好的发达国家,百白破疫苗覆盖率一直保持在很高水平,但百日咳报告发病率保持多年低水平之后却又重新上升,甚至出现暴发疫情[7]。如美国自20世纪50年代开始使用百白破疫苗,随后百日咳年发病人数持续下降至4 000例以下,但80年代后发病人数开始上升,2012年报告发病48 277例[8]。近年来,澳大利亚、加拿大、英国、法国、荷兰、芬兰、意大利等疫苗接种率高的国家也纷纷出现百日咳再现的报道[2-4]。Domenech等[7]分析了63个国家的数据,发现32个国家的百日咳发病率在1980- 2012年均有增长。虽然各国采取了一些积极的应对措施,但截至目前,百日咳再现的问题在这些发达国家仍未得到有效解决[8-9]。
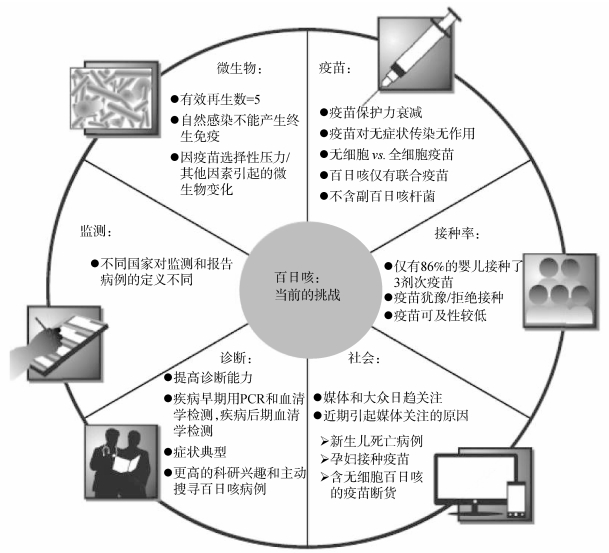
1.2 国际上认为百日咳再现具有复杂的影响因素百日咳再现的原因十分复杂,从传染病流行的三个环节(传染源、传播途径和易感人群)和两大因素(自然和社会因素)的角度来看,百日咳再现的影响因素既与一些客观因素密不可分,也与一些主观因素的变化直接相关。2015年8月,世界卫生组织(WHO)在百日咳立场文件中指出[1],百日咳再现的可能因素包括医务人员对百日咳的知晓度和关注度的提高、监测敏感度的提升、PCR等实验室检测技术的应用、部分地区疫苗接种率下降、疫苗保护效果不佳、疫苗接种后保护作用持续时间较短等。Domenech等[7]指出,各个国家百日咳的监测意识、监测标准、监测体系和监测方法等存在巨大差异,这也可能是导致各国数据有明显差异的原因。另有学者认为,百日咳再现还与菌株的变异、疫苗犹豫导致的疫苗覆盖率低、无细胞百日咳疫苗黏膜免疫弱等因素相关[10]。Martinón-Torres等[11]从六个方面(微生物、疫苗、监测、接种率、诊断和社会)分析了当前在百日咳防控中所面临的主要挑战(图 1)。
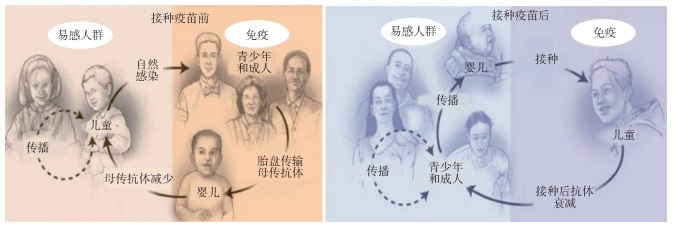
有些学者提出百日咳传播模式的转变是百日咳再现的一个重要因素[12-16]。针对百日咳新的流行特征,Hewlett和Edwards[12]提出疫苗使用前后百日咳不同传播模式的理论(图 2)。该理论认为,在疫苗大规模接种前,多数病例为儿童,百日咳处于高流行时期,青少年和成人通过反复接触百日咳鲍特菌致使体内抗体维持在较高水平,且孕妇体内的高水平抗体还可通过胎传抗体间接保护出生不久的婴儿;这一时期的显著特征是百日咳鲍特菌主要由儿童向青少年和成人传播。在疫苗大规模接种时期,儿童因普遍接种疫苗而受到保护,百日咳发病率降低并一直处于低流行状态,导致儿童体内抗体随时间逐渐衰减,此后发生的百日咳病例,多为抗体已衰减至无保护作用的青少年、成人以及尚未到疫苗基础免疫接种时间的婴儿;这一时期的显著特征是百日咳鲍特菌主要由青少年和成人传播给婴儿,并被许多研究报告所证实,如国外学者研究发现未接种百日咳疫苗的婴幼儿病例,其主要传染源为青少年和成人[13-14];在加拿大、法国、德国和美国开展的研究显示,76%~83%的婴幼儿病例是由以父母为主的家庭成员传染所致,提示在家庭型发病模式中,成人是婴幼儿百日咳病例的主要传染源[15];Kowalzik等[16]研究证实,在欧洲、拉丁美洲和部分亚洲国家,成人尤其是父母是婴幼儿百日咳的最主要传染源。
1.3 中国已有百日咳再现的研究报告自百白破疫苗纳入儿童计划免疫之后,中国百日咳的发病也出现大幅下降,一度被认为得到有效控制。在国外报道百日咳再现之后,中国学者重新开始对百日咳予以关注。2002年,Wang等[17]报道2000年6月至2001年5月北京儿童医院因呼吸道感染住院的婴幼儿中,11%的患者百日咳鲍特菌培养阳性,提示百日咳发病已不少见。张颖等[18]和黄海涛[19]通过监测证实,在接种率维持高水平的同时,天津市百日咳发病较以往明显增加,已具有百日咳再现特征。近年来,陕西省、广东省、山东省、重庆市等也发现百日咳局部暴发或流行[20-23]。部分临床研究也报告百日咳病例异常增多的现象[24]。上述研究结果显示,尽管全国范围尚未形成百日咳再现的情形,但部分区域百日咳病例异常增多甚至流行的事实,与国外发达国家百日咳再现并无原则性差异,这一观点已被业内多数专家所认可。因此,目前有必要深入研究中国百日咳发病的历史和形势,并结合国外百日咳再现的研究进展,分析中国百日咳再现的原因及其影响因素,探讨今后的防控策略。
2、尽管中国近年来百日咳报告发病呈逐年上升趋势,但实际发病仍可能被严重低估 2.1 中国百日咳报告病例数呈上升态势,与国际疫情趋势基本一致在疫苗使用前,中国百日咳年报告发病率为100/10万~200/10万[25]。自20世纪60年代,中国开始接种百白破疫苗,并于1978年将百白破疫苗纳入儿童计划免疫,百日咳发病率大幅下降,2006-2010年百日咳年均报告发病率已降至0.2/10万[26]。近年来,虽然中国3剂次百白破疫苗报告接种率保持在99%以上[27],但百日咳报告发病率却呈现上升趋势[5, 28-29],2019年报告发病率达2.15/10万。而国外百日咳报告发病率较国内更高,汇总分析2001-2019年WHO网站(https://apps.who.int/immunization_monitoring/globalsummary/)公布的百日咳疫情,并与中国的疫情数据进行对比发现,美国、日本和印度同期的发病率均显著高于中国(图 3)。如2019年美国3剂次百白破疫苗报告接种率为94%,百日咳报告发病数为15 662例,报告发病率为4.79/10万;澳大利亚3剂次百白破疫苗报告接种率为95%,百日咳报告发病数为12 021例,报告发病率为47.7/10万。值得注意的是,对于百日咳病例诊断,中国除个别省份部分医疗机构开展实验室诊断以外,其他机构基本以临床诊断为主,而美国和日本等主要基于实验室诊断。
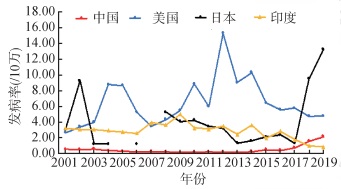
|
| 图 3 2001-2019年中国、美国、日本和印度百日咳报告发病率 |
此外,从病例年龄分布来看,近些年国外大年龄组儿童、青少年和成人感染百日咳的报道日渐增多,而中国百日咳发病的主要人群为青少年、未接种或未全程接种百日咳疫苗的婴幼儿[30]。欧盟国家2018年百日咳报告显示,≥15岁人群报告病例数占总报告病例数的62%,< 1岁婴儿仅占10%左右[31]。而中国2011-2017年百日咳报告病例以 < 1岁婴儿为主,占64.33%[6]。国内外百日咳报告病例的年龄分布差异,可能与中国对青少年和成人百日咳疾病认识和诊断意识低,从而导致漏诊漏报有关。
2.2 中国百日咳发病情况仍可能被严重低估通过检测人群血清中针对百日咳毒素(pertussis toxin,PT)IgG(PT-IgG)抗体阳性率,可以估算百日咳感染率。天津市2010-2012年4~83岁人群估算感染率为10 852/10万[32];北京市2010年3~69岁人群估算感染率为5 400/10万[33],2012年≥5岁人群估算感染率超过6 000/10万[34];广东省2010年 > 7岁人群估算感染率为9 395/10万[35];重庆市2011年通过对健康人群血清学结果估算,百日咳感染率为7 290/10万[28]。尽管在方法学上尚无法区分PT-IgG抗体阳性是由疫苗还是自然感染所致,但由于疫苗诱导抗体可能衰减较快,故估算感染率仍可侧面反映中国百日咳实际感染率被严重低估的现状。此外,朱启镕等代表中华预防医学会疫苗可预防疾病儿童百日咳临床调查研究协作组研究发现[36],2008-2009年,上海市、重庆市、银川市、昆明市等地区≥6岁连续咳嗽2周以上儿童和青少年中实验室检测的百日咳感染率为11.3%。
目前中国现行的百日咳病例报告依赖于传染病网络直报信息系统,是基于各级医院疫情报告的被动监测,而主动监测与被动监测报告发病率差异甚大。如张颖等[18]研究发现,百日咳社区监测的人群报告发病率是同期医院报告发病率的12倍。黄海涛等[32]基于主动监测的研究发现,主动监测报告发病率是同期被动报告发病率的16.22倍。主动监测与被动监测报告发病率之间的差别,既提示被动报告敏感性差、存在漏报现象,也表明中国百日咳实际发病率可能被严重低估。近期的研究发现,百日咳实际发病情况远远比报告的结果严重,可能有高达95%的感染者未被诊断和报告[37]。其实,国内外均不同程度存在百日咳报告发病率低于实际发病的状况,究其原因,可能与以下因素有关:①青少年和成人症状不典型,常不就诊。青少年和成人百日咳患者常表现为无症状、轻微咳嗽或持续性咳嗽[38]。②百日咳病例实验室诊断比例低。Aksakal等[39]对6~14岁长时间咳嗽的学龄前儿童血清学检测发现,16.6%的调查对象有近期百日咳感染的血清学表现,但并未被诊断为百日咳。③临床诊断标准不统一。不同国家和地区采用的诊断标准有所差异,百日咳再现促进了对不典型百日咳的认识,暴露了现行标准的不足[40]。④医生对百日咳的诊断意识不足[41]。在经历了百日咳长年低发之后,临床医生对百日咳的警觉不高,即使遇上此类病例,也常常使用诸如类百日咳、百日咳综合征等不规范的诊断名称。⑤实验室检测条件的局限性。百日咳实验室检测受标本采集、采样时间、疫苗免疫史和抗生素使用等因素影响,PCR和细菌培养在疾病晚期敏感性不高,血清学检测在方法学上存在一定的缺陷,目前中国大多数医院未开展相关检测工作。⑥疫情报告和管理方面的客观影响。百日咳在中国属于法定传染病,临床医生有时因疫情报告繁琐而将疑似病例诊断为上呼吸道感染等其他疾病,从而减少了医院的病例报告数。
2.3 中国已存在与国外百日咳再现相似的影响因素 2.3.1 易感人群在逐步积累百日咳基本再生数(R0)为5~17,传染性强,易造成百日咳的持续传播和流行。人群对百日咳普遍易感且一生可多次感染,而自然感染不能产生终生免疫,保护年限仅为4~20年。北京市一项血清学调查显示[42],约2/3的孕妇和新生儿PT-IgG抗体水平低于检测下限(< 5 IU/ml)。另一项全年龄段人群(0~89岁)的血清学调查显示,各个年龄组PT-IgG抗体达到40 IU/ml者均不超过10%[43]。由此可见,中国在进入疫苗时代后,除了未到百白破疫苗接种时间的婴儿之外,随着疫苗免疫和自然感染免疫的衰减,已逐步积累起大量的百日咳易感人群。
2.3.2 中国已存在百日咳从青少年/成人到婴幼儿的传播模式相关研究提示[18],中国百日咳病例中,成人已成为新的高发人群,并成为婴幼儿病例的重要传染源。中国百日咳家庭聚集性发病中,有多种传播模式,其中从青少年/成人到婴幼儿的传播模式在所有发病中占比为80%[32]。目前中国青少年/成人百日咳总报告病例数之所以不多,估计仍与对大年龄段人群百日咳的诊断和报告意识不强、缺乏严密的流行病学监测有关。
2.3.3 实验室检测技术的逐步普及近年部分欧美国家百日咳再现的发生引起全球研究者越来越多的关注,百日咳再现成为研究热点之一。中国的一些临床医生尤其是儿科医生也增强了对百日咳实验室检测和临床诊断的意识,通过积极推进对百日咳的再认识,不断提高实验室和临床诊断水平。2013年起中国陆续有3个PT-IgG抗体检测试剂盒获准上市,2019年核酸PCR检测试剂也获准上市,医疗机构逐渐将百日咳鲍特菌分离培养、PT抗体检测以及更敏感的核酸PCR检测方法作为诊断百日咳实验室依据,这必将促进百日咳病例的发现。
2.3.4 百日咳监测和报告工作正在提升近年来,中国的疾病预防控制机构与医院加强了百日咳监测、专题研究等工作,促进了百日咳病例的发现和报告。例如,天津市和山东省以市(省)为单位开展百日咳加强监测工作,河北省、重庆市、广东省、陕西省、新疆维吾尔自治区等也在1个地级市开展百日咳的加强监测工作。根据中国疾病预防控制信息系统数据,中国2019年百日咳报告发病率居前5位的省份为重庆市(6.77/10万)、湖南省(6.18/10万)、陕西省(6.15/10万)、山东省(5.04/10万)和广东省(4.38/10万)(图 4),其报告发病水平较高与百日咳加强监测和实验室检测工作的开展存在直接关联[6]。2019年全国百日咳报告病例中,5岁以下儿童占87.95%。专家评估认为,如果开展以社区人群为基础的加强监测,更多的青少年和成人百日咳病例将被发现并报告,报告病例数还将大幅度增加。
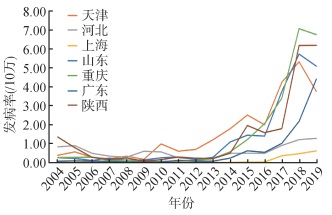
|
| 图 4 2004-2019年中国部分省份百日咳报告发病率 |
WHO认为[1],近年部分国家的百日咳再现可能与无细胞百白破联合疫苗(diphtheria,tetanus and acellular pertussis combined vaccine,DTaP)的广泛使用有关。DTaP可预防百日咳,相对于全细胞百白破联合疫苗(diphtheria,tetanus and whole-cell pertussis combined vaccine,DTwP)和自然感染,DTaP预防感染和减少后续传播的能力相对较弱。但是DTaP不良反应发生风险远远低于DTwP。目前,欧美国家、日本、韩国、澳大利亚等发达国家已于2005年以前采用DTaP替代了DTwP。2005年起,中国开始批签发DTaP,2007年起逐步使用DTaP替代DTwP,并于2013年完成替代[44]。
3、百日咳疫苗免疫仍是全球预防百日咳最有效的特异性措施 3.1 自然感染和疫苗接种都不能诱导终生免疫力人群对百日咳普遍易感[45],人体可以通过自然感染或接种疫苗获得对百日咳的免疫力。但越来越多的研究表明,无论是通过自然感染还是通过疫苗接种获得的免疫力,都不能持续终生[46]。研究发现,通过接种疫苗产生的百日咳特异性抗体可以持续4~12年,通过自然感染获得的免疫力可以持续4~20年[47-48]。针对全细胞百日咳疫苗长时间追踪的研究显示,6~12年后疫苗的保护率会下降50%[49-50]。国外一项前瞻性研究对1 000多名0~7岁儿童连续观察10年,研究显示,婴幼儿接种无细胞百日咳疫苗的保护效力从接种后的100%逐渐衰减,而到4、5岁时保护效力下降至50%左右[51]。
3.2 使用无细胞百日咳疫苗可有效减少严重异常反应风险,也能有效控制百日咳疫情当前常见的百日咳疫苗有两类:基于灭活百日咳鲍特菌制成的全细胞疫苗和基于高度纯化的选择性细菌抗原制成的无细胞疫苗[1]。中国既往一直使用DTwP,鉴于全细胞疫苗接种不良反应特别是局部反应发生率高,中国参照WHO的建议和国外的经验,也逐步完成对DTwP的替换。
3.2.1 全细胞百日咳疫苗全细胞百日咳疫苗是将百日咳全菌体灭活后,与佐剂配合,直接用作免疫用疫苗[52]。全细胞百日咳疫苗于20世纪初研制成功,由于其生产成本低,生产技术难度低,在全球迅速得到了广泛使用,使全球百日咳发病率大幅下降,减轻了疾病负担与社会经济负担[53]。中国于20世纪60年代开始使用全细胞百日咳疫苗,并于1978年将其纳入免疫规划,但由于全细胞百日咳疫苗接种后常出现轻微的局部反应,也会发生少见但严重的全身反应,全细胞百日咳疫苗接种后的安全性问题受到关注,人们于20世纪80年代开始研发新的低接种反应百日咳疫苗[54]。
3.2.2 无细胞百日咳疫苗无细胞百日咳疫苗主要是通过提取纯化技术,去掉一些无明显保护作用且易引发不良反应的毒性物质后制成的疫苗[55]。根据提纯工艺不同,可以将无细胞百日咳疫苗分为共纯化和组分纯化两类。共纯化疫苗指同时提取纯化疫苗中的PT和丝状血凝素(FHA)等有效成分,最早由日本研制成功,中国目前采用此种工艺方法[56];该方法疫苗的生产成本低,产率相对较高,但存在批次间抗原比例不稳定、原液之间含量不一致的问题[57]。另一种方法是组分纯化,将具有免疫原性的抗原分别纯化,再按照适宜的比例将纯化后的抗原组分混合,这种方法对各组分是可控的,并克服了共纯化技术的缺陷,但组分纯化技术要求较高,而且对纯度也有严格要求,使疫苗成本相对高[58]。与欧美发达国家相比,中国无细胞百日咳疫苗的共纯化生产工艺较之组分纯化工艺相对落后,存在一定的差距[52]。尽管目前中国生产的无细胞百日咳疫苗均为共纯化工艺生产,但有关企业正在积极研发组分纯化工艺疫苗。国际上有的组分纯化的无细胞百日咳疫苗除含有PT和FHA外,有的还加入了百日咳黏附素(pertactin,PRN)、菌毛蛋白2(FIM2)、菌毛蛋白3(FIM3)等成分。尽管各国使用的无细胞百日咳疫苗组分及其含量有所不同,但均含有公认的保护性抗原PT[59]。有学者认为,无论多少组分的无细胞百日咳疫苗,只要能诱导PT抗体,即可对百日咳起到免疫预防作用[53]。2015年WHO百日咳疫苗立场文件中指出,各组分无细胞百日咳疫苗的有效性相当,均可用于百日咳免疫接种[1]。美国食品药品监督管理局和欧洲疾病预防控制中心也发表声明或在其指导意见中指出,已无必要再讨论无细胞百日咳疫苗的组分数量问题,因为实际使用的效果数据已经证实无显著性差异[60-61]。含无细胞百日咳成分的百白破联合疫苗根据组分中抗原含量的不同,可以分为全抗原含量百白破联合疫苗(DTaP)和其中减少了白喉、百日咳抗原含量的百白破联合疫苗(Tdap)。其中,DTaP主要用于儿童基础免疫;Tdap主要用于青少年和成人加强免疫,能产生与DTaP免疫相当的抗体水平,且疫苗的安全性更好。因此,Tdap是青少年和成人加强免疫的首选[62]。美国免疫实施咨询委员会(ACIP)推荐11岁以上的青少年和19~64岁的成人接种Tdap[45]。目前有两种用于青少年和成人加强免疫的Tdap在北美和欧洲批准上市,中国目前尚无用于青少年和成人的Tdap注册上市,有关企业正在积极研发中。
3.3 调整百日咳疫苗免疫策略是保护婴幼儿和全人群的重要途径 3.3.1 及时接种含百日咳成分疫苗,提高并保持高水平接种率是预防百日咳最基本的免疫策略百日咳免疫接种的核心目的是预防和减少婴幼儿百日咳重症和死亡病例[1]。WHO推荐采取3剂次基础免疫程序,第1剂最早在6周龄且不晚于8周龄时接种,后续剂次则间隔4~8周,且在6月龄前完成3剂基础免疫[1]。目前大多数国家与WHO推荐的免疫程序保持一致[30]。因此,各国应采取相应的措施,增强疫苗接种服务的可及性,将提高并保持高水平百日咳疫苗接种率包括及时接种率作为最基本的免疫策略。
3.3.2 对青少年和成人开展含百日咳成分疫苗加强免疫是预防百日咳的重要补充策略因百日咳疫苗免疫后的保护力随时间延长而下降,青少年和成人患百日咳增多,且成为婴幼儿百日咳的重要传染源,故目前欧美多个国家均推荐对青少年和成人开展含百日咳成分疫苗的加强免疫[41]。各个国家基础和加强免疫策略略有不同,部分国家含百日咳成分疫苗推荐接种方案见表 1。
3.3.3 探索高风险人群选择性免疫策略,以进一步保护易感人群研究表明,中国成人体内百日咳抗体水平较低,婴儿基本无法获得足够的母传保护性抗体,而根据中国现行免疫规划疫苗免疫程序,婴儿接种第1剂DTaP的时间为3月龄,完成基础免疫最早时间为5月龄。为了降低婴儿百日咳发病风险,WHO建议第1剂DTaP接种时间最早为6周龄且不晚于8周龄,孕妇可在妊娠中期或晚期接种1剂Tdap[1],部分国家已将孕妇接种纳入国家免疫规划常规接种计划[64]。然而有研究显示,孕期接种Tdap可能在一定程度上影响婴儿出生后接种DTaP的主动免疫应答[65]。
上述通过甄别高风险人群并采取选择性免疫接种的做法也是一种保护易感人群、减少百日咳发病的免疫策略。因此,GPI建议对妊娠晚期的孕妇使用Tdap接种,以提高母传抗体水平;或对产后母亲及其家庭成员和新生儿密切接触者进行接种,并对婴儿形成严密保护,称为“茧策略”(cocoon strategy)[66],该策略可以同时预防婴幼儿和成人发病[67]。但有学者认为,该策略的依从性受限于父母对百日咳的认知[68],而且婴幼儿的感染有一部分来源于家庭以外的成员[69],该策略并不能完全保护婴幼儿免于感染百日咳,且实施难度较大,故该策略并不符合成本效益[13]。
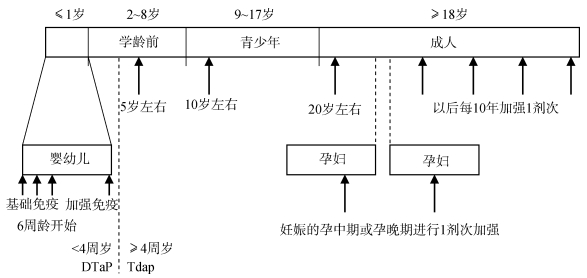
另外,国外专家提出了覆盖终生的免疫策略[10](图 5)。该策略建议在4周岁之前接种DTaP,在4周岁后接种Tdap。婴幼儿时期接种程序按照WHO建议,最早在6周龄且不晚于8周龄开始接种,6月龄内完成3剂次基础免疫,随后完成首剂次加强免疫;学龄前儿童在5岁左右加强1剂次;青少年时期在10岁左右加强1剂次;成年后在20岁左右加强1剂次,以后每10年进行1剂次加强。对于孕妇,建议在每次妊娠的孕中期或孕晚期进行1剂次加强。该建议为各个国家制定免疫策略提供了参考。
4、中国百日咳防控工作的思考与建议面对百日咳再现这一挑战,中国疾病预防控制管理者和专家以及广大医疗卫生领域的工作人员应该保持清醒的头脑,积极探讨应对策略。为此,中华预防医学会倡议的“中国百日咳行动计划”(CPI),将联合有关单位和专家从技术方面开展一些前期工作,其主要工作任务是进一步推动和组织百日咳防控等关键技术的研究,特别是提出完善百日咳临床诊断、治疗与病例报告标准,加强百日咳主动监测、完善流行病学调查和实验室检测及完善中国百日咳防控策略等技术建议。同时,不定期地将有关研究结果和建议,以专家共识等形式向相关领域的专业人员进行介绍,必要时上报国家有关部门。从目前中国百日咳防控工作的进展情况来看,建议中国今后加强以下相关工作。
4.1 加强百日咳监测工作,积极开展主动监测疾病监测是制定有效控制措施的基础。WHO鼓励全球各国针对百日咳(尤其是实验室确诊病例)开展科学的流行病学监测,以监测疾病负担和免疫接种的效果。近年来,多个国家报道了百日咳再现现象,且多有青少年和成人病例增加的报道。中国监测系统的数据显示,虽然近年百日咳发病率有上升趋势,但尚处于较低水平,且主要发病人群为婴幼儿,与国外报道不同。研究显示,中国主动和被动监测模式下的百日咳报告发病率和流行特征有较大差别,提示中国监测系统的敏感性可能存在不足。建议加强流行病学和实验室监测工作,积极开展主动监测,了解中国百日咳的真实疾病负担和流行特征,分析其传播模式,为制定针对性的防控措施和免疫策略提供科学依据。
4.2 完善百日咳临床诊断标准,提升百日咳防治水平和报告意识疾病诊断是防控的关键。近年来的百日咳再现过程中,临床医生对不典型百日咳的认识、实验室检测方法等水平提高,同时比较国内外诊断标准的差异后发现中国当前百日咳临床诊断标准(WS 274-2007)的不足[39]。一方面,由于疫苗的使用,百日咳报告发病在中国长期处于低水平流行且临床症状典型病例减少,导致目前临床医生对百日咳的认知与防治意识不足,常常漏诊、误诊不典型病例。另一方面,百日咳实验室诊断患者发病到采样时间间隔以及标本种类、质量、运输条件、抗生素应用等多种因素影响,导致百日咳鲍特菌分离困难;同时恢复期与急性期双份血清抗体4倍增长的诊断要求在实际操作中较为困难,且无助于急性期诊断[69]。不同年龄和疫苗接种史患者罹患百日咳临床症状的差异增加了百日咳临床诊断难度。为提高百日咳诊断水平,建议更新百日咳诊断标准,比如依据不同年龄特点制定临床诊断建议,考虑百日咳鲍特菌核酸检测、单份血清PT-IgG抗体等已在欧洲等国家应用多年,应将这些成熟且公认的实验室检测方法纳入诊断依据[70-71]。为提高百日咳防治水平,建议在加强实验室检测能力建设的同时加强对临床医生百日咳诊断的培训,提升对百日咳的防治意识与警惕性。
4.3 加强百日咳实验室诊断方法的研发和评价,提高检测能力和水平百日咳再现凸显了采用标准化病原学检测方法开展疾病诊断的重要性,缺乏灵敏、特异的实验室诊断方法将导致不同国家或地区之间百日咳的报告存在较大差异。准确的实验室诊断也是鉴别其他病原体感染导致的类百日咳或百日咳综合征的重要手段。及时做出百日咳诊断,合理给予敏感抗生素治疗,可有效缓解患者症状、控制传播;同时,对高危人群开展暴露后预防,可以保护未接种疫苗或未完成免疫程序的婴幼儿,降低感染百日咳后发生重症病例和死亡的风险。准确诊断百日咳还是揭示特定年龄组人群百日咳发病趋势的重要前提,这对于评估疫苗保护效力或效果的变化、细菌适应性菌株的出现有着重要的参考价值[72]。接种含PT成分的无细胞百日咳疫苗对现有以PT-IgG抗体为基础的血清学诊断方法带来了挑战,建议针对疫苗中不含有的抗原成分开展研究,寻找可替代PT抗原的其他成分来开展血清学诊断。PCR是诊断百日咳感染的敏感方法,可弥补疾病早期开展细菌培养和后期开展血清学诊断的不足,无论疾病处于何种阶段均可使用,但在设计PCR靶标、提高检测敏感性和特异性等方面尚需要更加标准化。总之,建议加快百日咳实验室方法的临床研发和评价,将标准、灵敏、快速、无创、便宜和便捷的方法运用于临床和公共卫生实践。
4.4 加快含百日咳成分新疫苗的研发、生产和引进目前中国DTaP生产仍采用共纯化工艺,存在批次间抗原比例不稳定等问题,建议促进以组分纯化工艺为基础开展新型疫苗研发。一般来讲,无细胞百日咳疫苗产生的免疫力与全细胞百日咳疫苗相比,由于诱导免疫方式不同,前者的抗体衰减更为迅速,且记忆免疫应答低。另外,自DTaP使用以来,百日咳鲍特菌已出现了适应性变异,如发现PRN、PT等毒力因子缺失的临床分离株明显增加。欧洲近期一项研究发现含有PRN抗原的DTaP使用时间越久,PRN缺失的临床分离株比例越高[73],说明现有百日咳疫苗对该型百日咳鲍特菌感染的保护效力降低。这些结果均提示需加快研制新型疫苗,以提供更全面、高效和持久的保护。此外,对于青少年和成人加强免疫,应针对性地研制或引进国外已批准上市的减量相关抗原的Tdap。
4.5 完善中国百日咳疫苗免疫程序和免疫策略中国目前含百日咳成分疫苗的免疫程序为3、4、5月龄各接种1剂次DTaP,在18~24月龄加强1剂次DTaP,另在6岁时加强1剂次白喉破伤风联合疫苗[74]。宁桂军等[6]对中国2011-2017年百日咳流行病学特征的分析显示,在所有百日咳报告病例中,< 1岁婴儿病例数占64.33%;而在 < 1岁病例中,≤2月龄占28.05%,3~5月龄占41.95%,即约70%的 < 1岁婴儿病例未达到接种DTaP的月龄或尚未完成基础免疫,提示现有的DTaP免疫程序无法有效保护≤5月龄儿童。为了降低婴幼儿百日咳的疾病负担,保护婴幼儿生命健康,建议积极开展研究,探索将中国儿童百日咳疫苗初始免疫提前到2月龄甚至6周龄的可行性。同时,还要探索如何在现有免疫程序基础上开展学龄儿童、青少年和成人、孕妇的加强免疫,例如在入学前加强1剂次DTaP,以提高人群免疫水平,控制百日咳鲍特菌的传播。
4.6 加强科普教育,提高公众的认知度和参与防控的主动性研究表明,百日咳不仅是影响儿童健康且可感染任何年龄群体的呼吸道传染病。虽然青少年和成人罹患百日咳后自身罕有重症或致死的后果,但他们可加剧百日咳鲍特菌在人群中的传播,并最终感染婴幼儿,是当前百日咳再现引发严重后果的重要环节。积极开展暴露后预防工作也是非常重要的防控手段。研究发现,百日咳病例的密切接触者呼吸道样本中百日咳鲍特菌携带率高达8%~83%[75],对实验室确诊的百日咳病例周围暴露人群积极开展化学药物预防也是阻断细菌传播和控制暴发的有效手段之一[76]。此外,勤洗手、戴口罩等非特异性预防措施均可以有效预防通过呼吸道传播的疾病。因此,结合当前中国防控新型冠状病毒肺炎取得的有效经验,建议今后应进一步加强健康教育和健康促进等科普工作,大力普及公共卫生常识和百日咳防控知识,提高公众对健康共同体理念的认知度以及积极参与公共卫生和防控传染病的主动性。
参加本共识讨论及撰写的专家(按姓氏拼音排序)
邓继岿(深圳市儿童医院)、刁连东(原江苏省疾病预防控制中心)、何秋水(首都医科大学/芬兰图尔库大学医学院)、蒋荣猛(首都医科大学附属北京地坛医院)、李艺星(中国疾病预防控制中心免疫规划中心)、梁晓峰(中华预防医学会)、马霄(中国食品药品检定研究院)、邵祝军(中国疾病预防控制中心传染病预防控制所)、余建兴(中国疾病预防控制中心传染病预防控制所)、吴丹(中国疾病预防控制中心免疫规划中心)、吴疆(北京市疾病预防控制中心)、徐爱强(山东省疾病预防控制中心)、辛美哲(中华预防医学会)、杨焕(原国家药品监督管理局药品审评中心)、姚开虎(首都医科大学附属北京儿童医院)、尹遵栋(中国疾病预防控制中心免疫规划中心)、张丽(山东省疾病预防控制中心)、张颖(天津市疾病预防控制中心)
利益冲突 所有作者均声明不存在利益冲突
| [1] |
W HO. Pertussis vaccines:WHO position paper-September 2015[J]. Wkly Epidemiol Rec, 2015, 90(35): 433-458. |
| [2] |
CDC. Pertussis (whooping cough)[EB/OL]. (2019-12-17)[2021-01-12]. http://www.cdc.gov/pertussis/outbreaks/trends.html.
|
| [3] |
Government of Canada. Pertussis (whooping cough): for health professionals[EB/OL]. (2020-01-07)[2021-01-12]. https://www.canada.ca/en/public-health/services/immunization/vaccine-preventable-diseases/pertussis-whooping-cough/health-professionals.html.
|
| [4] |
Amirthalingam G. Strategies to control pertussis in infants[J]. Arch Dis Child, 2013, 98(7): 552-555. DOI:10.1136/archdischild-2012-302968 |
| [5] |
刁连东, 徐爱强. 百日咳免疫预防专家共识[J]. 中华流行病学杂志, 2011, 32(6): 550-553. DOI:10.3760/cma.j.issn.0254-6450.2011.06.004 |
| [6] |
宁桂军, 高源, 吴丹, 等. 中国2011-2017年百日咳流行病学特征分析[J]. 中国疫苗和免疫, 2018, 24(3): 264-267, 273. |
| [7] |
Domenech de Cellès M, Magpantay FM, King AA, et al. The pertussis enigma:reconciling epidemiology, immunology and evolution[J]. Proc Biol Sci, 2016, 283(1822): 20152309. DOI:10.1098/rspb.2015.2309 |
| [8] |
Ghorbani GR, Zahraei SM, Moosazadeh M, et al. Comparing Seasonal Pattern of Laboratory Confirmed Cases of Pertussis with Clinically Suspected Cases[J]. Osong Public Health Res Perspect, 2016, 7(2): 131-137. DOI:10.1016/j.phrp.2016.02.004 |
| [9] |
Liu XC, Bell CA, Simmonds KA, et al. Epidemiology of pertussis in Alberta, Canada 2004-2015[J]. BMC Public Health, 2017, 17(1): 539. DOI:10.1186/s12889-017-4468-4 |
| [10] |
Esposito S, Stefanelli P, Fry NK, et al. Pertussis Prevention:Reasons for Resurgence, and Differences in the Current Acellular Pertussis Vaccines[J]. Front Immunol, 2019, 10: 1344. DOI:10.3389/fimmu.2019.01344 |
| [11] |
Martinón-Torres F, Heininger U, Thomson A, et al. Controlling pertussis:how can we do it? A focus on immunization[J]. Expert Rev Vaccines, 2018, 17(4): 289-297. DOI:10.1080/14760584.2018.1445530 |
| [12] |
Hewlett EL, Edwards KM. Clinical practice. Pertussis-not just for kids[J]. N Engl J Med, 2005, 352(12): 1215-1222. DOI:10.1056/NEJMcp041025 |
| [13] |
CDI Editorial team. Erratum:Who gives pertussis to infants? Source of infection for laboratory confirmed cases less than 12 months of age during an epidemic, Sydney, 2009. (Article originally published in Commun Dis Intell Q Rep 2010;34(2):116-121)[J]. Commun Dis Intell (2018), 2019, 43: 116. DOI:10.33321/cdi.2019.43.16 |
| [14] |
Skoff TH, Kenyon C, Cocoros N, et al. Sources of Infant Pertussis Infection in the United States[J]. Pediatrics, 2015, 136(4): 635-641. DOI:10.1542/peds.2015-1120 |
| [15] |
Wendelboe AM, Hudgens MG, Poole C, et al. Estimating the role of casual contact from the community in transmission of Bordetella pertussis to young infants[J]. Emerg Themes Epidemiol, 2007, 4: 15. DOI:10.1186/1742-7622-4-15 |
| [16] |
Kowalzik F, Barbosa AP, Fernandes VR, et al. Prospective multinational study of pertussis infection in hospitalized infants and their household contacts[J]. Pediatr Infect Dis J, 2007, 26(3): 238-242. DOI:10.1097/01.inf.0000256750.07118.ee |
| [17] |
Wang J, Yang Y, Li J, et al. Infantile pertussis rediscovered in China[J]. Emerg Infect Dis, 2002, 8(8): 859-861. DOI:10.3201/eid0808.010442 |
| [18] |
张颖, 黄海涛, 刘勇, 等. 天津市社区人群百日咳发病监测及传播特征研究[J]. 中国疫苗和免疫, 2011, 17(3): 209-211, 257. |
| [19] |
黄海涛. 百日咳再现及其应对策略的研究进展[J]. 医学综述, 2015, 21(9): 1630-1632. DOI:10.3969/j.issn.1006-2084.2015.09.035 |
| [20] |
段利娜, 刘刚, 孔东风, 等. 2005-2016年深圳市百日咳发病反弹流行病学特征[J]. 热带医学杂志, 2019, 19(1): 92-94. DOI:10.3969/j.issn.1672-3619.2019.01.023 |
| [21] |
Zhang Y, Bambrick H, Mengersen K, et al. Resurgence of Pertussis Infections in Shandong, China:Space-Time Cluster and Trend Analysis[J]. Am J Trop Med Hyg, 2019, 100(6): 1342-1354. DOI:10.4269/ajtmh.19-0013 |
| [22] |
Liu Z, Liu S, Shu Y, et al. Severe Bordetella pertussis infection and vaccine issue in Chongqing, from 2012 to 2018[J]. Int J Infect Dis, 2019, 84: 102-108. DOI:10.1016/j.ijid.2019.05.014 |
| [23] |
Wang Z, Cui Z, Li Y, et al. High prevalence of erythromycin-resistant Bordetella pertussis in Xi'an, China[J]. Clin Microbiol Infect, 2014, 20(11): 825-830. DOI:10.1111/1469-0691.12671 |
| [24] |
王传清, 朱启镕. 百日咳与非百日咳迁延性慢性咳嗽儿童及青少年临床特征分析[J]. 临床儿科杂志, 2010, 28(6): 542-544. DOI:10.3969/j.issn.1000-3606.2010.06.010 |
| [25] |
张兴录, 杨志伟, 周军, 等. 我国近年百日咳流行病学特点分析[J]. 中国计划免疫, 2000, 6(2): 93-95. DOI:10.3969/j.issn.1006-916X.2000.02.011 |
| [26] |
汪海波, 罗会明, 温宁, 等. 我国2006-2010年百日咳流行病学分析[J]. 中国疫苗和免疫, 2012, 18(3): 207-210. |
| [27] |
崔健, 曹雷, 郑景山, 等. 中国2015年国家免疫规划疫苗报告接种率分析[J]. 中国疫苗和免疫, 2017, 23(6): 601-607. |
| [28] |
Yao N, Zeng Q, Wang Q. Seroepidemiology of diphtheria and pertussis in Chongqing, China:serology-based evidence of Bordetella pertussis infection[J]. Public Health, 2018, 156: 60-66. DOI:10.1016/j.puhe.2017.12.009 |
| [29] |
裴亚楠, 马骏. 2013-2017年天津市滨海新区百日咳流行特征分析[J]. 现代预防医学, 2018, 45(17): 3080-3083, 3097. |
| [30] |
李薇, 王梅. 百日咳现状及预防控制进展[J]. 预防医学论坛, 2013, 19(1): 52-54, 58. |
| [31] |
European Centre for Disease Prevention and Control. Pertussis in: ECDC. Annual epidemiological report for 2018[EB/OL]. (2020-09-25)[2021-01-12]. https://www.ecdc.europa.eu/en/publications-data/pertussis-annual-epidemiological-report.
|
| [32] |
黄海涛, 刘勇, 高志刚, 等. 天津市2010-2012年社区人群百日咳血清流行病学调查[J]. 中华流行病学杂志, 2014, 35(12): 1354-1357. DOI:10.3760/cma.j.issn.0254-6450.2014.12.009 |
| [33] |
Zhang Y, Chen Z, Zhao J, et al. Increased susceptibility to pertussis in adults at childbearing age as determined by comparative seroprevalence study, China 2010-2016[J]. J Infect, 2019, 79(1): 1-6. DOI:10.1016/j.jinf.2019.04.011 |
| [34] |
Li X, Chen M, Zhang T, et al. Seroepidemiology of diphtheria and pertussis in Beijing, China:A cross-sectional study[J]. Hum Vaccin Immunother, 2015, 11(10): 2434-2439. DOI:10.1080/21645515.2015.1062954 |
| [35] |
Zhang Q, Zheng H, Liu M, et al. The seroepidemiology of immunoglobulin G antibodies against pertussis toxin in China:a cross sectional study[J]. BMC Infect Dis, 2012, 12: 138. DOI:10.1186/1471-2334-12-138 |
| [36] |
中华预防医学会疫苗可预防疾病儿童百日咳临床调查研究协作组. 持续性咳嗽儿童百日咳临床多中心调查研究[J]. 中华儿科杂志, 2010, 48(10): 748-752. DOI:10.3760/cma.j.issn.0578-1310.2010.10.007 |
| [37] |
Tan T, Trindade E, Skowronski D. Epidemiology of pertussis[J]. Pediatr Infect Dis J, 2005, 24(5 Suppl): S10-18. DOI:10.1097/01.inf.0000160708.43944.99 |
| [38] |
王宗润, 米荣. 百日咳研究现状[J]. 当代医学, 2018, 24(6): 174-177. DOI:10.3969/j.issn.1009-4393.2018.06.081 |
| [39] |
Aksakal FN, Cöplü N, Ceyhan MN, et al. High incidence of Pertussis among schoolchildren with prolonged cough in Turkey[J]. Tohoku J Exp Med, 2007, 211(4): 353-358. DOI:10.1620/tjem.211.353 |
| [40] |
姚开虎, 邓继岿, 热夏提·达吾提. 百日咳诊断:现行标准的局限性和GPI建议[J]. 中国当代儿科杂志, 2016, 18(9): 891-896. DOI:10.7499/j.issn.1008-8830.2016.09.020 |
| [41] |
王丽婵, 马霄, 孟丽, 等. 百日咳疫苗免疫接种策略及相关研究进展[J]. 中华预防医学杂志, 2013, 47(1): 70-73. DOI:10.3760/cma.j.issn.0253-9624.2013.01.017 |
| [42] |
Meng QH, Luo J, Yang F, et al. A General Lack of IgG Against Pertussis Toxin in Chinese Pregnant Women and Newborns[J]. Pediatr Infect Dis J, 2018, 37(9): 934-938. DOI:10.1097/INF.0000000000001933 |
| [43] |
Liu D, Cheng X, Wei S, et al. Decline of serologic immunity to diphtheria, tetanus and pertussis with age suggested a full life vaccination in mainland China[J]. Hum Vaccin Immunother, 2021, 1-6. DOI:10.1080/21645515.2020.1840253 |
| [44] |
Xu Y, Tan Y, Asokanathan C, et al. Characterization of co-purified acellular pertussis vaccines[J]. Hum Vaccin Immunother, 2015, 11(2): 421-427. DOI:10.4161/21645515.2014.988549 |
| [45] |
Liang JL, Tiwari T, Moro P, et al. Prevention of Pertussis, Tetanus, and Diphtheria with Vaccines in the United States:Recommendations of the Advisory Committee on Immunization Practices (ACIP)[J]. MMWR Recomm Rep, 2018, 67(2): 1-44. DOI:10.15585/mmwr.rr6702a1 |
| [46] |
Di Mattia G, Nicolai A, Frassanito A, et al. Pertussis:New preventive strategies for an old disease[J]. Paediatr Respir Rev, 2019, 29: 68-73. DOI:10.1016/j.prrv.2018.03.011 |
| [47] |
Bednarek A, Bartkowiak-Emeryk M, Klepacz R, et al. Persistence of Vaccine-Induced Immunity in Preschool Children:Effect of Gestational Age[J]. Med Sci Monit, 2018, 24: 5110-5117. DOI:10.12659/MSM.908834 |
| [48] |
van Twillert I, van Gaans-van den Brink JA, Poelen MC, et al. Age related differences in dynamics of specific memory B cell populations after clinical pertussis infection[J]. PLoS One, 2014, 9(1): e85227. DOI:10.1371/journal.pone.0085227 |
| [49] |
Jenkinson D. Duration of effectiveness of pertussis vaccine:evidence from a 10 year community study[J]. Br Med J (Clin Res Ed), 1988, 296(6622): 612-614. DOI:10.1136/bmj.296.6622.612 |
| [50] |
Fine PE, Clarkson JA. Reflections on the efficacy of pertussis vaccines[J]. Rev Infect Dis, 1987, 9(5): 866-883. DOI:10.1093/clinids/9.5.866 |
| [51] |
Ohfuji S, Okada K, Nakano T, et al. Effectiveness of acellular pertussis vaccine in a routine immunization program:a multicenter, case-control study in Japan[J]. Vaccine, 2015, 33(8): 1027-1032. DOI:10.1016/j.vaccine.2015.01.008 |
| [52] |
潘殊男, 盛玉博. 中国百日咳疫苗的现状及研发趋势初探[J]. 微生物学免疫学进展, 2012, 40(5): 72-77. DOI:10.3969/j.issn.1005-5673.2012.05.016 |
| [53] |
柳艳萍. 百日咳流行现状及疫苗研究进展[J]. 职业与健康, 2018, 34(7): 1005-1009. |
| [54] |
李玉峰, 尹遵栋, 李艺星, 等. 百日咳疫苗保护效果及持久性的研究进展[J]. 中国疫苗和免疫, 2017, 23(2): 230-234. |
| [55] |
谢广中. 无细胞百日咳疫苗的发展及应用[J]. 上海预防医学, 2006, 18(1): 6-8. DOI:10.3969/j.issn.1004-9231.2006.01.002 |
| [56] |
骆鹏, 马霄, 侯启明. 建立我国百日咳组分纯化疫苗质量标准的探讨[J]. 中国生物制品学杂志, 2013, 26(9): 1351-1354. |
| [57] |
王静敏. 百日咳与百日咳疫苗[J]. 中华实用儿科临床杂志, 2013, 28(20): 1530-1535. DOI:10.3969/cma.j.issn.2095-428X.2013.20.004 |
| [58] |
王晓娟. 百日咳疫苗的应用及存在问题的讨论[J]. 中国药品标准, 2008, 9(6): 410-413. DOI:10.3969/j.issn.1009-3656.2008.06.004 |
| [59] |
Kapil P, Papin JF, Wolf RF, et al. Maternal Vaccination With a Monocomponent Pertussis Toxoid Vaccine Is Sufficient to Protect Infants in a Baboon Model of Whooping Cough[J]. J Infect Dis, 2018, 217(8): 1231-1236. DOI:10.1093/infdis/jiy022 |
| [60] |
The Pink Sheet. DTaP makers cannot claim superiority based on antigen number, FDA says[EB/OL]. (1998-08-03)[2021-01-12]. https://pink.pharmaintelligence.informa.com/PS032582/DTaP-Makers-Cannot-Claim-Superiority-Based-on-Antigen-Number-FDA-Says.
|
| [61] |
European Centre for Disease Prevention and Control. ECDC guidance: scientific panel on childhood immunization schedule: diphtheria-tetanus-pertussis (DTP) vaccination[EB/OL]. (2009-11-01)[2020-12-01].https://citeseerx.ist.psu.edu/viewdoc/download?doi=10.1.1.308.4260&rep=rep1&type=pdf.
|
| [62] |
Scheifele DW, Halperin SA, Ochnio JJ, et al. A modified vaccine reduces the rate of large injection site reactions to the preschool booster dose of diphtheria-tetanus-acellular pertussis vaccine:results of a randomized, controlled trial[J]. Pediatr Infect Dis J, 2005, 24(12): 1059-1066. DOI:10.1097/01.inf.0000190028.96152.46 |
| [63] |
Chiappini E, Stival A, Galli L, et al. Pertussis re-emergence in the post-vaccination era[J]. BMC Infect Dis, 2013, 13: 151. DOI:10.1186/1471-2334-13-151 |
| [64] |
于晓婷, 谌志筠, 何秋水. 无细胞百日咳疫苗全球孕期接种的现状[J]. 微生物学免疫学进展, 2020, 48(3): 59-65. |
| [65] |
Maertens K, Caboré RN, Huygen K, et al. Pertussis vaccination during pregnancy in Belgium:Results of a prospective controlled cohort study[J]. Vaccine, 2016, 34(1): 142-150. DOI:10.1016/j.vaccine.2015.10.100 |
| [66] |
Forsyth KD, Wirsing von Konig CH, Tan T, et al. Prevention of pertussis:recommendations derived from the second Global Pertussis Initiative roundtable meeting[J]. Vaccine, 2007, 25(14): 2634-2642. DOI:10.1016/j.vaccine.2006.12.017 |
| [67] |
Quinn HE, Snelling TL, Habig A, et al. Parental Tdap boosters and infant pertussis:a case-control study[J]. Pediatrics, 2014, 134(4): 713-720. DOI:10.1542/peds.2014-1105 |
| [68] |
Fedele G, Carollo M, Palazzo R, et al. Parents as source of pertussis transmission in hospitalized young infants[J]. Infection, 2017, 45(2): 171-178. DOI:10.1007/s15010-016-0943-6 |
| [69] |
吴丹遐, 陈强, 申昆玲. 百日咳的临床研究进展[J]. 中国当代儿科杂志, 2016, 18(9): 897-902. DOI:10.7499/j.issn.1008-8830.2016.09.021 |
| [70] |
Guiso N, Wirsing von König CH, Forsyth K, et al. The Global Pertussis Initiative:report from a round table meeting to discuss the epidemiology and detection of pertussis, Paris, France, 11-12 January 2010[J]. Vaccine, 2011, 29(6): 1115-1121. DOI:10.1016/j.vaccine.2010.12.010 |
| [71] |
Xu Y, Wang L, Xu J, et al. Seroprevalence of pertussis in China:need to improve vaccination strategies[J]. Hum Vaccin Immunother, 2014, 10(1): 192-198. DOI:10.4161/hv.26335 |
| [72] |
van der Zee A, Schellekens JF, Mooi FR. Laboratory Diagnosis of Pertussis[J]. Clin Microbiol Rev, 2015, 28(4): 1005-1026. DOI:10.1128/CMR.00031-15 |
| [73] |
Barkoff AM, Mertsola J, Pierard D, et al. Pertactin-deficient Bordetella pertussis isolates:evidence of increased circulation in Europe, 1998 to 2015[J]. Euro Surveill, 2019, 24(7). DOI:10.2807/1560-7917.ES.2019.24.7.1700832 |
| [74] |
骆鹏, 张庶民. 百日咳免疫控制研究进展[J]. 中国公共卫生, 2010, 26(5): 651-653. |
| [75] |
Craig R, Kunkel E, Crowcroft NS, et al. Asymptomatic Infection and Transmission of Pertussis in Households:A Systematic Review[J]. Clin Infect Dis, 2020, 70(1): 152-161. DOI:10.1093/cid/ciz531 |
| [76] |
Tiwari T, Murphy TV, Moran J, et al. Recommended antimicrobial agents for the treatment and postexposure prophylaxis of pertussis:2005 CDC guidelines[J]. MMWR Morb Mortal Wkly Rep, 2005, 54(RR-14): 1-16. |
 2021, Vol. 42
2021, Vol. 42