文章信息
- 王爽, 徐留臣, 裴耀文, 王梅, 毕振强, 张华宁, 刘璐, 房明, 寇增强.
- Wang Shuang, Xu Liuchen, Pei Yaowen, Wang Mei, Bi Zhenqiang, Zhang Huaning, Liu Lu, Fang Ming, Kou Zengqiang
- 农村井水中耐碳青霉烯类铜绿假单胞菌及耐药基因分子流行病学特征
- Molecular epidemiology of drug resistance genes and carbapenem resistance of Pseudomonas aeruginosa in rural well water
- 中华流行病学杂志, 2021, 42(5): 898-902
- Chinese Journal of Epidemiology, 2021, 42(5): 898-902
- http://dx.doi.org/10.3760/cma.j.cn112338-20200904-01127
-
文章历史
收稿日期: 2020-09-04
2. 山东省疾病预防控制中心办公室, 济南 250014
2. General Office, Shandong Center for Disease Control and Prevention, Ji'nan 250014, China
铜绿假单胞菌(Pseudomonas aeruginosa,PA)是医院获得性感染的重要病原体,对抗生素具有广泛的耐药性[1-2]。PA是呼吸机相关性肺炎的第二大常见病因,也是引起该病最常见的多药耐药革兰阴性菌[3]。碳青霉烯类药物是治疗多重耐药PA的主要手段,因此,对碳青霉烯类抗生素的耐药性和耐药基因的可转移性,是治疗PA感染面临的重大挑战[4]。PA对碳青霉烯类耐药性的产生,主要是由于外膜孔蛋白的改变或丢失、外排泵表达的增加和金属β-内酰胺酶的产生[5]。维罗纳整合素编码的金属β-内酰胺酶-2(VIM-2)是PA最常见的金属β-内酰胺酶,1996年在法国马赛首次被发现,VIM-2阳性PA是多次感染暴发的来源[6]。本研究针对山东省巨野县农村井水中PA的污染情况,对分离的PA进行耐药性检测、PFGE分型、S1-PFGE和Southern杂交分析,探索VIM-2在其中的传播机制,为农村井水中多重耐药PA的污染溯源和预警提供参考支持。
材料与方法1. 材料:2018年10月在山东省菏泽市巨野县6个村的农户手压井,每口井随机采集1份水样,共112份。
2. 菌株的分离和鉴定:按《饮用天然矿泉水检验方法》(GB/T 8538-2016)进行PA鉴定,在CN琼脂培养基上生长的疑似菌落生化鉴定结果阳性,采用基质辅助激光解吸/电离飞行时间质谱仪鉴定。
3. 药物敏感性试验:进行15种抗生素的敏感试验(亚胺培南、头孢噻肟、头孢他啶、头孢西丁、阿莫西林/克拉维酸、哌拉西林/他唑巴坦、庆大霉素、阿米卡星、环丙沙星、甲氧苄氨/嘧啶磺胺甲恶唑、四环素、氟苯尼考、多粘菌素、呋喃妥因和替加环素)。采用微量肉汤法检测多粘菌素和替加环素的最小抑菌浓度(minimal inhibitory concentration,MIC),其余抗生素的MIC值用琼脂稀释法检测。以美国临床和实验室标准协会(CLSI,2018)标准作为敏感性判读标准。质控菌株为PA的ATCC27853。
4. PFGE分型:PA基因组DNA以SpeⅠ酶切,沙门菌标准菌株H9812以XbaⅠ酶切。采用BioNumerics 6.6软件对PFGE指纹图谱进行图像处理和聚类分析,计算相似度。
5. 耐药基因检测[7]:采用煮沸法提取61株PA的DNA,采用多重PCR扩增碳青霉烯酶耐药基因(blaIMP、blaOXA-48、blaVIM、blaGES、blaKPC、blaNDM),采用GenBank序列和BLAST在线软件分析耐药基因亚型。
6. S1-PFGE和Southern杂交[8]:用S1-PFGE和Southern杂交验证blaVIM-2在质粒上的位置。将分离菌株包埋在10 g/L金胶中,采用S1核酸内切酶消化和PFGE。将DNA片段水平转移到尼龙膜上,并与PCR扩增获得地高辛标记的探针进行杂交。沙门菌H9812用XbaⅠ酶切后用作分子量标准。
7. 结合试验:采用大肠埃希菌J53作为受体菌检测blaVIM-2耐药基因的菌株间水平转移性。将受体菌和目标菌的单菌落分别接种到2 ml LB液体培养基中,在37 ℃恒温摇床中持续摇动培养约6.5 h,达到对数生长期。将受体菌和供体菌的生长肉汤以1∶2体积比混匀,并接种于2 ml LB液体培养基中,37 ℃培养12 h。第2天,取100 µl培养液分别均匀涂布于含亚胺培南和利福平的耐叠氮钠的琼脂平板上,37 ℃培养18 h。挑选单个菌落并纯化过夜。采用PCR检测和药敏实验检测结合菌中耐药基因和耐药性。
结果1. 菌株的检出情况和耐药性:农村井水中PA检出率为54.46%(61/112)。61株PA对四环素、氟苯尼考、头孢西丁、呋喃妥因、头孢噻肟和复方新诺明的耐药率较高,分别为98.36%(60/61)、98.36%(60/61)、98.36%(60/61)、96.72%(59/61)、95.08%(58/61)和93.44%(57/61);对哌拉西林/他唑巴坦、阿莫西林/克拉维酸、头孢他啶、多粘菌素、阿米卡星和环丙沙星的耐药率较低,均低于5.00%。多重耐药菌占93.44%(57/61)。见表 1。
2. PFGE分型结果:61株菌的图谱相似性为12.65%~100.00%,分为56个PFGE带型,出现8簇100.00%一致的PFGE带型。100.00%一致带型均只有2株菌,无明显的优势带型。提示该县农村井水中PA基因型呈多样性,没有优势的流行基因型。见图 1。

|
| 图 1 61株铜绿假单胞菌的脉冲场凝胶电泳聚类分析图 |
3. 菌株耐药基因检测:PCR和序列分析结果显示,有2株亚胺培南耐药的PA携带blaVIM-2耐药基因。未检出其他类型碳青霉烯类耐药基因。5株亚胺培南耐药的PA来自2个村,携带blaVIM-2耐药基因的PA来自同一个村。见图 1。
4. blaVIM-2基因定位和水平传递:S1-PFGE结果显示,2株菌分别有3个和1个质粒,Southern杂交结果显示,2株菌的blaVIM-2耐药基因均定位在质粒上。根据Marker(H9812)进行质粒大小判断,携带blaVIM-2耐药基因的2株菌质粒大小不一,大小分别约为78.2 kb和104.5 kb。见图 2。

|
| 注:VIM-2:维罗纳整合素编码的金属β-内酰胺酶-2 图 2 VIM-2阳性的S1-PFGE和Southern杂交 |
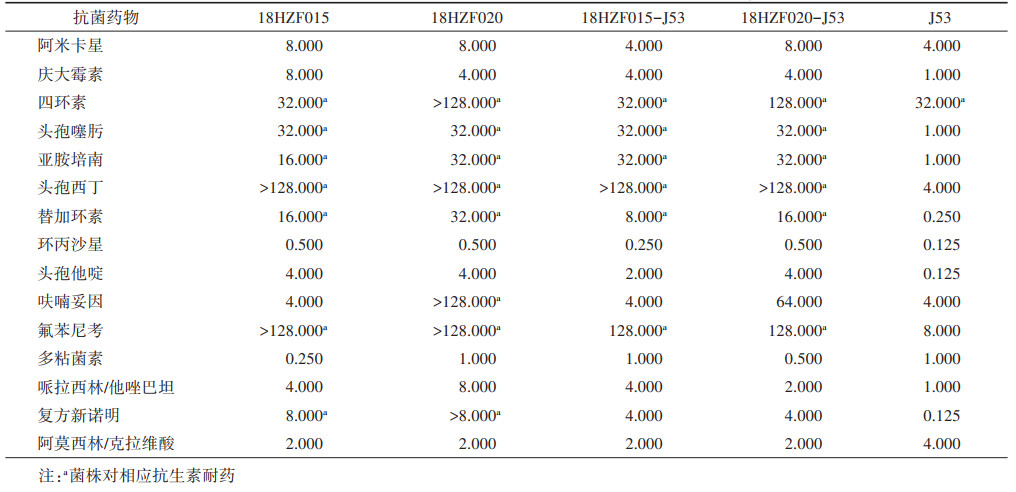
5. 结合子的药物敏感性试验:15种抗菌药物的MIC测定发现,相比于受体菌J53,亚胺培南的MIC值增加了32倍,四环素、头孢噻肟、头孢他啶、头孢西丁、替加环素和氟苯尼考的MIC值至少增加了32倍。而阿米卡星、庆大霉素、多粘菌素、环丙沙星和阿莫西林/克拉维酸的MIC值与J53相比无明显升高。见表 2。
PA对碳青霉烯类药物的耐药率正在增加,这与该类药物在治疗超广谱β-内酰胺酶耐药菌引起的感染过度使用有关[3]。耐碳青霉烯类PA可产生多种金属β-内酰胺酶,酶编码基因位于质粒等携带多种耐药基因的遗传元件上,从而赋予PA多重耐药性。此外,耐药基因在菌间可发生水平转移,使细菌耐药率增加,导致感染患者的治疗复杂化[9]。VIM-2是除NDM外最普遍的金属β-内酰胺酶,其编码基因可随质粒发生水平传播,这是此种耐药基因的主要传播机制[10-11]。本研究验证了blaVIM-2耐药基因的水平转移性,对进一步揭示该地区PA耐药性的传播机制具有重要意义。
药物敏感性结果显示,本地区井水中的PA对四环素、氟苯尼考、头孢西丁、呋喃妥因、头孢噻肟等具有较高的耐药性,且多重耐药情况非常严重。提示该社区应重视对井水的合理利用,以降低人或动物感染耐药菌的风险。2株VIM-2阳性PA均为多重耐药菌,除呋喃妥因外对其他抗菌药均表现出一致的耐药性,对亚胺培南等7种抗生素耐药,但对阿米卡星、庆大霉素、环丙沙星、头孢他啶、多粘菌素和阿莫西林/克拉维酸敏感。此外,2株VIM-2阳性结合子均表现出与供体菌相似的耐药表型,说明多种耐药基因随质粒发生了水平转移。
我国农村欠发达地区,井水与人类的日常生活(如刷牙、洗澡、蔬果清洗等)和养殖动物的饮水等活动密切相关。农村井水已经有毒性很强的耐碳青霉烯类解鸟氨酸拉乌尔菌被检出[12],这类耐药菌对食物链的污染成为潜在的公共健康危害,这可能是我国农村地区环境管理和公共卫生面临的新挑战。
综上所述,山东省巨野县农村井水中检出耐碳青霉烯类PA及其耐药基因,此类耐药基因存在水平传播的可能性。研究农村地区环境中耐碳青霉烯类PA的分子流行病学特征和耐药传播机制,对于预防和控制耐碳青霉烯类PA引起的感染至关重要。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Moradali MF, Ghods S, Rehm BHA. Pseudomonas aeruginosa lifestyle: a paradigm for adaptation, survival, and persistence[J]. Front Cell Infect Microbiol, 2017, 7: 39. DOI:10.3389/fcimb.2017.00039 |
| [2] |
Hong DJ, Bae IK, Jang IH, et al. Epidemiology and characteristics of Metallo-β-lactamase-producing Pseudomonas aeruginosa[J]. Infect Chemother, 2015, 47(2): 81-97. DOI:10.3947/ic.2015.47.2.81 |
| [3] |
Pacheco T, Bustos-Cruz RH, Abril D, et al. Pseudomonas aeruginosa coharboring BlaKPC-2 and BlaVIM-2 carbapenemase genes[J]. Antibiotics (Basel), 2019, 8(3): 98. DOI:10.3390/antibiotics8030098 |
| [4] |
Malkoçoğlu G, Aktaş E, Bayraktar B, et al. VIM-1, VIM-2, and GES-5 carbapenemases among Pseudomonas aeruginosa isolates at a tertiary hospital in Istanbul, Turkey[J]. Microb Drug Resist, 2017, 23(3): 328-334. DOI:10.1089/mdr.2016.0012 |
| [5] |
Dagher TN, Al-Bayssari C, Diene SM, et al. Emergence of plasmid-encoded VIM-2-producing Pseudomonas aeruginosa isolated from clinical samples in Lebanon[J]. New Microbes New Infect, 2019, 29: 100521. DOI:10.1016/j.nmni.2019.100521 |
| [6] |
Poirel L, Naas T, Nicolas D, et al. Characterization of VIM-2, a carbapenem-hydrolyzing metallo-β-lactamase and its plasmid-and integron-borne gene from a Pseudomonas aeruginosa clinical isolate in France[J]. Antimicrob Agents Chemother, 2000, 44(4): 891-897. DOI:10.1128/aac.44.4.891-897.2000 |
| [7] |
Monteiro J, Widen RH, Pignatari AC, et al. Rapid detection of carbapenemase genes by multiplex real-time PCR[J]. J Antimicrob Chemother, 2012, 67(4): 906-909. DOI:10.1093/jac/dkr563 |
| [8] |
Wang S, Xu LC, Chi XH, et al. Emergence of NDM-1-and CTX-M-3-producing Raoultella ornithinolytica in human gut Microbiota[J]. Front Microbiol, 2019, 10: 2678. DOI:10.3389/fmicb.2019.02678 |
| [9] |
Karampatakis T, Antachopoulos C, Tsakris A, et al. Molecular epidemiology of carbapenem-resistant Pseudomonas aeruginosa in an endemic area: comparison with global data[J]. Eur J Clin Microbiol Infect Dis, 2018, 37(7): 1211-1220. DOI:10.1007/s10096-018-3244-4 |
| [10] |
Paul D, Dhar D, Maurya AP, et al. Occurrence of co-existing blaVIM-2 and blaNDM-1 in clinical isolates of Pseudomonas aeruginosa from India[J]. Ann Clin Microbiol Antimicrob, 2016, 15: 13. DOI:10.1186/s12941-016-0146-0 |
| [11] |
Yu YS, Qu TT, Zhou JY, et al. Integrons containing the VIM-2 metallo-β-lactamase gene among imipenem-resistant Pseudomonas aeruginosa strains from different Chinese hospitals[J]. J Clin Microbiol, 2006, 44(11): 4242-4245. DOI:10.1128/JCM.01558-06 |
| [12] |
Zou HY, Berglund B, Xu H, et al. Genetic characterization and virulence of a carbapenem-resistant Raoultella ornithinolytica isolated from well water carrying a novel megaplasmid containing blaNDM-1[J]. Environ Pollut, 2020, 260: 114041. DOI:10.1016/j.envpol.2020.114041 |
 2021, Vol. 42
2021, Vol. 42