文章信息
- 蒋力云, 刘远, 苏文哲, 罗雷, 曹毅敏, 刘文辉, 狄飚, 张周斌.
- Jiang Liyun, Liu Yuan, Su Wenzhe, Luo Lei, Cao Yimin, Liu Wenhui, Di Biao, Zhang Zhoubin
- 广州市2019年登革热确诊病例空间聚集性及登革病毒E基因进化特征分析
- Spatial autocorrelation of dengue cases and molecular biological characteristics of envelope gene of dengue virus in Guangzhou, 2019
- 中华流行病学杂志, 2021, 42(5): 878-885
- Chinese Journal of Epidemiology, 2021, 42(5): 878-885
- http://dx.doi.org/10.3760/cma.j.cn112338-20201015-01238
-
文章历史
收稿日期: 2020-10-15
登革热是由登革病毒(DENV)引起的,主要流行于热带和亚热带地区的虫媒传染病。2019年初,WHO将登革热列为10种对人类有潜在威胁性的疾病,同年在一些美洲国家的暴发证实了这一预测[1]。DENV的RNA编码3个结构蛋白(核蛋白、膜蛋白和包膜蛋白)和7个非结构蛋白。其中,根据包膜蛋白抗原性的不同,DENV被分为血清型1~4型。同时,包膜蛋白对于DENV感染有非常重要的作用。一方面,病毒通过包膜蛋白与宿主细胞结合进入细胞;另一方面,宿主细胞产生的中和抗体与包膜蛋白结合,阻止病毒进入细胞。因此,通过分析包膜蛋白基因(E基因),对探讨DENV传播和流行具有一定意义。广州市气候炎热、人口密度大,加之城市化进程加速,为登革热的暴发提供了条件。近年监测发现,DENV血清型1~4型在广州市均有出现,并以DENV血清型1型为优势毒株[2]。2019年,广州市登革热发生暴发和流行,并于8月9日启动登革热疫情防控三级应急响应。为深入了解登革热在广州市的流行情况,以及潜在扩散和暴发风险,通过分析2019年登革热确诊病例的空间聚集性和DENV的E基因进化,评估DENV 4种血清型对流行的影响。
对象与方法1. 研究对象:登革热确诊病例信息来源于中国疾病预防控制信息系统传染病报告信息管理系统。所有确诊病例均按照《登革热诊断标准》(WS 216- 2018)诊断[3]。病例血清标本由广州市各医院及区CDC送检。
2. 登革热确诊病例空间自相关性和聚集性分析:将广州市按照行政区域划分为178个街道,使用ArcGIS 10.2软件计算全局Moran's I指数,并进行局部自相关分析(LISA),绘制LISA聚集图。全局Moran's I值范围为-1~1,反映邻近空间区域某一单元属性值的相似程度。全局Moran's I > 0表示该值与空间正相关,越接近于1,表示空间相关性越密切;Moran's I < 0表示该值与空间负相关,越接近于-1,表示空间差异越大;当Moran's I=0,表示该值在空间上呈随机性。LISA反映某一区域与相邻区域的相关程度,分为高-高聚集性(high-high cluster)、高-低聚集性(high-low cluster)、低-低聚集性(low-low cluster)、低-高聚集性(low-high cluster)4种相关程度。
3. 血清标本的荧光定量PCR核酸检测:将确诊病例血清标本用病毒核酸提取试剂(磁珠法)(江苏硕士生物科技有限公司)提取核酸,DENV通用/1型/2型/3型/4型核酸检测试剂盒(荧光PCR法)(江苏硕士生物科技有限公司)进行核酸检测,实验步骤和反应条件参见试剂说明书。
4. 病毒分离:C6/36细胞在28 ℃ CO2培养箱中培养至单层,将荧光定量PCR结果为阳性的血清标本按照1∶20、1∶30、1∶40、1∶50的梯度稀释,取100 μl稀释血清接种到单层细胞,吸附1 h后,弃上清,加入含2%小牛血清的1640培养基(美国Gibco),置28 ℃ CO2培养箱中培养。每日观察细胞病变情况,如连续7 d无细胞病变则判断为阴性,盲传3代仍无细胞病变则判断为未分离到毒株。分离到的毒株置-80 ℃低温冰箱保存,待下一步实验使用。
5. 序列测定及进化分析:将毒株提取核酸后,按照文献[4]中的引物、试剂和步骤扩增DENV的E基因,产物送上海英潍捷基公司测序。将分离毒株的E基因序列全部上传至GenBank,并从GenBank中下载参考序列,使用PhyML 3.1软件构建最大相似度的基因树[5]。DENV 4种血清型中的基因型分类参考Rico-Hesse的分类标准[6]。
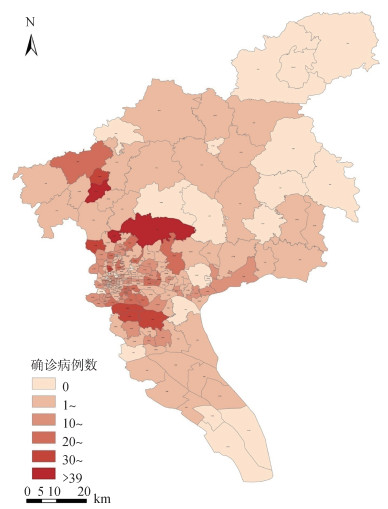
结果1. 基本情况:2019年广州市共报告登革热确诊病例1 655例,发病率11.10/10万,其中本地病例1 382例,输入病例273例。与2001-2019年相比,2019年的发病率和发病人数处于较高水平,仅次于2014年大流行。2019年广州市登革热疫情波及全市11个区,确诊病例数最高为白云区356例,占总确诊数的21.51%,天河区220例,占13.29%,海珠区196例,占11.84%。在178个街道中,154个街道报告发现登革热确诊病例,占86.52%,确诊病例数街道分布统计见图 1。确诊病例数较高的街道为花都区新华街(50例),白云区太和镇(42例)和嘉禾街(41例),番禺区洛浦街(38例)和南村街(38例),越秀区矿泉街(34例),花都区花城街(34例)等。输入病例来源国家以东南亚国家(86.08%,235/273)为主,其次为非洲国家(2.56%,7/273)。柬埔寨输入病例162例,占总输入病例数的59.34%,是输入病例最多的来源国家。
|
| 图 1 2019年广州市登革热确诊病例数按街道统计分布模拟图 |
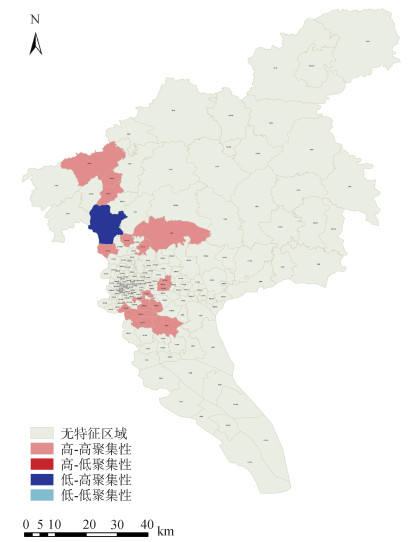
2. 空间自相关性和聚集性分析:2019年,全局Moran's I为0.029(Z=2.617,P=0.009),呈全局空间正相关关系,说明广州市登革热确诊病例具有空间聚集性。以街道为单位绘制LISA聚集图(图 2),共发现18个高-高聚集性街道,分布于广州市北部的白云区和花都区,南部的番禺区以及中部的天河区、海珠区和荔湾区。
|
| 图 2 2019年广州市登革热确诊病例局部自相关性空间聚集模拟图 |
3. 确诊病例血清标本核酸检测结果:荧光定量PCR检测确诊病例血清标本749例,阳性697例,阳性率93.06%。其中,DENV血清型1~4型分别为557、82、43和1例,分别占确诊病例标本总检测数的74.37%、10.95%、5.74%和0.13%,另有14例(1.87%)无法确定型别。DENV1在各区均有检出,阳性数量最多的是白云区(160例)、天河区(106例)和越秀区(88例);DENV2的检出数量和流行范围次于DENV1,仅在南沙区和增城区未检测到,阳性数量最多的是白云区(57例)、荔湾区(12例)和越秀区(5例);DENV3主要分布于荔湾区(18例)、白云区(10例)和海珠区(9例);DENV4仅出现在番禺区(1例)。
广州市18个高-高聚集性街道病例数、荧光PCR分型检测结果及病毒分离情况见表 1。在高-高聚集性街道中,以DENV1流行为主,DENV2和DENV3主要在白云区的街道中被检出和分离,DENV4在高-高聚集性街道中无检出和分离。
4. DENV分离及E基因分析:2019年共计分离毒株464株,包含403株DENV1(86.85%),38株DENV2(8.19%),22株DENV3(4.74%),1株DENV4(0.22%)。所有分离毒株均测序,并将序列上传至GenBank。在E基因进化树中,所有分离毒株均以GenBank序列编号和实验室标号表示。
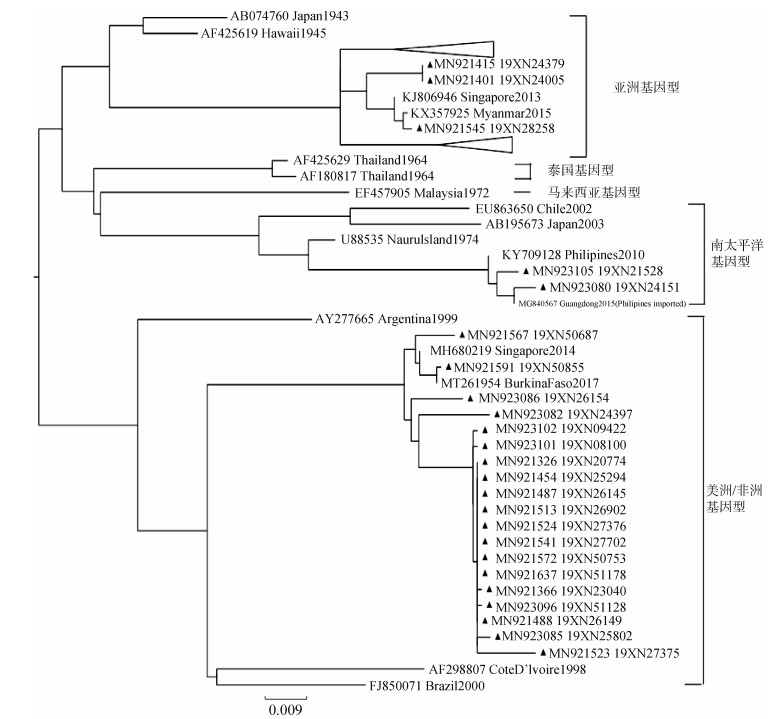
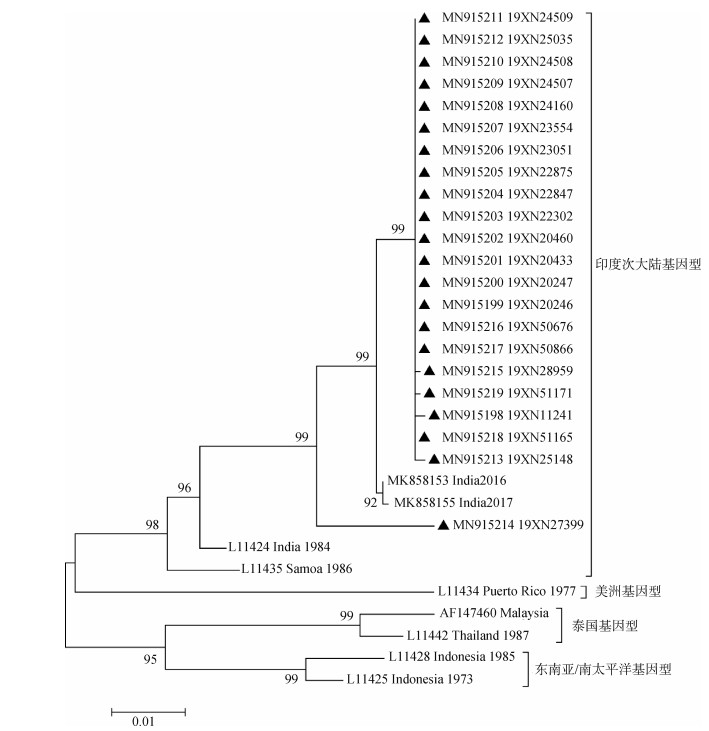
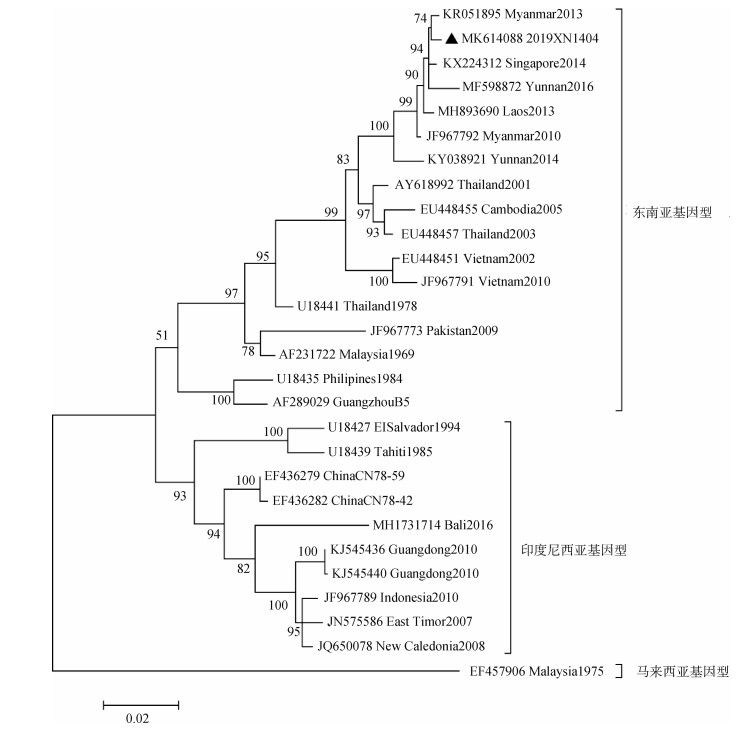
在GenBank进行序列比对发现,我国广州市分离到的DENV1、DENV2和DENV4与东南亚国家毒株基因相似率最高,DENV3与印度分离毒株基因相似率最高。DENV1的E基因进化树(图 3)由于序列较多,将完全由广州市分离毒株序列组成的归属于亚洲基因型的2条分支缩小,缩小的分支共包含379条序列。2019年DENV1归属于亚洲基因型、美洲/非洲基因型和南太平洋基因型,其中亚洲基因型是优势基因型,未分离到泰国基因型和马来西亚基因型。DENV2的E基因进化树(图 4)显示,分离毒株以马来西亚/印度次大陆基因型为主,仅2株为东南亚基因型,无美洲基因型和西非基因型流行。在DENV3的E基因进化树(图 5)中,所有分离毒株均归属于印度次大陆基因型,无美洲基因型、泰国基因型和东南亚/南太平洋基因型。2019年唯一的DENV4属于东南亚基因型(图 6),相关流行病学资料显示,该毒株分离自缅甸输入病例。
|
注:▲广州市分离毒株; 缩小的2条分支
图 3 2019年广州市登革病毒血清型1型E基因进化树 缩小的2条分支
图 3 2019年广州市登革病毒血清型1型E基因进化树
|

|
| 注:▲广州市分离毒株 图 4 2019年广州市登革病毒血清型2型E基因进化树 |
|
| 注:▲广州市分离毒株 图 5 2019年广州市登革病毒血清型3型E基因进化树 |
|
| 注:▲广州市分离毒株 图 6 2019年广州市登革病毒血清型4型E基因进化树 |
2019年广州市登革热发病率较往年偏高,疫情波及全市86.52%的街道,相较于往年[7-8],流行范围扩大,高发病数地区(图 1)逐步从人口密集的中心向周边城乡接合部转移。全局Moran's I显示,登革热在广州市的发病呈聚集性,高-高聚集性街道(图 2)主要分布于广州市北部的白云区和花都区,南部的番禺区以及中部的天河区、海珠区和荔湾区。而往年发病数较高的越秀区却没有高-高聚集性街道分布[9]。预示广州市登革热从中心城市居民区向城乡接合部扩散和转移的趋势。由于广州市城市化进程加速,城乡接合部聚集大量流动人口,人口密度大,环境卫生条件差,蚊媒密度大[10],为登革热的传播和流行提供了理想条件。在制订防控和监测措施时,应进一步重视和加强对城乡接合部的管理力度,以防登革热在这些地区暴发。
东南亚国家仍然是我国广州市登革热输入病例的主要输入来源[2, 11]。同时,通过在GenBank中的序列比对以及对E基因进化树分析发现,广州市分离的DENV1、DENV2和DENV4与东南亚国家的毒株有较高同源性,印证了广州市登革热与东南亚国家的密切关系。同时,与往年相比,从非洲国家输入的病例数出现上升趋势[12]。2019年从非洲国家输入登革热病例7例,占总输入病例数的2.56%。在WHO全球登革热统计数据中,一直缺乏非洲国家登革热监测数据,但这并不能说明非洲不存在登革热流行。相反,该地区适宜的气候和蚊媒,再加之落后的医疗条件和恶劣的卫生环境,登革热很可能长期流行。广州市与非洲国家对外贸易交流频繁。2010-2014年,广州市空港口岸仅通过红外线监测,就从非洲直航航班入境人员中发现登革热病例13例[13]。在2019年DENV1的E基因进化树(图 3)中,有一部分DENV1归属于美洲/非洲基因型。这提示,非洲国家正逐步成为广州市登革热不可忽视的输入源。因此,出入境口岸、商务外事和疾病预防控制机构应该形成多部门联防联控体系,加强对非洲入境人员的传染病监测工作,保障国内人民健康。
从确诊病例血清核酸检测结果、DENV分离情况以及高-高聚集性街道4种血清型毒株检测情况看(表 1),DENV1是广州市流行的优势血清型,并最有可能引起聚集性暴发。同时,将4种血清型的基因树同往年的基因树相比,未发现基因型的转换[2, 14-15],也未发现E基因进化与确诊病例空间聚集性存在关联。分析确诊病例荧光PCR检测结果发现,DENV2主要集中在白云区和荔湾区。同时结合18个高-高聚集性街道DENV的分离情况(表 1),在白云区新市街,DENV2无论是从确诊病例数还是分离毒株数均高于DENV1。不仅如此,白云区4个高-高聚集性街道均分离到DENV2毒株。提示,DENV2在白云区的流行情况不容忽视,甚至有引起聚集性暴发的风险。DENV3和DENV2相似,主要分布在白云区和荔湾区,但在高-高聚集性街道的检出率和分离率都不高,说明DENV3引发聚集性暴发的风险较DENV2低。
2019年DENV 4种血清型在广州市同时出现,造成人群二次感染不同血清型DENV风险增加。由于DENV存在抗体依赖增强效应,可能导致登革出血热或者登革休克综合征患者数量和比例增加,广州市登革热流行形势更加严峻。
综上所述,2019年广州市登革热疫情累及全市,范围向城乡接合部扩大和转移,应进一步重视城乡接合部的防控工作。加强来自东南亚和非洲国家的国境检疫。DENV血清型2型的流行和聚集性暴发风险不容忽视。多种血清型在广州市同时出现,提示广州市需预防重症登革热的暴发和流行。加强登革热病例和毒株的网络监测,及时处理登革热暴发,做好蚊媒消杀工作,预防登革热特别是重症登革热的暴发和流行。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
WHO. Dengue and severe dengue[EB/OL]. (2020-01-01)[2020-09-30]. https://www.who.int/health-topics/dengue-and-severe-dengue#tab=tab_1.
|
| [2] |
Jiang LY, Wu XW, Wu YJ, et al. Molecular epidemiological and virological study of dengue virus infections in Guangzhou, China, during 2001-2010[J]. Virol J, 2013, 10: 4. DOI:10.1186/1743-422X-10-4 |
| [3] |
国家卫生健康委员会. 登革热诊断标准WS 216-2018)[EB/OL]. (2018-03-06)[2020-09-01]. http://www.nhc.gov.cn/ewebeditor/uploadfile/2018/03/20180330092855998.pdf. National Health Commission. Diagnosis standard for dengue fever (WS216-2018)[EB/OL]. (2018-03-06)[2020-09-01]. http://www.nhc.gov.cn/ewebeditor/uploadfile/2018/03/20180330092855998.pdf. |
| [4] |
蒋力云, 曹毅敏, 许杨, 等. 广州市2011年登革病毒流行状况及E基因进化特征分析[J]. 中华流行病学杂志, 2012, 33(12): 1273-1275. Jiang LY, Cao YM, Xu Y, et al. Epidemiological situation and the E gene evolution of dengue virus in Guangzhou, 2011[J]. Chin J Epidemiol, 2012, 33(12): 1273-1275. DOI:10.3760/cma.j.issn.0254-6450.2012.12.017 |
| [5] |
Guindon S, Dufayard J, Lefort V, et al. New algorithms and methods to estimate maximum-likelihood phylogenies: assessing the performance of PhyML 3.0[J]. SystBiol, 2010, 59(3): 307-321. DOI:10.1093/sysbio/syq010 |
| [6] |
Rico-Hesse R. Microevolution and virulence of dengue viruses[J]. Adv Virus Res, 2003, 59: 315-341. DOI:10.1016/s0065-3527(03)59009-1 |
| [7] |
罗雷, 杨智聪, 王玉林, 等. 广州市1978至2006年登革热流行病学特征分析[J]. 中华传染病杂志, 2008, 26(8): 490-493. Luo L, Yang ZC, Wang YL, et al. The analysis of the epidemiologic features of dengue fever from 1978 to 2006 in Guangzhou, China[J]. Chin J Infect Dis, 2008, 26(8): 490-493. |
| [8] |
宋韶芳, 罗雷, 景钦隆, 等. 广州市2001-2010年登革热流行病学分析[J]. 热带医学杂志, 2012, 12(2): 214-216. Song SF, Luo L, Jing QL, et al. Epidemiological analysis of dengue fever in Guangzhou, 2001-2010[J]. J Trop Med, 2012, 12(2): 214-216. |
| [9] |
陆剑云, 陈宗遒, 马蒙蒙, 等. 2008-2017年广州市登革热疫情流行趋势[J]. 热带医学杂志, 2018, 18(7): 973-976, 985. Lu JY, Chen ZQ, Ma MM, et al. Epidemic trend of dengue fever in Guangzhou city from 2008 to 2017[J]. J Trop Med, 2018, 18(7): 973-976, 985. DOI:10.3969/j.issn.1672-3619.2018.07.031 |
| [10] |
严子锵, 胡志刚, 江毅民, 等. 广州地区白纹伊蚊自然种群幼虫密度指数变动及其影响因素[J]. 热带医学杂志, 2010, 10(5): 606-608. Yan ZQ, Hu ZG, Jiang YM, et al. Factors affecting the larva density index of Aedesalbopictus in Guangzhou[J]. J Trop Med, 2010, 10(5): 606-608. |
| [11] |
牟笛, 崔金朝, 殷文武, 等. 2015-2018年我国登革热暴发流行病学特征分析[J]. 中华流行病学杂志, 2020, 41(5): 685-689. Mu D, Cui JC, Yin WW, et al. Epidemiological characteristics of dengue fever outbreaks in China, 2015-2018[J]. Chin J Epidemiol, 2020, 41(5): 685-689. DOI:10.3760/cma.j.cn112338-20190715-00523 |
| [12] |
景钦隆, 张兢文, 李意兰, 等. 广州市2001-2010年输入性登革热监测与流行特征研究[J]. 热带医学杂志, 2013, 13(12): 1509-1512, 1556. Jing QL, Zhang JW, Li YL, et al. Epidemiology of imported dengue fever in Guangzhou from 2001 to 2010[J]. J Trop Med, 2013, 13(12): 1509-1512, 1556. |
| [13] |
戴俊, 张显光, 洪烨, 等. 广州空港口岸非洲航班传染病输入风险研究[J]. 中国国境卫生检疫杂志, 2015, 38(5): 342-347, 351. Dai J, Zhang XG, Hong Y, et al. The risk research of imported infectious diseases carried by Africa-China direct flights at Guangzhou airport[J]. Chin J Front Health Quar, 2015, 38(5): 342-347, 351. DOI:10.16408/j.1004-9770.2015.04.013 |
| [14] |
Jiang LY, Jing QL, Liu Y, et al. Molecular characterization and genotype shift of dengue virus strains between 2001 and 2014 in Guangzhou[J]. Epidemiol Infect, 2017, 145(4): 760-765. DOI:10.1017/S0950268816002429 |
| [15] |
刘远, 蒋力云, 罗雷, 等. 广州市2001-2015年登革病毒2型E基因进化分析[J]. 中华流行病学杂志, 2017, 38(1): 90-95. Liu Y, Jiang LY, Luo L, et al. Phylogenetic analysis of envelope gene of dengue virus serotype 2 in Guangzhou, 2001-2015[J]. Chin J Epidemiol, 2017, 38(1): 90-95. DOI:10.3760/cma.j.issn.0254-6450.2017.01.018 |
 2021, Vol. 42
2021, Vol. 42



