文章信息
- 赵甜静, 杨志清, 李雁笛, 扆琳珠, 丰淑英, 汪波, 冯永亮, 王素萍.
- Zhao Tianjing, Yang Zhiqing, Li Yandi, Yi Linzhu, Feng Shuying, Wang Bo, Feng Yongliang, Wang Suping
- C基因型HBV变异与宫内传播的关系
- Relationship between C genotype HBV mutation and intrauterine transmission
- 中华流行病学杂志, 2021, 42(4): 716-722
- Chinese Journal of Epidemiology, 2021, 42(4): 716-722
- http://dx.doi.org/10.3760/cma.j.cn112338-20200915-01163
-
文章历史
收稿日期: 2020-09-15
2. 太原市第三人民医院妇产科 030001
2. Department of Obstetrics and Gynaecology, the Third People's Hospital of Taiyuan City, Taiyuan 030001, China
HBV感染是全球重大的公共卫生问题,我国有超过9 000万慢性乙型肝炎(乙肝)感染者,育龄期女性HBsAg阳性率约6%[1-2],母婴传播仍是我国众多HBV慢性感染者积累的主要原因,占新发HBV感染的40%~50%[3-4]。携带HBV母亲的新生儿出生后接受主/被动免疫,可有效阻断产时传播和产后传播,但对已发生的宫内传播无阻断作用,发生宫内传播的新生儿90%将转为慢性感染[5]。近年来,研究显示HBV的基因型、基因组结构与宫内传播密切相关,我国主要流行B和C基因型HBV毒株,占HBV感染的90%以上,C基因型在我国北方占主导地位,B基因型在我国南方更常见[6-7],与B基因型相比,C基因型有更高的HBV DNA载量和基因突变率,C基因型基因组变异与母婴传播的关系可能更为密切[8-9]。HBV基因组在长期的体液免疫或细胞免疫压力下,核酸碱基的点突变(置换、插入和缺失)逐年增加[10],以往研究显示,PreS/S突变率低的HBV株可能更容易引起新生儿宫内传播[11];PreC中的G1896A突变和核心启动子(BCP)的A1762T/G1764A突变是宫内传播的保护因素[12-13];X区的缺失突变可通过减少HBsAg、HBcAg和HBeAg的表达,影响宫内传播的发生[14]。这些研究多侧重于HBV基因组单一区域突变对宫内传播的影响,而HBV全基因组突变与宫内传播的关系研究较少。因此,本研究从携带C基因型HBV的母亲病毒基因组变异入手,进一步探讨与宫内传播可能有关的基因突变区,为HBV宫内传播机制的研究提供新思路。
对象与方法1. 研究对象与标本收集:选取2011-2013年在太原市第三人民医院产科住院的399对携带HBV的母亲及其新生儿。本研究经山西医科大学伦理委员会批准,所有研究对象均签署知情同意书。通过问卷调查和病历查阅获得母亲及其新生儿基本情况,收集母亲分娩前肘静脉血和新生儿出生后24 h内、主/被动免疫前股静脉血,及时分装血清并储存在-80 ℃备检,股静脉血HBsAg和/或HBV DNA阳性者判定为HBV宫内传播[15-17]。按克隆测序要求,母亲HBV DNA载量须≥106IU/ml,在54例发生HBV宫内传播者中,满足克隆测序要求的22对母亲及其新生儿作为宫内传播组;以随机种子方法选择同等数量未发生宫内传播的母亲及其新生儿为对照组,经PCR扩增HBV DNA、基因克隆、测序,对42例携带C基因型HBV母亲的406条克隆株进行基因变异分析。
2. 血清中HBsAg、HBeAg标志物及HBV DNA检测:使用德国罗氏诊断有限公司生产的试剂盒,采用电化学发光法测定血清HBsAg和HBeAg,HBsAg≥1.00 COI(cut off index,临界值指数)、HBeAg≥1.00 COI为阳性。使用中国湖南圣湘生物科技有限公司生产的试剂盒,采用荧光定量PCR定量测定血清HBV DNA,HBV DNA≥200 IU/ml为阳性[18-19]。所有操作严格按照试剂盒说明书进行。
3. HBV DNA的提取和纯化:使用德国Qiagen公司生产的QIAamp DNA提取试剂盒,提取血清HBV DNA(按说明书操作)。
4. PCR扩增及测序引物:由于HBV DNA全长3.2 kb,为保证实验结果的稳定性,对HBV DNA分两个片段进行扩增后拼接为全长获得HBV DNA全基因组序列,片段1采用HBV-DF/DR引物(DF:5'-GTC TGC GGC GTT TTA TC-3',DR:5'-AAG TTG CAT GGT GCT GGT GA-3')进行扩增,产物大小为1 442 bp,片段2采用HBV-SF/SR引物(SF:5'-TCA CCT CTG CCT AAT CAT CTC ATG-3',SR:5'-GCA AAG CCC AAA AGA CCC ACA AT-3')进行扩增,产物大小为2 410 bp。PCR反应体系为50 μl,主要包括血清病毒DNA 3 μl、Pfu DNA聚合酶1 μl、5×TransStart® FastPfu缓冲液10 μl、dNTP 4 μl、ddH2O 30 μl、正反向引物各1 μl。PCR扩增条件:94 ℃变性5 min;94 ℃ 30 s,55 ℃ 30 s,68 ℃ 80 s(单链)或110 s(双链),35个循环;68 ℃延伸10 min。引物由生工生物工程(上海)股份有限公司设计、合成。
5. 克隆和测序:PCR产物经凝胶电泳分离回收,将HBV DNA片段连接到pEASY-Blunt Zero Cloning载体,转入Trans1-T1噬菌体抗性化学感受态细胞(北京TransGen生物技术有限公司)进行培养,培养液送生工生物工程(上海)股份有限公司测序。
6. 基因型确定及突变分析:所得HBV序列需经过整理(BioEdit软件)、编辑(DNAStar软件)、拼接(SeqMan软件)、位置调整(Mega 6.0软件),调整后的序列采用Mega 6.0软件与HBV A~H型标准序列进行对比,采用邻接(Neighbor-joining)法构建系统发育树(Kimura双参数模型,1 000次验证),通过与NCBI数据库下载的标准序列比对进行基因分型。HBV各基因型标准序列编号:A:AF090842、X02763、X51970;B:D00329、AB073846、AB602818;C:AB014381、M12906、X04615;D:M32138、X65259、X85254;E:X75657、AB032431;F:AB036910、AF223965、X69798;G:AF405706、AB064310、AF160501;H:AY090454、AY090457、AY090460。从NCBI下载HBV野生型参考序列并校正(ClustalX2.1程序、MegAlign软件),与参考序列相比,样本序列中核苷酸(位点)改变即为点突变。
7. 统计学分析:采用SAS 9.4软件进行统计学分析,计量资料用M(QR)进行统计描述,计数资料用率描述,Wilcoxon秩和检验和χ2检验进行组间差异分析,以P < 0.05为差异有统计学意义。
结果1. 新生儿HBV宫内传播率及母亲HBV基因型:共收集399对携带HBV的母亲及其新生儿,新生儿股静脉血HBsAg阳性54例,HBsAg和HBV DNA同时阳性6例,HBV宫内传播率为13.53%(54/399)。
新生儿HBV宫内传播者中,22例母亲外周血HBV DNA载量满足克隆测序要求(HBV DNA≥106IU/ml),未发生HBV宫内传播345例,母亲外周血中HBV DNA≥106IU/ml共91例,以随机种子方法选择同等数量22例,对44例携带HBV的母亲进行HBV DNA扩增克隆测序。
HBV基因型分析结果显示:44例样本中39例(88.63%,39/44)为C基因型,其余2例为B基因型,3例为B与C混合型。选择携带C基因型HBV的42例母亲,宫内传播组和对照组各21例,共406条C基因型HBV基因组变异分析,其中宫内传播组204条,对照组202条。
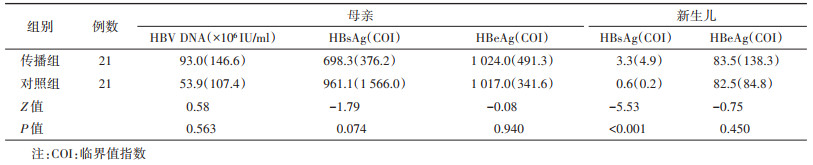
2. C基因型携带HBV的母亲及新生儿一般情况:宫内传播组携带HBV母亲年龄为21.1~32.1岁,孕周为37.0~41.0周,新生儿中有9名男孩,12名女孩,新生儿身长为47.0~52.0 cm,体重为2.5~4.3 kg;对照组携带HBV母亲年龄为20.1~35.8岁,孕周为38.0~41.0周,新生儿中有11名男孩,10名女孩,新生儿身长为47.0~53.0 cm,体重为2.8~4.0 kg。宫内传播组与对照组母亲及其新生儿一般人口学特征比较结果显示,母亲年龄及孕周,新生儿性别、出生身长及出生体重在两组间差异无统计学意义(P > 0.05)。见表 1。
3. 携带C基因型HBV的母亲及新生儿HBV复制与感染情况:42例携带HBV的母亲均为HBeAg阳性,HBV宫内传播组母亲HBV DNA > 108IU/ml共9例、107IU/ml < HBV DNA≤108IU/ml共10例、106IU/ml < HBV DNA≤107IU/ml共2例;对照组母亲HBV DNA > 108IU/ml共6例、107IU/ml < HBV DNA≤108IU/ml共13例,106IU/ml < HBV DNA≤107IU/ml共2例。携带HBV的母亲血清HBsAg、HBeAg水平及HBV DNA载量在HBV宫内传播组与对照组间差异无统计学意义(P > 0.05)。HBV宫内传播组新生儿HBV DNA > 108IU/ml 1例、105IU/ml < HBV DNA≤108IU/ml 1例、103IU/ml < HBV DNA≤105IU/ml 4例,余15例均为阴性;对照组21例新生儿HBV DNA均为阴性。新生儿HBeAg水平在HBV宫内传播组与对照组间差异无统计学意义(P > 0.05),宫内传播组新生儿HBsAg水平高于对照组,差异有统计学意义(P < 0.05)。见表 2。
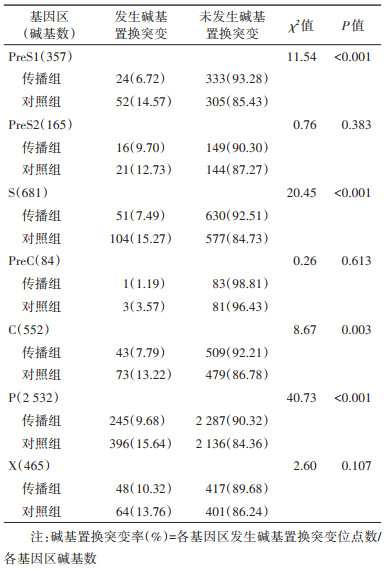
4. 携带C基因型HBV的母亲病毒基因组碱基置换突变及与HBV宫内传播的关系:C基因型HBV基因组PreS1、S、C及P区碱基置换突变与HBV宫内传播有关联。HBV DNA基因组全长有3 215 bp,HBV宫内传播组共305 bp发生置换突变,突变率为9.49%(305/3 215);对照组共491 bp发生置换突变,突变率为15.27%(491/3 215),HBV宫内传播组碱基置换突变率低于对照组,差异有统计学意义(χ2=49.60,P < 0.001)。进一步比较两组间HBV基因组不同区碱基置换突变情况,HBV宫内传播组PreS1、S、C、P区碱基置换突变率明显低于对照组(P < 0.05)。说明碱基置换突变率较低者在HBV宫内传播中风险更大。见表 3。
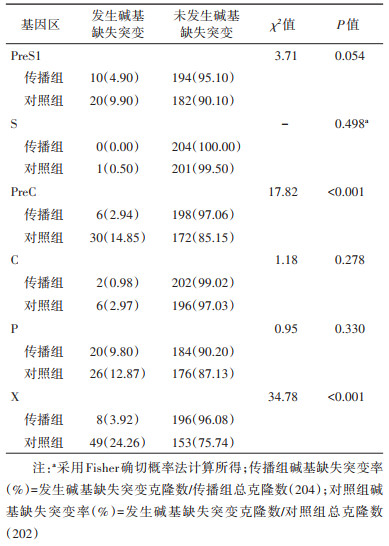
5. 携带C基因型HBV的母亲病毒基因组碱基插入、缺失突变及与HBV宫内传播的关系:C基因型HBV基因组PreC、X区碱基缺失突变率和X区碱基插入突变与HBV宫内传播有关联。PreS1区缺失起始位点大多数位于nt2848~2850内,缺失长度介于12~21 bp之间,其余还包括传播组起始于nt3047长度达39 bp及对照组起始于nt3016长度达183 bp的缺失突变;S区仅有对照组长度为3 bp的缺失突变;PreC区缺失起始位点位于nt1815~1834内,均为1~4 bp的小片段缺失;C区传播组有长度达168 bp的缺失突变;P区缺失起始位点位于nt381~1019内,有1~5 bp的小片段缺失,起始位点nt2847~2850有12~21 bp的缺失,其余还包括传播组起始于nt3047长度达39 bp及对照组起始于nt3016长度达183 bp的缺失突变;X区是起始位点位于nt1808~1834内1~4 bp的小片段缺失突变和nt1754~1768内8 bp、18 bp或20 bp的缺失突变,其中PreC和X区宫内传播组碱基缺失突变率低于对照组,两组间差异有统计学意义(P < 0.05)。提示C基因型HBV基因组除PreS2区外,其他各区均有碱基缺失突变发生,以PreS1、PreC和X区多见,C和P区较少,PreS2相对保守。见表 4。HBV基因组X区nt1644~1645和nt1649~1650分别存在31 bp和27 bp的插入突变,且均发生于对照组。
6. 携带C基因型HBV的母亲病毒基因组PreC、X区缺失突变与母亲血清HBeAg水平及HBV DNA载量的关系:PreC区发生缺失突变的母亲血清HBeAg水平低于未发生突变的母亲血清HBeAg水平(1 005.0 COI vs.1 024.0 COI,P=0.647);X区发生缺失突变的母亲血清HBV DNA载量低于未发生突变的母亲血清HBV DNA载量(5.4×107 IU/ml vs.6.6×107 IU/ml,P=0.573),未发现两组间差异有统计学意义。
讨论HBV可根据其全基因序列差异≥8%的标准将其划分为A~J 10种基因型,其分布存在一定的地理和种族差异,且不同基因型基因组长度不完全一致[20]。例如,A和D基因型HBV基因组分别为3 221和3 182 nt,在欧洲、北美和中东地区常见。B和C基因型HBV基因组长度相同,均为3 215 nt,主要分布在亚洲地区。研究发现,我国主要流行的是B和C基因型HBV毒株,占HBV感染的90%以上,C基因型在我国北方占主导地位,B基因型在我国南方更常见[6-7]。本研究中,携带HBV的母亲主要为C基因型,符合我国北方以C基因型为主的特征,与文献报道一致[21]。
携带C基因型HBV的母亲病毒基因组S、C、P及X区碱基置换突变与HBV宫内传播有关。HBV DNA基因组小、复制能力高,由其mRNA反转录而来,且反转录酶缺乏校正读码功能,因此,HBV在复制或反转录过程中有很高的核苷酸错配率[22]。在HBV DNA 4个开放阅读框(open reading frame)中,S区与HBV免疫应答密切相关,可进一步分为前S1(PreS1)、前S2(PreS2)和S区,其中,S编码的HBsAg有联合免疫的作用表位,前S与HBV黏附入胞作用密切相关,可以影响病毒复制,使宿主体内HBV DNA水平改变[9]。本研究对照组中全S区多个位点的突变,可能通过影响HBV外膜蛋白的合成与分泌,进而影响病毒与细胞的结合及宿主体内的免疫应答,使其发生宫内传播的概率下降。前C(PreC)/C区突变主要影响病毒在宿主体内的复制能力[23],PreC中的G1896A突变和核心启动子(BCP)的A1762T/G1764A突变是宫内传播的保护因素[12-13]。课题组前期研究显示HBsAg阳性母亲血清HBeAg与HBV宫内传播密切相关[24],HBV C基因型的HBsAg阳性母亲HBV DNA BCP区A1762T/G1764A双突变可能降低HBV宫内传播的风险[25],本研究中对照组全C区碱基置换突变率高,可能阻止了HBeAg的表达,降低了宫内传播的危险性。目前,P区是HBV DNA聚合酶的编码区,其位点突变可产生HBV DNA聚合酶变异株,影响HBV DNA正常复制,降低宫内传播的发生风险。X区点突变与较低水平的HBV cccDNA和总DNA相关[26]。对照组中X区多bp置换突变位点,可能通过降低HBV复制水平,影响宫内传播的发生。
PreC区的缺失突变、X区的插入和缺失突变可能降低了宫内传播的发生风险。PreC区主要编码HBeAg蛋白,可能通过缺失突变减少HBeAg的表达,降低HBV感染力,发生HBV宫内传播的概率降低。X区常见的缺失突变部位有nt1763~1770、nt1770~1777、nt1753~1772及nt1750~1770,X区的缺失突变可能会直接或间接抑制病毒的复制,在HBV基因nt1763~1770或nt1753~1772处缺失8 bp或20 bp可导致HBsAg、HBcAg和HBeAg的减少,这可能使突变病毒逃避免疫检测[14];将X区缺陷型的HBV转染入细胞内后,HBV的复制水平降低为野生型的10%[27]。由此提示,相对于HBV宫内传播组,对照组中较多的X区核苷酸片段缺失突变可能通过抑制病毒的复制水平,降低HBV感染力,进而相对不易发生HBV宫内传播。X区发生插入突变也可能会使HBV感染能力下降而使得HBV宫内传播的发生风险降低。可能由于样本量的限制,尚未发现PreC区缺失突变引起母亲HBeAg水平和X区缺失突变引起母亲HBV DNA载量的统计学改变,但发现母亲PreC区发生缺失突变时,HBeAg的表达水平在一定程度上相较于未发生缺失突变时减少;母亲发生X区缺失突变时,HBV DNA复制水平在一定程度上相较于未发生缺失突变时减少。
综上所述,携带C基因型HBV的母亲病毒基因组碱基置换和缺失突变率较低者在HBV宫内传播发生中风险更大,PreS1、S、C及P区碱基置换突变与HBV宫内传播有关;PreC区的缺失突变、X区的插入和缺失突变可能降低了宫内传播的发生风险。
本研究存在局限性。首先,由于技术限制,只选择了HBV DNA高载量的母亲血样,无法评估不同HBV DNA水平对宫内传播的影响;其次,仅研究了携带C基因型HBV的母亲病毒变异对HBV宫内传播的影响,今后应进一步扩大样本量,从基因分型的角度去分析HBV基因突变与HBV宫内传播的相关性。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Polaris Observatory C. Global prevalence, treatment, and prevention of hepatitis B virus infection in 2016:a modelling study[J]. The Lancet Gastroenterology Hepatology, 2018, 3(6): 383-403. DOI:10.1016/S2468-1253(18)30056-6 |
| [2] |
Jing W, Liu J, Liu M. Eliminating mother-to-child transmission of HBV: progress and challenges in China[J]. Front Med, 2020, 14(1): 21-29. DOI:10.1007/s11684-020-0744-2 |
| [3] |
Xu Y, Liu H, Wang Y, et al. The next step in controlling HBV in China[J]. BMJ (Clinical research ed), 2013, 347: f4503. DOI:10.1136/bmj.f4503 |
| [4] |
Thio CL, Guo N, Xie C, et al. Global elimination of mother-to-child transmission of hepatitis B: revisiting the current strategy[J]. The Lancet Infectious Dis, 2015, 15(8): 981-985. DOI:10.1016/s1473-3099(15)00158-9 |
| [5] |
Wang FS, Fan JG, Zhang Z, et al. The global burden of liver disease: the major impact of China[J]. Hepatology (Baltimore, Md), 2014, 60(6): 2099-2108. DOI:10.1002/hep.27406 |
| [6] |
Li HM, Wang JQ, Wang R, et al. Hepatitis B virus genotypes and genome characteristics in China[J]. World J Gastroenterol, 2015, 21(21): 6684-6697. DOI:10.3748/wjg.v21.i21.6684 |
| [7] |
Zeng G, Wang Z, Wen S, et al. Geographic distribution, virologic and clinical characteristics of hepatitis B virus genotypes in China[J]. J Viral Hepat, 2005, 12(6): 609-617. DOI:10.1111/j.1365-2893.2005.00657.x |
| [8] |
Lin CL, Kao JH. The clinical implications of hepatitis B virus genotype: Recent advances[J]. J Gastroenterol Hepatol, 2011, 26(Suppl 1): 123-130. DOI:10.1111/j.1440-1746.2010.06541.x |
| [9] |
Su HX, Zhang YH, Zhang ZG, et al. High conservation of hepatitis B virus surface genes during maternal vertical transmission despite active and passive vaccination[J]. Intervirology, 2011, 54(3): 122-130. DOI:10.1159/000319437 |
| [10] |
Hannoun C, Horal P, Lindh M. Long-term mutation rates in the hepatitis B virus genome[J]. J Gen Virol, 2000, 81(Pt 1): 75-83. DOI:10.1099/0022-1317-81-1-75 |
| [11] |
Su HX, Xu DZ, Li D, et al. Heterogeneity analysis of the hepatitis B virus genome in intrauterine infection[J]. J Med Virol, 2005, 77(2): 180-187. DOI:10.1002/jmv.20454 |
| [12] |
Papadakis MA, Elefsiniotis IS, Vlahos G, et al. Intrauterine-transplacental transmission of hepatitis B virus (HBV) from hepatitis B e antigen negative (precore mutant, G1896A) chronic HBV infected mothers to their infants. Preliminary results of a prospective study[J]. J Clin Virol, 2007, 38(2): 181-183. DOI:10.1016/j.jcv.2006.10.008 |
| [13] |
Sa-Nguanmoo P, Tangkijvanich P, Tharmaphornpilas P, et al. Molecular analysis of hepatitis B virus associated with vaccine failure in infants and mothers: a case-control study in Thailand[J]. J Med Virol, 2012, 84(8): 1177-1185. DOI:10.1002/jmv.23260 |
| [14] |
Moriyama K. Reduced antigen production by hepatitis B virus harbouring nucleotide deletions in the overlapping X gene and precore-core promoter[J]. J Gen Virol, 1997, 78(Pt 6): 1479-1486. DOI:10.1099/0022-1317-78-6-1479 |
| [15] |
Cheng H, Su H, Wang S, et al. Association between genomic heterogeneity of hepatitis B virus and intrauterine infection[J]. Virology, 2009, 387(1): 168-175. DOI:10.1016/j.virol.2009.02.015 |
| [16] |
Zou H, Chen Y, Duan Z, et al. Virologic factors associated with failure to passive-active immunoprophylaxis in infants born to HBsAg-positive mothers[J]. J Viral Hepat, 2012, 19(2): e18-25. DOI:10.1111/j.1365-2893.2011.01492.x |
| [17] |
Guo Z, Shi XH, Feng YL, et al. Risk factors of HBV intrauterine transmission among HBsAg-positive pregnant women[J]. J Viral Hepat, 2013, 20(5): 317-321. DOI:10.1111/jvh.12032 |
| [18] |
Zeng DW, Liu YR, Dong J, et al. Serum HBsAg and HBeAg levels are associated with liver pathological stages in the immune clearance phase of hepatitis B virus chronic infection[J]. Mol Med Rep, 2015, 11(5): 3465-3472. DOI:10.3892/mmr.2015.3207 |
| [19] |
Ko SC, Schillie SF, Walker T, et al. Hepatitis B vaccine response among infants born to hepatitis B surface antigen-positive women[J]. Vaccine, 2014, 32(18): 2127-2133. DOI:10.1016/j.vaccine.2014.01.099 |
| [20] |
Li H, She Q, Liu Y, et al. Clinical implication and viral mutation in basal core promoter/pre-core of hepatitis B virus C/D recombinant[J]. Hepatol Int, 2018, 12(5): 447-455. DOI:10.1007/s12072-018-9885-7 |
| [21] |
许军, 王齐欣, 范春蕾, 等. 中国南北两城市乙型肝炎病毒基因型与血清型的构成差异[J]. 中华实验和临床病毒学杂志, 2003, 17(4): 327-329. Xu J, Wang QX, Fan CL, et al. Comparison of hepatitis B virus serotype and genotype among HBsAg positive hepatitis B patients in a northern and a southern city of China[J]. Chin J Exp Clin Virol, 2003, 17(4): 327-329. DOI:10.3760/cma.j.issn.1003-9279.2003.04.006 |
| [22] |
Ghany M, Liang TJ. Drug targets and molecular mechanisms of drug resistance in chronic hepatitis B[J]. Gastroenterology, 2007, 132(4): 1574-1585. DOI:10.1053/j.gastro.2007.02.039 |
| [23] |
Lee YI, Hur GM, Suh DJ, et al. Novel pre-C/C gene mutants of hepatitis B virus in chronic active hepatitis: naturally occurring escape mutants[J]. J Gen Virol, 1996, 77(Pt 6): 1129-1138. DOI:10.1099/0022-1317-77-6-1129 |
| [24] |
Wang DD, Yi LZ, Wu LN, et al. Relationship between Maternal PBMC HBV cccDNA and HBV Serological Markers and its Effect on HBV Intrauterine Transmission[J]. Biomed Envir Sci: BES, 2019, 32(5): 315-323. DOI:10.3967/bes2019.043 |
| [25] |
武佳欣, 杨志清, 张睿君, 等. HBsAg阳性母亲HBV核心启动子突变与宫内传播的关系[J]. 中华流行病学杂志, 2020, 41(6): 902-907. Wu JX, Yang ZQ, Zhang RJ, et al. Relationship between mutations of HBV basal core promoter region in HBsAg-positive mothers and intrauterine transmission[J]. Chin J Epidemiol, 2020, 41(6): 902-907. DOI:10.3760/cma.j.cn112338-20200224-00163 |
| [26] |
Jiao F, Long L, Ding S, et al. Complete genome sequencing and clinical analysis of intrahepatic hepatitis B virus cccDNA from HCC[J]. Microb Pathog, 2017, 109: 49-55. DOI:10.1016/j.micpath.2017.04.028 |
| [27] |
Yousif M, Mudawi H, Bakhiet S, et al. Molecular characterization of hepatitis B virus in liver disease patients and asymptomatic carriers of the virus in Sudan[J]. BMC Infect Dis, 2013, 13: 328. DOI:10.1186/1471-2334-13-328 |
 2021, Vol. 42
2021, Vol. 42