文章信息
- 徐璐璐, 沈伟伟, 陈潇潇, 李桂霞, 许圆圆, 高眉扬, 周素娟, 林海江, 何纳.
- Xu Lulu, Shen Weiwei, Chen Xiaoxiao, Li Guixia, Xu Yuanyuan, Gao Meiyang, Zhou Sujuan, Lin Haijiang, He Na
- 台州市2016-2018年新报告HIV/AIDS抗病毒治疗前HIV-1耐药及亚型流行特征分析
- HIV-1 drug resistance and subtypes in newly reported HIV/AIDS patients before antiretroviral therapy in Taizhou city, 2016-2018
- 中华流行病学杂志, 2021, 42(4): 711-715
- Chinese Journal of Epidemiology, 2021, 42(4): 711-715
- http://dx.doi.org/10.3760/cma.j.cn112338-20200706-00926
-
文章历史
收稿日期: 2020-07-06
2. 台州市疾病预防控制中心 318000
2. Taizhou City Center for Disease Control and Prevention, Taizhou 318000, China
抗病毒治疗(ART)前HIV-1耐药指HIV/AIDS接受ART之前就存在的耐药。有研究显示ART前HIV-1耐药与一线ART方案疗效差、早期病毒学和免疫学失败以及耐药突变的进一步积累有关[1-2]。此外,我国自2016年实施“发现即治疗”策略以来,HIV/AIDS生存时间显著延长,接受ART人数规模不断扩大,这增加了HIV-1耐药株的传播风险,特别是在WHO提出“3个90%”艾滋病防治目标的背景下,我国艾滋病防控面临着新的挑战。
目前国内关于HIV/AIDS在ART前HIV-1耐药流行现状的研究大多集中于2016年“发现即治疗”策略之前,大部分研究现场为云南省、河南省等HIV-1高流行区[3-4]。本研究分析台州市2016- 2018年新报告的未接受ART的908例HIV/AIDS,了解ART前HIV-1耐药的流行状况及HIV-1亚型流行特点。
对象与方法1. 研究对象:2016年1月至2018年12月台州市新报告HIV/AIDS。纳入标准:①台州市常住居民;②首次确证为HIV/AIDS;③抗凝血标本 > 200 μl;④未接受ART;⑤知情同意。相关信息来源于我国艾滋病综合防治基本信息系统。采集的静脉血经处理后置-80 ℃冰箱保存。
2. 实验室检测:
(1)HIV-1 RNA的提取:使用德国Roche公司试剂盒(high pure viral nucleic acid kit),根据标准操作程序从200 μl样品中提取HIV-1 RNA。
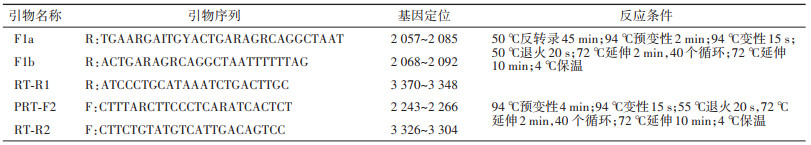
(2)pol区基因的扩增:应用RT-PCR进行扩增。2轮PCR均使用日本TaKaRa公司生产的试剂盒,使用引物及反应条件见表 1。
(3)基因测序:PCR产物送至北京六合华大基因科技有限公司上海分公司完成纯化及基因测序。
(4)基因亚型及耐药分析:采用DNASTAR Lasergene 17.0.2.1软件SeqMan程序对基因序列进行编辑和拼接,将拼接好的序列提交至美国HIV数据库(http://www.hiv.lanl.gov),使用HIV-Blast在线软件初步判定亚型。使用ClustalW 2.0.10软件将待分析序列与各亚型参考株序列多重排列和比对,利用Mega 7.0.26软件,采用Neighbor-Joining(N-J)法构建系统进化树,bootstrap设置为1 000且自展值≥70%判定同一亚型。最后,将序列提交到美国斯坦福大学HIV耐药数据库(http://hivdb.stanford.edu),耐药标准为2014年WHO耐药监测指南推荐的12种监测药物中有≥1种耐药评分≥15[5],即判为耐药。
3. 统计学分析:采用EpiData 3.1软件建立数据库,Excel 2016软件整理数据,统计分析采用SPSS 22.0软件。组间比较采用χ2检验,双侧检验,以P < 0.05为差异有统计学意义。
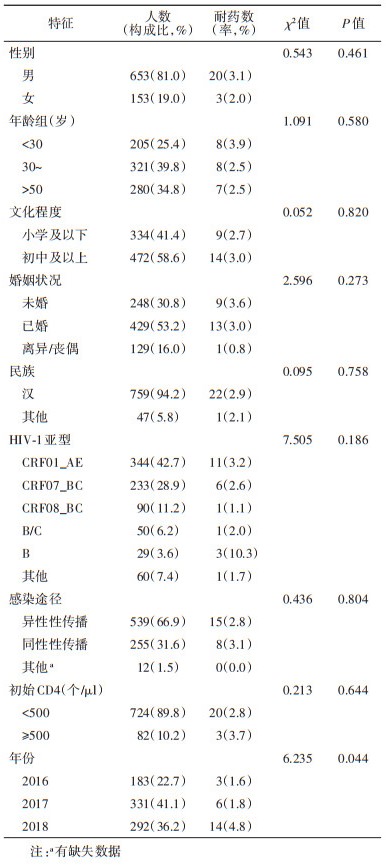
结果1. 人口学特征:2016-2018年台州市新报告HIV/AIDS 1 008例中,符合研究对象纳入标准908例,成功获得HIV-1 pol基因区序列的研究对象806例(88.8%,806/908),以男性(占81.0%)、30~50岁(占39.8%)、初中及以上文化程度(占58.6%)、已婚(占53.2%)、汉族(占94.2%)、异性性传播(占66.9%)为主。CD4+T淋巴细胞(CD4)计数 < 500个/μl者占89.8%。见表 2。
2. HIV-1亚型分布:以CRF01_AE(42.7%,344/806)、CRF07_BC(28.9%,233/806)和CRF08_BC(11.2%,90/806)为主,还包括B/C(6.2%,50/806)、B(3.6%,29/806)、CRF55_01B(1.7%,14/806)、CRF85_BC(1.7%,14/806)、CRF01_AE/B(1.4%,11/806)、CRF01_AE/B/C(0.7%,6/806)、C(0.6%,5/806)、CRF01_AE/CRF07_BC(0.4%,3/806)、CRF68_01B(0.3%,2/806)、CRF01_AE/C(0.3%,2/806)、A1(0.1%,1/806)、CRF02_AG(0.1%,1/806)和CRF59_01B(0.1%,1/806)。见表 2。
MSM中HIV-1亚型以CRF01_AE(53.3%,136/255)和CRF07_BC(32.2%,82/255)为主,其他包括CRF55_01B(2.4%,6/255)、B(1.6%,4/255)和CRF08_BC(1.2%,3/255)等;异性性传播者中HIV-1亚型以CRF01_AE(37.7%,203/539)、CRF07_BC(27.5%,148/539)和CRF08_BC(16.1%,87/539)为主,其他还包括B(4.6%,25/539)、CRF85_BC(2.6%,14/539)和CRF55_01B(1.5%,8/539)等。
3. HIV-1耐药情况:HIV/AIDS在ART前HIV-1耐药率为2.9%(23/806),其中,非核苷类反转录酶抑制剂(NNRTIs)、核苷类反转录酶抑制剂(NRTIs)和蛋白酶抑制剂(PIs)耐药率分别为1.9%(15/806)、0.6%(5/806)和0.0%,2例是NNRTIs和NRTIs双重耐药(0.2%),1例是NNRTIs、NRTIs和PIs三重耐药(0.1%)。不同年龄、不同感染途径和不同HIV-1亚型的耐药率差异无统计学意义(P > 0.05)。2016-2018年耐药率分别为1.6%(3/183)、1.8%(6/331)和4.8%(14/292),呈上升趋势(趋势χ2=4.872,P=0.027)。
23例HIV/AIDS在ART前HIV-1耐药者均为性传播(同性性传播8例、异性性传播15例),HIV-1亚型主要为CRF01_AE(11例)、CRF07_BC(6例)和B(3例)。有6例携带K103 N耐药突变位点针对依非韦伦(EFV)和奈韦拉平(NVP)高度耐药;4例携带M184I/V耐药突变位点针对恩曲他滨(FTC)和拉米夫定(3TC)高度耐药。针对依非韦伦(EFV)和奈韦拉平(NVP)高度耐药的携带其他耐药突变位点包括V106M(2例)、K101E(1例)和Y188L(1例)。见表 3。
2016-2018年台州市新报告HIV/AIDS ART前HIV-1耐药率为2.9%,这与Hua等[6]报道2008- 2011年台州市HIV/AIDS在ART前HIV-1耐药率(2.7%)、张星灿等[7]报道2012-2013年台州市HIV/AIDS在ART前HIV-1耐药率(3.1%)结果接近,略高于姚媛等[8]报道2014年台州市HIV/AIDS在ART前HIV-1耐药率(1.9%)。为了便于比较,认为传播性耐药与ART前耐药之间的差异可以忽略[9],参照WHO对耐药传播警戒线的规定,耐药率 < 5%为低度流行,5%~为中度流行,> 15%为高度流行[10],因此相较我国2004-2005年、2003-2014年和2005-2015年HIV/AIDS的ART前HIV-1耐药率分别为3.8%,4.7%和9.5%[3-4, 11],台州市ART前HIV-1耐药率仍处于低水平状态,说明台州市现行ART方案仍然具有成效。值得注意的是,2016- 2018年台州市新报告HIV/AIDS的ART前HIV-1耐药率分别为1.6%、1.8%、4.8%,呈现上升趋势。需继续加强对HIV/AIDS的ART前HIV-1耐药的监测工作,预防HIV-1耐药型毒株的扩散传播。
本研究发现,CRF01_AE和CRF07_BC是台州市HIV-1流行的主要亚型,与该地区以往的研究结果相近[6-8],也与浙江省2014-2017年的调查结果类似[12],而与我国其他地区HIV-1亚型分布有所不同[13-14]。
值得注意的是,B亚型HIV/AIDS在ART前HIV-1耐药率与其他亚型差异较大,最近有一项研究表明,B亚型与更高的传播耐药性相关[15],这一结果可能为ART提供重要的临床意义。
出现频率较高的耐药突变位点是K103N、M184V/I、Y181C和V106M,这些位点均可引起相关药物的高水平耐药。在报告的潜在耐药突变位点中,V179D/E、V106I与M46I/V的突变率较高,其中V179D/E突变率高达4.1%,V179D/E和V106I会导致NNRTIs的潜在耐药,包括EFV、NVP、依曲韦林和利匹韦林;M46I/V会导致PIs的潜在耐药,包括阿扎那韦、克力芝、福沙那韦、茚地那韦。我国目前一线ART方案并不包括PIs,因此,ART前HIV-1耐药突变主要归因于NNRTIs和NRTIs[16]。
综上所述,2016-2018年台州市新报告HIV/AIDS的ART前HIV-1耐药水平处于低流行状态,但存在上升趋势,随着ART规模的扩大,需加强HIV-1耐药型毒株的监测工作。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Kityo C, Boerma RS, Sigaloff KCE, et al. Pretreatment HIV drug resistance results in virological failure and accumulation of additional resistance mutations in Ugandan children[J]. J Antimicrob Chemother, 2017, 72(9): 2587-2595. DOI:10.1093/jac/dkx188 |
| [2] |
Hofstra LM, Sauvageot N, Albert J, et al. Transmission of HIV drug resistance and the predicted effect on current first-line regimens in Europe[J]. Clin Infect Dis, 2016, 62(5): 655-663. DOI:10.1093/cid/civ963 |
| [3] |
刘大锦, 冯孟贤, 刘民. 中国未接受抗病毒治疗的人类免疫缺陷病毒/获得性免疫缺陷综合征(HIV/AIDS)人群HIV原发耐药的Meta分析[J]. 北京大学学报: 医学版, 2015, 47(3): 474-482. Liu DJ, Feng MX, Liu M. Primary drug resistance of human immunodeficiency virus (HIV) among the treat-ment-naive individuals with HIV in China: a Meta-analysis[J]. J Peking Univ: Health Sci, 2015, 47(3): 474-482. DOI:10.3969/j.issn.1671-167X.2015.03.020 |
| [4] |
吴楠楠, 殷明琪, 袁瑞, 等. 我国HIV亚型与耐药性Meta分析[J]. 中华流行病学杂志, 2016, 37(11): 1546-1554. Wu NN, Yin MQ, Yuan R, et al. HIV genetic subtypes and HIV drug resistance in China: a Meta-analysis[J]. Chin J Epidemiol, 2016, 37(11): 1546-1554. DOI:10.3760/cma.j.issn.0254-6450.2016.11.022 |
| [5] |
World Health Organization. Surveillance of HIV drug resistance in adults initiating antiretroviral therapy (pre-treatment HIV drug resistance)[EB/OL]. (2014-07)[2020-06-01]. http://apps.who.int/iris/bitstream/handle/10665/112802/9789241507196_eng.pdf?sequence=1.
|
| [6] |
Hua J, Lin H, Ding Y, et al. HIV drug resistance in newly diagnosed adults in a rural prefecture of eastern China[J]. Epidemiol Infect, 2015, 143(3): 663-672. DOI:10.1017/S0950268814001174 |
| [7] |
张星灿, 吴琼海, 沈伟伟, 等. 浙江省台州地区新确诊HIV感染者耐药突变研究[J]. 中华疾病控制杂志, 2015, 19(2): 107-110. Zhang XC, Wu QH, Shen WW, et al. HIV drug resistance among newly-diagnosed HIV-infected patients in Taizhou prefecture of Zhejiang Province[J]. Chin J Dis Control Prev, 2015, 19(2): 107-110. DOI:10.16462/j.cnki.zhjbkz.2015.02.001 |
| [8] |
姚媛, 吴琼海, 沈伟伟, 等. 浙江省台州市2014年新确诊HIV感染者原发性耐药研究[J]. 中国初级卫生保健, 2016, 30(9): 52-54, 57. Yao Y, Wu QH, Shen WW, et al. Reseatch on HIV drug resistance among newly-diagnosed HIV-infected patients in Taizhou prefecture of Zhejiang province in 2014[J]. Chin Prim Health Care, 2016, 30(9): 52-54, 57. DOI:10.3969/j.issn.1001-568X.2016.09.0020 |
| [9] |
Steegen K, Carmona S, Bronze M, et al. Moderate levels of pre-treatment HIV-1 antiretroviral drug resistance detected in the first South African national survey[J]. PLoS One, 2016, 11(12): e0166305. DOI:10.1371/journal.pone.0166305 |
| [10] |
Bennett DE, Myatt M, Bertagnolio S, et al. Recommendations for surveillance of transmitted HIV drug resistance in countries scaling up antiretroviral treatment[J]. Antivir Ther, 2008, 13(Suppl 2): 25-36. |
| [11] |
Liao LJ, Xing H, Shang H, et al. The prevalence of transmitted antiretroviral drug resistance in treatment-naive HIV-infected individuals in China[J]. J Acquir Immune Defic Syndr, 2010, 53(Suppl 1 Suppl 1): S10-14. DOI:10.1097/QAI.0b013e3181c7d363 |
| [12] |
Xu YF, Peng XR, Peng XM, et al. Characterization of HIV-1 subtypes and transmitted drug resistance among treatment-naive HIV-infected individuals in Zhejiang, China, 2014-2017[J]. Arch Virol, 2018, 163(8): 2233-2237. DOI:10.1007/s00705-018-3839-1 |
| [13] |
Yuan R, Cheng H, Chen LS, et al. Prevalence of different HIV-1 subtypes in sexual transmission in China: a systematic review and Meta-analysis[J]. Epidemiol Infect, 2016, 144(10): 2144-2153. DOI:10.1017/S0950268816000212 |
| [14] |
Xiao PP, Li JJ, Fu GF, et al. Geographic distribution and temporal trends of HIV-1 subtypes through heterosexual transmission in China: a systematic review and Meta-analysis[J]. Int J Environ Res Public Health, 2017, 14(7): 830. DOI:10.3390/ijerph14070830 |
| [15] |
Li YJ, Gu LJ, Han Y, et al. HIV-1 subtype B/B' and baseline drug resistance mutation are associated with virologic failure: a multicenter cohort study in China[J]. J Acquir Immune Defic Syndr, 2015, 68(3): 289-297. DOI:10.1097/QAI.0000000000000473 |
| [16] |
Ding YY, Ma ZH, He JY, et al. Evolving HIV epidemiology in Mainland China: 2009-2018[J]. Curr HIV/AIDS Rep, 2019, 16(6): 423-430. DOI:10.1007/s11904-019-00468-z |
 2021, Vol. 42
2021, Vol. 42