文章信息
- 金晓媚, 陈会超, 孙鹏艳, 曾志君, 杨莉, 杨朝军, 宋丽军, 张祖样, 马艳玲, 陈敏.
- Jin Xiaomei, Chen Huichao, Sun Pengyan, Zeng Zhijun, Yang Li, Yang Chaojun, Song Lijun, Zhang Zuyang, Ma Yanling, Chen Min
- 限制性抗原亲和力酶联免疫法和集合核酸法检测用于云南省哨点监测男男性行为人群HIV-1新发感染的研究
- Performance of limiting-antigen avidity enzyme immunoassay and pooling PCR in detection of recent HIV-1 infection among men who have sex with men in Yunnan province
- 中华流行病学杂志, 2021, 42(4): 706-710
- Chinese Journal of Epidemiology, 2021, 42(4): 706-710
- http://dx.doi.org/10.3760/cma.j.cn112338-20200605-00810
-
文章历史
收稿日期: 2020-06-05
新发感染率是评价HIV流行趋势的关键指标,在哨点监测系列横断面调查中开展HIV-1新发感染率监测,能够了解不同人群和不同地区HIV-1的传播速度和流行趋势,为有效地采取预防和治疗措施提供重要依据。相较于传统队列研究和数学模型法,应用血清学方法从横断面样本中估算新发感染率具有更高的成本效益[1],同队列研究一致性也较好[2]。限制性抗原亲和力酶联免疫法(LAg-Avidity EIA)因检测结果受疾病状态影响较小[3],相较于BED捕获酶联免疫法(BED-CEIA)具有更低的假近期感染率[4-5]。我国研究显示LAg-Avidity EIA具有较好的重复性和稳定性[6]。但由于LAg-Avidity EIA检测的为抗体阳转者,因此难以检出急性期感染,而研究显示新报告的HIV病例中半数是来源于早期感染阶段的传播[7],通过核酸检测可发现急性期感染者,采用集合核酸法既兼顾了敏感性又节约了成本,适用于各地区及全国高危人群艾滋病疫情监测和HIV-1新发感染率估算[8-10]。已有研究显示,使用BED-CEIA法和集合核酸法估算的MSM的HIV-1新发感染率有较好的一致性[11-12],而LAg-Avidity EIA和集合核酸法间的比较研究则报道较少。本研究将在云南省2016- 2017年哨点监测MSM中运用LAg-Avidity EIA和集合核酸法在横断面样本中评估MSM的HIV-1新发感染率。
对象与方法1. 研究对象:采用横断面连续调查的方法,在云南省的昆明市、西双版纳傣族自治州、保山市、楚雄彝族自治州、大理白族自治州、红河哈尼族彝族自治州、丽江市、临沧市、普洱市、曲靖市、文山壮族苗族自治州、玉溪市和昭通市13个州(市)开展MSM哨点监测。采用滚雪球方法,在哨点监测期内(4-6月)在MSM聚集场所连续抽样,监测对象为≥15岁男性,最近1年内有过同性插入性口交或肛交性行为。采集调查者5 ml外周静脉血,收集研究对象血液样本。
2. 检测方法:HIV-1抗体检测方法按照“全国艾滋病检测技术规范(2015年修订版)”[13]。HIV-1抗体初筛检测采用酶联免疫吸附试验,初筛阳性者采用蛋白免疫印迹试验(WB)进行确证检测,WB结果阳性排除既往HIV感染者(包括HIV/AIDS或已接受过艾滋病抗病毒治疗,或本次调查与首次病例报告时间相差≥6个月者),使用LAg-Avidity EIA(北京金豪制药股份有限公司)进行新发感染检测,区分新近感染者和长期感染者。HIV-1抗体初筛阴性者进行集合核酸法检测,采用50∶10∶1三级集合进行样品前处理[13]。10份样品各取130 μl形成1个二级集合,5个二级集合各取210 μl形成1个一级集合,使用NucliSENS EasyQ®HIV-1 v2.0试剂盒(法国生物梅里埃公司)进行实时分子信标核酸定量检测,集合检测阳性者进行拆分,最终确定核酸阳性的单个样本,经过追踪随访,抗体阳转的最后确定为HIV-1窗口期感染者。
3. HIV-1新发感染率估算:
采用LAg-Avidity EIA估算HIV-1新发感染率,按照UNAIDS/WHO推荐的公式[14]:

式中:I为新发感染率(高危人群中每100人年新感染的数量);R为判定为新近感染者人数;FRR为假近期感染率,根据中国CDC对国内样本的评估,在界值ODn=1.5时FRR=2.3%;P为抽检HIV-1阳性人数;ω为窗口期,即近期感染持续的时间,根据中国CDC对国内样本的评估LAg-Avidity EIA窗口期为130 d[15];N为抽检HIV-1阴性人数(根据未检测样本在应检测样本中所占比例对HIV-1阴性人数进行校正)。
采用集合核酸法估算HIV-1新发感染率,参照Brookmeyer方法[16],计算公式:

式中:I为新发感染率;M为HIV-1 RNA检测为阴性集合中的样品总数;N为参加集合的样品总数;C为HIV-1 RNA检测为阳性集合的单个集合中样品数;μ为窗口期,即抗体阳转前RNA检测持续为阳性的时间,以现有诊断技术检测HIV抗体估计为21 d[17]。
4. 统计学分析:使用SPSS 21.0软件进行统计学分析。HIV-1感染率和新发感染率的差异分析均采用χ2检验,以P < 0.05为差异有统计学意义。
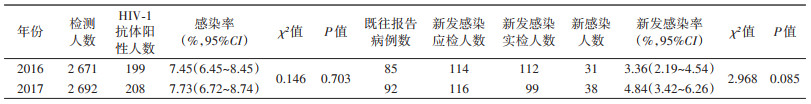
结果1. LAg-Avidity EIA估算的HIV-1新发感染率:2016-2017年通过云南省13个州(市)监测哨点共调查5 363名MSM。2016年监测2 671例,HIV-1抗体阳性199例,其中既往报告病例85例,感染率为7.45%;2017年监测2 692例,HIV-1抗体阳性208例,其中既往报告病例92例,感染率为7.73%。2年的HIV-1感染率差异无统计学意义(P > 0.05)(表 1)。
根据LAg-Avidity EIA检测结果进行新发感染率估算,2016年和2017年新发感染率分别为3.36%和4.84%,差异无统计学意义(P > 0.05)(表 1)。
2. 集合核酸法估算的HIV-1新发感染率:2016-2017年共监测HIV-1抗体阴性4 956例,实际进行集合核酸检测样本为4 469份,检测发现8份HIV-1 RNA阳性样本,其中2016年4份,2017年4份。8份样本定量核酸检测病毒载量平均拷贝数6.00(95%CI:3.81~6.34)Log10拷贝数/ml,经过随访,8例的HIV-1抗体全部阳转。2016年参加集合总样本数2 147份,HIV-1新发感染率为3.27%(95%CI:2.51%~4.02%);2017年参加集合总样本数2 322份,HIV-1新发感染率为3.02%(95%CI:2.32%~3.71%),不同年份HIV-1新发感染率(95%CI)有交叉,差异无统计学意义。
3. 2种方法估算的HIV-1新发感染率比较:2年数据合并,分别用基于HIV-1抗体的新发感染检测和基于HIV-1集合核酸法检测的方法估算云南省MSM的新发感染率,分别为4.05%(95%CI:3.14%~4.97%)和3.14%(95%CI:2.63%~3.65%)。2种方法得到的HIV-1新发感染率(95%CI)有交叉,差异无统计学意义。
4. 2种方法估算云南省3个国家级MSM哨点监测点HIV-1新发感染率比较:对3个国家级MSM哨点监测点(昆明市、红河哈尼族彝族自治州和玉溪市)2016年和2017年新发感染率进行比较显示,95%CI值有交叉,差异无统计学意义(表 2)。
本研究发现,采用LAg-Avidity EIA和集合核酸法分别估算云南省哨点MSM的HIV-1新发感染率在不同年份差异无统计学意义,2种方法用于新发感染率的连续监测有较好的稳定性,同时2种方法间一致性较好。与集合核酸法相比,使用LAg-Avidity EIA获得的新发感染率更高,同BED-CEIA法估算的新发感染率较接近[18-19]。集合核酸法估算的HIV-1新发感染率略低的原因在于感染后核酸阳性而抗体阴性的时间较短,平均12 d,而感染后22 d即可检测到IgM抗体[20-21],因此大样本或较高的检测频次才能筛查到足够的窗口期感染;其次就是抽样方法造成的结果偏倚,尽管LAg-Avidity EIA评估新发感染率具有较低的错分率[22-23],得到的感染率与队列研究较为一致[24],但同样会受抽样方法影响,由于MSM是难于接触到的人群,一般采用滚雪球的方法进行抽样,使得具有同样高危行为的人纳入调查,从而使样本的HIV-1阳性偏高[25]。
本研究对云南省3个国家级MSM哨点监测点数据统计显示,2种方法估算的新发感染率一致性较好。LAg-Avidity EIA估算的2016-2017年3个州(市)的新发感染率同2012-2015年使用BED-CEIA法估算的结果变化趋势一致[26],2012-2017年昆明市MSM的HIV-1新发感染率一直维持在较高水平,而红河哈尼族彝族自治州和玉溪市则一直保持在较低水平,这与昆明市MSM规模大、流动性大和活跃程度高有关。研究显示昆明市用LAg-Avidity EIA估算的HIV-1新发感染率较高,而与昆明市相反的是,红河哈尼族彝族自治州和玉溪市集合核酸法估算的HIV-1新发感染率较高,这可能与HIV-1感染率不同有关,昆明市MSM感染率显著高于其他2个州(市),而有研究显示,随着HIV-1感染率增高,BED-CEIA对新发感染率高估程度随之增加[27-28],这是由血清学检测方法存在的错分率造成的,尽管LAg-Avidity EIA错分率远低于BED-CEIA,但仍会受此影响导致新发感染率的高估。
本研究存在不足。一是少部分州(市)HIV-1抗体筛查阴性样本未进行保存,因而未进行集合核酸法检测,从而可能造成窗口期检出率下降;二是2017年未进行新发感染检测的样本数较多,可能会造成估算结果的偏差;三是可能与HIV-1筛查试剂的敏感度有关,如果采用四代抗体筛查试剂进行检测,阳性检出率相对较高,那么结果判定为阴性的样本数量就会减少,在采用“四代试剂+WB+集合核酸法”检测策略时,如未将筛查阳性确证结果不确定或阴性的样本纳入集合核酸法检测,则可能导致集合核酸法估算的HIV-1新发感染率被低估[29]。
综上所述,LAg-Avidity EIA和集合核酸法估算得到2016-2017年云南省哨点MSM HIV-1新发感染率一致性较好,2种方法用于HIV-1新发感染率的连续监测会有较好的稳定性,能反映该人群HIV-1新发感染的流行趋势,但2种方法估算的新发感染率存在一定差异,仅采用1种方法估算新发感染率可能会使结果产生偏倚。通过多种方法分层或联合检测更能准确地获得新发感染率[30-31],对于部分欠发达地区不能开展多种方法联合检测的,应根据目的和特定人群选择合适的评价方法。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Janssen RS, Satten GA, Stramer SL, et al. New testing strategy to detect early HIV-1 infection for use in incidence estimates and for clinical and prevention purposes[J]. JAMA, 1998, 280(1): 42-48. DOI:10.1001/jama.280.1.42 |
| [2] |
陶钧, 孟令章, 肖瑶. HIV-1发病率研究方法及其比较[J]. 中国艾滋病性病, 2011, 17(2): 191-195. Tao J, Meng LZ, Xiao Y. The comparison among different methods of measuring HIV-1 incidence[J]. Chin J AIDS STD, 2011, 17(2): 191-195. DOI:10.13419/j.cnki.aids.2011.02.031 |
| [3] |
Wei XR, Liu X, Dobbs T, et al. Development of two avidity-based assays to detect recent HIV type 1 seroconversion using a multisubtype gp41 recombinant protein[J]. AIDS Res Hum Retroviruses, 2010, 26(1): 61-71. DOI:10.1089/aid.2009.0133 |
| [4] |
Duong YT, Qiu MF, de AK, et al. Detection of recent HIV-1 infection using a new limiting-antigen avidity assay: potential for HIV-1 incidence estimates and avidity maturation studies[J]. PLoS One, 2012, 7(3): e33328. DOI:10.1371/journal.pone.0033328 |
| [5] |
Karatzas-Delgado EF, Ruiz-González V, García-Cisneros S, et al. Evaluation of an HIV recent infection testing algorithm with serological assays among men who have sex with men in Mexico[J]. J Infect Public Health, 2020, 13(4): 509-513. DOI:10.1016/j.jiph.2019.11.002 |
| [6] |
于海英, 叶艺, 张娜, 等. 检测HIV-1新发感染的限制性抗原亲和力方法的重复性与稳定性评价[J]. 中国艾滋病性病, 2013, 19(5): 318-321. Yu HY, Ye Y, Zhang N, et al. Evaluation of the repeatability and stability of limiting-antigen avidity enzyme immunoassay for HIV-1 incidence estimates[J]. Chin J AIDS STD, 2013, 19(5): 318-321. DOI:10.13419/j.cnki.aids.2013.05.005 |
| [7] |
Brenner BG, Roger M, Routy JP, et al. High rates of forward transmission events after acute/early HIV-1 infection[J]. J Infect Dis, 2007, 195(7): 951-959. DOI:10.1086/512088 |
| [8] |
Priddy FH, Pilcher CD, Moore RH, et al. Detection of acute HIV infections in an urban HIV counseling and testing population in the United States[J]. J Acquir Immune Defic Syndr, 2007, 44(2): 196-202. DOI:10.1097/01.qai.0000254323.86897.36 |
| [9] |
陈曦, 张国强, 贺健梅, 等. 基于核酸扩增方法估计MSM的HIV新发感染的研究[J]. 中国艾滋病性病, 2013, 19(12): 864-866. Chen X, Zhang GQ, He JM, et al. Screening of new HIV infection in men who have sex with men using pooled nucleic acid amplification tasting[J]. Chin J AIDS STD, 2013, 19(12): 864-866. DOI:10.13419/j.cnki.aids.2013.12.010 |
| [10] |
董莉娟, 陈敏, 苏莹珍, 等. 采用集合RNA检测方法估计高危人群的HIV感染发病率[J]. 中华流行病学杂志, 2013, 34(8): 812-814. Dong LJ, Chen M, Su YZ, et al. Estimation on the HIV-1 incidence among high risk groups using the pooling RNA technique[J]. Chin J Epidemiol, 2013, 34(8): 812-814. DOI:10.3760/cma.j.issn.0254-6450.2013.08.014 |
| [11] |
江华洲. 男男性行为人群HIV-1早期感染检测策略及新发感染率研究[D]. 北京: 中国疾病预防控制中心, 2011. Jiang HZ. Research of HIV-1 screening strategy and estimation of incidence among MSM population in China[D]. Beijing: Chinese Center for Disease Control and Prevention, 2011. |
| [12] |
柳忠泉, 于茂河, 郑敏娜, 等. 天津市MSM HIV感染窗口期检测策略的研究[J]. 中国艾滋病性病, 2013, 19(7): 494-496. Liu ZQ, Yu MH, Zheng MN, et al. A study on early detection of HIV infection among MSM in Tianjin[J]. Chin J AIDS STD, 2013, 19(7): 494-496. DOI:10.13419/j.cnki.aids.2013.07.012 |
| [13] |
中国疾病预防控制中心. 全国艾滋病检测技术规范(2015年修订版)[R]. 北京: 中国疾病预防控制中心, 2015. Chinese Center for Disease Control and Prevention. National guideline for detection of HIV/AIDS[R]. Beijing: Chinese Center for Disease Control and Prevention, 2015. |
| [14] |
WHO. When and how to use assays for recent infection to estimate HIV incidence at a population level: UNAIDS/WHO working group on global HIV/AIDS and STI surveillance[EB/OL]. (2011-01-01)[2020-05-05]. https://www.who.int/hiv/pub/surveillance/sti_surveillance/en.
|
| [15] |
Duong YT, Kassanjee R, Welte A, et al. Recalibration of the Limiting Antigen Avidity EIA to determine mean duration of recent infection in divergent HIV-1 subtypes[J]. PLoS One, 2015, 10(2): e0114947. DOI:10.1371/journal.pone.0114947 |
| [16] |
Brookmeyer R. Analysis of multistage pooling studies of biological specimens for estimating disease incidence and prevalence[J]. Biometrics, 1999, 55(2): 608-612. DOI:10.1111/j.0006-341x.1999.00608.x |
| [17] |
国家卫生健康委员会. WS 293-2019艾滋病和艾滋病病毒感染诊断[S]. 北京: 中国标准出版社, 2019. National Health Commission. WS 293-2019 Diagnosis for HIV/AIDS[S]. Beijing: Standards Press of China, 2019. |
| [18] |
杨洪, 李东民, 苏玲, 等. HIV-1新发感染2种检测方法在MSM哨点人群中的对比[J]. 预防医学情报杂志, 2017, 33(1): 10-14. Yang H, Li DM, Su L, et al. Comparison of two assays for identification of recent HIV-1 infection in population of men who have sex with men[J]. J Prev Med Inf, 2017, 33(1): 10-14. |
| [19] |
梁君, 高志云, 颜浩, 等. 限制性抗原亲和力酶免法用于MSM哨点HIV-1新发感染检测研究[J]. 中国病毒病杂志, 2014, 4(2): 101-105. Liang J, Gao ZY, Yan H, et al. Performance of limiting-antigen avidity enzyme immunoassay in the detection of recent HIV-1 infection among men who have sex with men in China[J]. Chin J Viral Dis, 2014, 4(2): 101-105. DOI:10.16505/j.2095-0136.2014.02.004 |
| [20] |
Fiebig EW, Wright DJ, Rawal BD, et al. Dynamics of HIV viremia and antibody seroconversion in plasma donors: implications for diagnosis and staging of primary HIV infection[J]. AIDS, 2003, 17(13): 1871-1879. DOI:10.1097/00002030-200309050-00005 |
| [21] |
Family Health International. Assays to estimate HIV incidence and detect acute HIV infection[EB/OL]. (2009-12-01)[2020-05-05]. https://www.who.int/diagnostics_laboratory/links/assays_to_estimate_hiv_incidence_jun_2010.pdf?ua=1.
|
| [22] |
Shah NS, Duong YT, Le LV, et al. Estimating false-recent classification for the limiting-antigen avidity EIA and BED-capture enzyme immunoassay in Vietnam: implications for HIV-1 incidence estimates[J]. AIDS Res Hum Retroviruses, 2017, 33(6): 546-554. DOI:10.1089/AID.2016.0203 |
| [23] |
Kassanjee R, Pilcher CD, Keating SM, et al. Independent assessment of candidate HIV incidence assays on specimens in the CEPHIA repository[J]. AIDS, 2014, 28(16): 2439-2449. DOI:10.1097/QAD.0000000000000429 |
| [24] |
Duong YT, Dobbs T, Mavengere Y, et al. Field validation of limiting-antigen avidity enzyme immunoassay to estimate HIV-1 incidence in cross-sectional survey in Swaziland[J]. AIDS Res Hum Retroviruses, 2019, 35(10): 896-905. DOI:10.1089/AID.2018.0284 |
| [25] |
彭庭海, 彭国平, 阳凯, 等. 湖北省2010-2013年男男性行为者HIV新发感染分析[J]. 中华流行病学杂志, 2015, 36(2): 162-166. Peng TH, Peng GP, Yang K, et al. Recent HIV infection among men who have sex with men in Hubei, 2010-2013[J]. Chin J Epidemiol, 2015, 36(2): 162-166. DOI:10.3760/cma.j.issn.0254-6450.2015.02.014 |
| [26] |
宋丽军, 陈会超, 梅静远, 等. 云南省2012-2015年男男性行为者HIV感染率及新近感染率分析[J]. 中国艾滋病性病, 2018, 24(10): 1020-1023. Song LJ, Chen HC, Mei JY, et al. HIV prevalence and incidence among men who have sex with men in Yunnan from 2012 to 2015[J]. Chin J AIDS STD, 2018, 24(10): 1020-1023. DOI:10.13419/j.cnki.aids.2018.10.16 |
| [27] |
McDougal JS, Parekh BS, Peterson ML, et al. Comparison of HIV type 1 incidence observed during longitudinal follow-up with incidence estimated by cross-sectional analysis using the BED capture enzyme immunoassay[J]. AIDS Res Hum Retroviruses, 2006, 22(10): 945-952. DOI:10.1089/aid.2006.22.945 |
| [28] |
Sakarovitch C, Rouet F, Murphy G, et al. Do tests devised to detect recent HIV-1 infection provide reliable estimates of incidence in Africa?[J]. J Acquir Immune Defic Syndr, 2007, 45(1): 115-122. DOI:10.1097/QAI.0b013e318050d277 |
| [29] |
江华洲, 沈圣, 裴丽健, 等. HIV集合核酸检测在男男性行为人群中的应用评价[J]. 中华检验医学杂志, 2011, 34(6): 529-533. Jiang HZ, Shen S, Pei LJ, et al. Evaluation of application of pooling nucleic acid amplification testing in men who have sex with men population in China[J]. Chin J Lab Med, 2011, 34(6): 529-533. DOI:10.3760/cma.j.issn.1009-9158.2011.06.013 |
| [30] |
Laeyendecker O, Brookmeyer R, Cousins MM, et al. HIV incidence determination in the United States: a multiassay approach[J]. J Infect Dis, 2013, 207(2): 232-239. DOI:10.1093/infdis/jis659 |
| [31] |
Konikoff J, Brookmeyer R, Longosz AF, et al. Performance of a limiting-antigen avidity enzyme immunoassay for cross-sectional estimation of HIV incidence in the United States[J]. PLoS One, 2013, 8(12): e82772. DOI:10.1371/journal.pone.0082772 |
 2021, Vol. 42
2021, Vol. 42