文章信息
- 蒋杨倩, 胡志斌, 杜江波, 林苑, 马红霞, 靳光付, 李蓉, 颜军昊, 刘志伟, 林戈, 周灿权, 夏彦恺, 沈洪兵.
- Jiang Yangqian, Hu Zhibin, Du Jiangbo, Lin Yuan, Ma Hongxia, Jin Guangfu, Li Rong, Yan Junhao, Liu Zhiwei, Lin Ge, Zhou Canquan, Xia Yankai, Shen Hongbing
- 中国国家出生队列研究调查对象的基线特征分析
- Baseline characteristics of the participants of China National Birth Cohort
- 中华流行病学杂志, 2021, 42(4): 579-585
- Chinese Journal of Epidemiology, 2021, 42(4): 579-585
- http://dx.doi.org/10.3760/cma.j.cn112338-20201231-01455
-
文章历史
收稿日期: 2020-12-31
2. 南京医科大学生殖医学国家重点实验室 全球健康研究中心 211166;
3. 南京医科大学公共卫生学院儿少卫生与妇幼保健学系 211166;
4. 北京大学第三医院生殖中心妇产科 100191;
5. 山东大学附属生殖医院, 济南 250021;
6. 上海交通大学医学院中国福利会国际和平妇幼保健院新生儿科 200030;
7. 中信湘雅生殖与遗传专科医院, 长沙 410000;
8. 中山大学第一附属医院生殖中心, 广州 510080;
9. 南京医科大学公共卫生学院教育部现代毒理学重点实验室 211166
2. State Key Laboratory of Reproductive Medicine, Center for Global Health, Nanjing Medical University, Nanjing 211166, China;
3. Department of Maternal, Child and Adolescent Health, School of Public Health, Nanjing Medical University, Nanjing 211166, China;
4. Department of Obstetrics and Gynecology, Reproductive Medical Center, Peking University Third Hospital, Beijing 100191, China;
5. Center for Reproductive Medicine, Shandong University, Ji'nan 250021, China;
6. Departments of Neonatology, International Peace Maternity and Children Hospital of China Welfare Institution, School of Medicine, Shanghai Jiaotong University, Shanghai 200030, China;
7. Reproductive and Genetic Hospital of CITIC-Xiangya, Changsha 410000, China;
8. Reproductive Medicine Center, The First Affiliated Hospital of Sun Yat-sen University, Guangzhou 510080, China;
9. Key Laboratory of Modern Toxicology of Ministry of Education, School of Public Health, Nanjing Medical University, Nanjing 211166, China
近年来,随着生育年龄推迟、环境污染、生活压力和不良生活习惯等问题的突出,进一步加重了我国育龄夫妇不孕不育的负担[1]。研究报告显示,2010-2011年我国育龄夫妇中的不孕不育患病率达25%[2]。人类辅助生殖技术(assisted reproductive technology,ART)作为当前解决不孕不育难题的重要技术手段,为不孕不育患者带来了福音。随着ART的兴起,2011年我国的“试管婴儿”出生比例超过1.0%,我国成为全球“试管婴儿”诞生最多的国家[3]。“健康和疾病的发育起源”学说认为生命早期的不良环境因素暴露,会引起组织器官在结构和功能上发生永久性或程序性改变,从而影响子代成年期多种慢性非传染性疾病的发生发展[4]。ART受孕人群在治疗过程不可避免地面临大量外源性激素、配子机械操作、胚胎冻融等外源性暴露,再结合父、母源性不良生殖生育特征,通过ART受孕的母亲及其子代的健康受到更多的关注。现有的流行病学调查也提示,ART受孕的孕妇发生妊娠并发症、不良围产期结局、子代出生缺陷和生长发育障碍的风险高于自然受孕人群[5-6],此外,还与子代远期的慢性疾病(包括肥胖、2型糖尿病和心血管疾病)的风险增加有关[7-10]。随着近年来“试管婴儿”数量的增加,亟需进一步阐明ART治疗相关因素及其对子代近期和远期健康影响和可能的生物学机制。
前瞻性的出生队列研究设计由“因”及“果”的特点,能够检验暴露与结局之间的因果关系,是研究生命早期暴露对子代健康的影响及可能机制的最有效手段。目前国内外许多出生队列如美国的环境与儿童健康(NIH Environmental Influences on Child Health Outcomes,ECHO)队列[11]、荷兰的鹿特丹R世代队列[12]、英国的埃文纵向亲子研究[13]、我国的安徽出生队列[14]和上海市的优生队列[15]等,纳入的研究人群绝大部分为自然受孕人群,美国的环境和生殖健康(Environment and Reproductive Health,EARTH)队列重点关注ART治疗人群,研究了一系列环境、饮食和生活方式因素对人类生殖的影响[16]。此外,ART受孕与自然受孕人群子代健康结局的比较研究大多基于登记系统数据库,如纽约上州儿童研究(Upstate Kids Study)[17],这些基于登记的系统研究,无法获取生物样本进一步探究多种环境暴露和遗传因素的影响以及环境-遗传的交互作用。
因此,由南京医科大学生殖医学国家重点实验室牵头,于2016年启动中国国家出生队列(China National Birth Cohort,CNBC)项目,覆盖我国不同地区的12个省(自治区、直辖市)的24所医院。CNBC将跟踪收集ART治疗前后、孕早期、孕中期、孕晚期及分娩时的数据信息并采集卵泡液、精液、男女双方血液和尿液等多种生物样本,并依次在子代儿童出生后第42天、6个月、12个月、36个月跟踪随访采集数据信息和生物样本。CNBC旨在研究ART治疗相关因素对子代近期和远期健康影响和可能的生物学机制,并进一步探讨生命早期遗传、环境因素及遗传-环境交互作用对子代健康的影响,阐明生殖障碍人群子代发育结局和胚胎源性疾病的潜在机制,高效衔接生殖健康人群研究、机制探索和临床应用。本文将简要介绍该队列人群基线相关指标并进行描述性分析。
对象与方法1. 基线调查:
(1)调查对象:ART受孕家庭来自项目内研究医院的生殖中心,纳入排除标准:①中国公民且为各研究医院所在城市的居民;②首次进行ART治疗的夫妇;③计划行体外受精或卵胞浆内单精子显微注射技术,排除捐精、捐卵或子宫内受精受孕的夫妇;④计划在研究医院分娩;⑤知情同意且自愿参加CNBC。自然受孕家庭来自社区或医院,纳入标准:①中国公民且为各研究医院所在城市的居民;②孕早期8~14周;③自然受孕的夫妇;④计划在研究医院进行常规产前检查并分娩;⑤知情同意且自愿参加CNBC。南京医科大学及项目所有的参与单位和研究医院的医学伦理委员会批准了此项研究。CNBC绝大部分研究医院基于项目组的无纸化信息采集平台,进行多中心队列成员管理和追踪随访,湖北、广东的自然受孕队列和山东的ART受孕队列基于各研究医院自建的随访系统,定期向项目组汇交数据。
(2)调查方法及内容:基线调查以家庭为单位,包括问卷调查、实验室指标检测、临床信息摘录和生物样本采集。ART受孕家庭在使用超排卵药物之前完成男女双方基线信息和生物样本采集。自然受孕家庭在孕8~14周完成男女双方基线信息和生物样本采集。
① 问卷调查:主要包括人口学和经济学信息(居住地区、年龄、家庭收入、文化程度、职业)、行为方式(吸烟、饮酒、饮茶、饮咖啡、饮料、体育锻炼等)、家庭和职业环境暴露(职业暴露、室内装修、被动吸烟暴露、宠物等)、女方生殖生育史(月经特征、孕次、产次、不良妊娠结局史)、疾病史和家族史(研究对象疾病史和直系亲属高血压、糖尿病、恶性肿瘤史)、膳食补充剂(叶酸、复合维生素、钙剂、铁剂)、膳食情况(大米、面食、蔬菜、水果、肉类、蛋、奶等24类食物摄入频率和量)以及睡眠(匹兹堡睡眠量表)和心理(压力、抑郁和焦虑量表)状况。
② 实验室指标检测:包括血常规、尿常规、FPG、血脂(TG、TC、HDL-C、LDL-C)、肝功能(胆红素、总蛋白、白蛋白、谷丙转氨酶、胆碱酯酶和碱性磷酸酶)和肾功能(血尿素氮、肌酐和尿酸)、甲状腺功能(促甲状腺素、游离T3、游离T4)、凝血功能检查、TORCH八项(弓形虫和风疹病毒、巨细胞病毒等)和传染病检查,另外,ART受孕家庭还包括男女双方遗传学检查、女方ART治疗前基础激素内分泌检查(促卵胞激素、促黄体生成素、雌二醇、孕酮、催乳素、睾酮、抗苗勒氏管激素、抑制素B和硫酸脱氢表雄酮)以及男方精液常规检查。
③ 临床信息摘录:ART受孕家庭男女双方的ART治疗前病案摘录,包括既往疾病史、不孕诊断等。
④ 生物样本采集:ART受孕家庭包括男女双方的血液和尿液、精液和卵泡液样本;自然受孕家庭包括男女双方血液和尿液样本。
2. 质量控制:CNBC项目启动之初已经建立了统一的队列建设标准和全流程的监督和质控体系,涵盖ART受孕和自然受孕出生队列研究对象纳入和随访、临床检查、问卷调查、生物样本采集、处理和转运、生物样本入库与出库、数据信息管理、网络平台管理、质量控制等内容的出生队列实施标准和操作规范,严格遵循队列的标准操作规范,采用科学、高效、标准化的手段严格管理队列研究各个环节,促进队列研究平台的有序高质量运行。此外,组织多中心出生队列工作人员在项目主中心(南京医科大学附属妇产医院)进行统一培训和考核,促进多中心出生队列的同质化建设。
3. 统计学分析:本研究采用R 3.6.1软件进行描述性统计学分析。采用频率或均数描述各主要基线变量的水平。对5个有ART受孕和自然受孕人群平行随访的地区(江苏省、北京市、上海市、广东省、四川省和湖南省),采用χ2检验(必要时采用Fisher精确概率检验法)比较不同受孕人群各构成比指标的差异,采用方差分析比较不同受孕人群连续性变量的差异,所有假设检验均为双侧,以P < 0.05为差异有统计学意义。
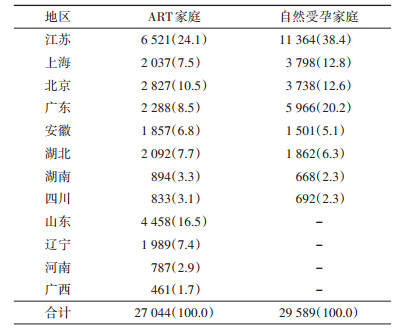
结果CNBC研究共有24家研究医院分别位于中国12个省(自治区、直辖市),江苏省、上海市、北京市、广东省、安徽省、湖北省、湖南省和四川省均有ART受孕家庭和自然受孕家庭的纳入,山东省、河南省、辽宁省和广西壮族自治区仅开展ART受孕家庭的纳入,共有9家研究中心同步开展ART受孕家庭和自然受孕家庭的纳入。见表 1,2。截至2020年6月,共纳入27 044个ART受孕家庭,29 589个自然受孕家庭。
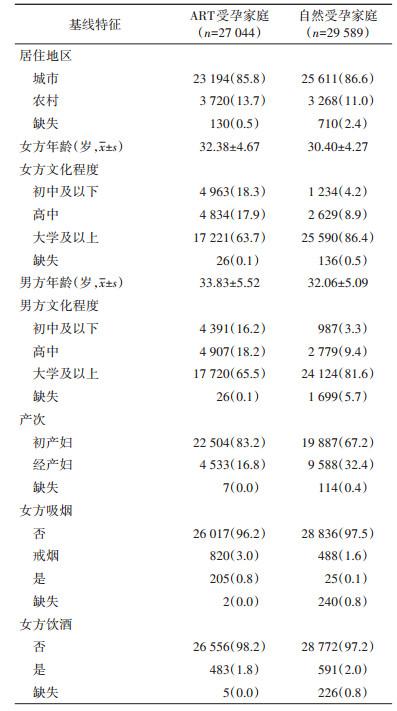
CNBC中ART受孕家庭和自然受孕家庭的基线特征见表 3。CNBC的研究人群中绝大部分为城市居民。在ART受孕家庭中,男女双方分别有65.5%和63.7%为大学及以上文化程度,年龄(33.83±5.52)和(32.38±4.67)岁。女方83.2%为初产妇,女方的吸烟率为0.8%,饮酒率为2.1%。在自然受孕家庭中,男女双方分别有81.5%和86.5%为大学及以上文化程度,年龄(32.06±5.09)和(30.40±4.27)岁。女方67.2%为初产妇,女方的吸烟率为0.1%,饮酒率为2.2%。
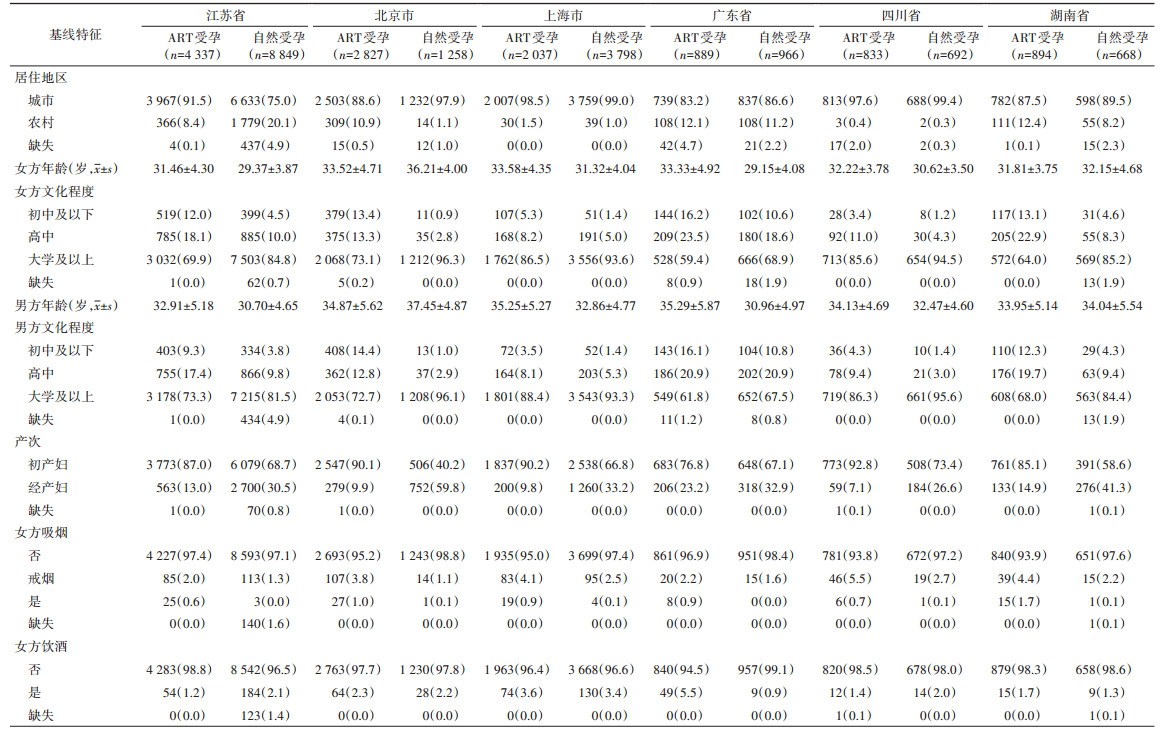
选择在CNBC中同期招募并进行后续平行随访的9个研究中心,分别位于江苏省、北京市、上海市、广东省、四川省和湖南省,比较ART受孕家庭和自然受孕家庭的基线特征(表 4)。虽然不同地区的研究对象的基线特征存在较大的差异,但是与自然受孕的家庭相比,ART受孕家庭男女双方的文化程度较低、初产妇占比越大,女方的吸烟率也越高,除北京市和湖南省以外,ART受孕家庭男女双方的年龄均高于自然受孕家庭。
CNBC是一项针对ART人群及其子代的大样本、前瞻性出生队列研究。CNBC同步纳入自然受孕的夫妇,在孕中期、孕晚期、分娩至子代出生后的随访,同步开展ART受孕家庭和自然受孕家庭长期的跟踪随访。CNBC的主要研究目的是探讨ART是否增加不良妊娠结局和子代相关疾病的风险,阐明ART导致的不良出生结局的可能影响因素及机制。另外,本队列研究现场收集了详细的流行病学资料和齐全的生物样本,并将致力于整合宏观环境因素、暴露组学、代谢组学、表观遗传组学及全基因组学等多组学数据,为后续研究生命早期环境与遗传因素及遗传-环境交互作用在胎儿发育及出生后子代发育和疾病发生中的作用提供了可靠的资源。同时,也为发现潜在的新的生物标志物并用于预测不良妊娠结局的发生提供了保障,并为促进母婴健康、优生优育的预防控制策略制定提供科学依据。本队列的实施将有助于实现全生命周期健康,实现更高水平的全民健康。
本次研究描述了我国各个地区ART受孕夫妇和自然受孕夫妇的基线特征。不同地区在人口学和经济性指标上有很大的差异,在饮酒、吸烟等生活方式上也有差异。与自然受孕人群相比,ART受孕夫妇年龄越大、文化程度较低,ART受孕女性中初产妇较多,吸烟率也较高。这些特征作为混杂因素,在探索ART对子代健康影响的研究中可以基于这些丰富的数据资源做更完善的分析。
CNBC具有的优势:多中心ART受孕和自然受孕人群并存,同步获取完善的暴露资料,同时采集多时点、多类型的生物样本用于环境内暴露和遗传学检测,为研究生命早期环境、遗传和遗传-环境交互作用在子代疾病发生中的作用及可能机制提供了可能。但是CNBC仍然存在一些不足,一方面,无法实时获取自然受孕人群孕前的暴露资料和生物样本;怀孕会影响研究人群的生活方式(如吸烟、饮酒等),ART受孕家庭和自然受孕家庭的基线采集时间不一致,可能导致不同受孕方式人群的基线信息比较时存在偏倚。另一方面,本研究的研究对象大部分为经济发达地区,这种选择性偏倚可能会影响队列结果对于环境暴露与疾病危险之间联系的判断。
利益冲突所有作者均声明不存在利益冲突
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Balen AH, Rutherford AJ. Management of infertility[J]. BMJ, 2007, 335(7620): 608-611. |
| [2] |
Zhou Z, Zheng D, Wu H, et al. Epidemiology of infertility in China: a population-based study[J]. BJOG, 2018, 125(4): 432-441. DOI:10.1111/1471-0528.14966 |
| [3] |
Yang X, Li Y, Li C, et al. Current overview of pregnancy complications and live-birth outcome of assisted reproductive technology in mainland China[J]. Fertil Steril, 2014, 101(2): 385-391. DOI:10.1016/j.fertnstert.2013.10.017 |
| [4] |
Gillman MW. Developmental origins of health and disease[J]. N Engl J Med, 2005, 353(17): 1848-1850. DOI:10.1056/NEJMe058187 |
| [5] |
Romundstad LB, Romundstad PR, Sunde A, et al. Effects of technology or maternal factors on perinatal outcome after assisted fertilisation: a population-based cohort study[J]. Lancet, 2008, 372(9640): 737-743. DOI:10.1016/S0140-6736(08)61041-7 |
| [6] |
Hansen M, Kurinczuk JJ, Milne E, et al. Assisted reproductive technology and birth defects: a systematic review and Meta-analysis[J]. Hum Reprod Update, 2013, 19(4): 330-353. DOI:10.1093/humupd/dmt006 |
| [7] |
Yeung EH, Druschel C. Cardiometabolic health of children conceived by assisted reproductive technologies[J]. Fertil Steril, 2013, 99(2): 318-326. DOI:10.1016/j.fertnstert.2012.12.015 |
| [8] |
Scherrer U, Rexhaj E, Allemann Y, et al. Cardiovascular dysfunction in children conceived by assisted reproductive technologies[J]. Eur Heart J, 2015, 36(25): 1583-1589. DOI:10.1093/eurheartj/ehv145 |
| [9] |
Padhee M, Zhang S, Lie S, et al. The periconceptional environment and cardiovascular disease: does in vitro embryo culture and transfer influence cardiovascular development and health?[J]. Nutrients, 2015, 7(3): 1378-1425. DOI:10.3390/nu7031378 |
| [10] |
Chen M, Heilbronn LK. The health outcomes of human offspring conceived by assisted reproductive technologies(ART)[J]. J Dev Orig Health Dis, 2017, 8(4): 388-402. DOI:10.1017/S2040174417000228 |
| [11] |
Tylavsky FA, Ferrara A, Catellier DJ, et al. Understanding childhood obesity in the US: the NIH environmental influences on child health outcomes (ECHO) program[J]. Int J Obes (Lond), 2020, 44(3): 617-627. DOI:10.1038/s41366-019-0470-5 |
| [12] |
Jaddoe VW, van Duijn CM, Franco OH, et al. The Generation R Study: design and cohort update 2012[J]. Eur J Epidemiol, 2012, 27(9): 739-756. DOI:10.1007/s10654-012-9735-1 |
| [13] |
Golding J, ALSPAC Study Team. The Avon Longitudinal Study of Parents and Children (ALSPAC)-study design and collaborative opportunities[J]. Eur J Endocrinol, 2004, 151 Suppl 3: U119-123. DOI:10.1530/eje.0.151u119 |
| [14] |
Tao FB, Hao JH, Huang K, et al. Cohort Profile: the China-Anhui Birth Cohort Study[J]. Int J Epidemiol, 2013, 42(3): 709-721. DOI:10.1093/ije/dys085 |
| [15] |
Zhang J, Tian Y, Wang W, et al. Cohort profile: the Shanghai Birth Cohort[J]. Int J Epidemiol, 2019, 48(1): 21-21g. DOI:10.1093/ije/dyy277 |
| [16] |
Messerlian C, Williams PL, Ford JB, et al. The Environment and Reproductive Health (EARTH) Study: A Prospective Preconception Cohort[J]. Hum Reprod Open, 2018, 2018(2): hoy001. DOI:10.1093/hropen/hoy001 |
| [17] |
Buck Louis GM, Hediger ML, Bell EM, et al. Methodology for establishing a population-based birth cohort focusing on couple fertility and children's development, the Upstate KIDS Study[J]. Paediatr Perinat Epidemiol, 2014, 28(3): 191-202. DOI:10.1111/ppe.12121 |
 2021, Vol. 42
2021, Vol. 42