文章信息
- 朱猛, 吕筠, 余灿清, 黄艳倩, 马红霞, 靳光付, 郭彧, 裴培, 陈铮鸣, 沈洪兵, 胡志斌, 李立明, 代表中国慢性病前膽性研究项目协作组.
- Zhu Meng, Lyu Jun, Yu Canqing, Huang Yanqian, Ma Hongxia, Jin Guangfu, Guo Yu, Pei Pei, Chen Zhengming, Shen Hongbing, Hu Zhibin, Li Liming, for the China Kadoorie Biobank Collaborative Group
- 多基因遗传风险评分指导肺癌个体化筛查的前瞻性队列研究
- Polygenic risk score in personalized screening of lung cancer: a prospective cohort study in Chinese
- 中华流行病学杂志, 2021, 42(3): 376-381
- Chinese Journal of Epidemiology, 2021, 42(3): 376-381
- http://dx.doi.org/10.3760/cma.j.cn112338-20210107-00013
-
文章历史
收稿日期: 2021-01-07
2. 北京大学公共卫生学院/北京大学公众健康与重大疫情防控战略研究中心 100191;
3. 中国医学科学院, 北京 100730;
4. 英国牛津大学临床与流行病学研究中心纳菲尔德人群健康系 OX3 7LF
2. School of Public Health, Peking University/Peking University Center for Public Health and Epidemic Preparedness and Response, Beijing 100191, China;
3. Chinese Academy of Medical Sciences, Beijing 100730, China;
4. Clinical Trial Service Unit and Epidemiological Studies Unit, Nuffield Department of Population Health, University of Oxford, Oxford OX3 7LF, United Kingdom
肺癌是全球负担最重的恶性肿瘤之一。据全球癌症统计报告估计,2018年全球新发肺癌病例约209万,占全肿瘤的11.6%,肺癌死亡病例约176万,占肿瘤相关死亡的18.4%[1]。我国肺癌发病率较高,基于中国肿瘤登记中心数据显示,2015年我国预计新发肺癌78.7万例,其中男性52.0万例,女性26.7万例;肺癌死亡63.1万例,其中男性43.3万例,女性19.7万例;全球超过三分之一的肺癌发病和死亡发生在我国[2]。肺癌是预后最差的恶性肿瘤之一,基于全球61个国家的预后数据显示,目前肺癌5年生存率仅有10%~20%[3]。尽管在过去的几十年中,我国肺癌的诊疗水平取得了长足的进步,但目前肺癌预后仍然较差,5年生存率仅有23.8%[4]。
提高肺癌的早诊率是进一步改善肺癌预后的关键。美国国家肺癌筛查试验(NLST)和荷兰-比利时肺癌筛查试验(NELSON)均表明,对肺癌高危人群进行低剂量螺旋CT(LDCT)筛查,可以发现更多的早期肺癌患者,及时进行干预,降低肺癌死亡率[5-6]。基于这些研究结果,目前多项国际指南及学会共识已将LDCT肺癌筛查写入推荐指南,指南中通常将高危人群界定为年龄55~74岁,吸烟≥30包/年,戒烟时间 < 15年;或年龄≥50岁,吸烟≥20包/年,合并一项额外的危险因素(除二手烟以外)[7]。
前期研究中,本团队首次发现根据19个遗传变异位点建立的肺癌多基因遗传风险评分(PRS-19)可前瞻性预测个体的肺癌发病风险,与低遗传风险人群相比,高遗传风险人群在10年队列随访期间肺癌发病率增加了96%[8]。然而,如何根据个体的遗传风险评分,制定个体化的肺癌筛查方案,目前尚无相关报道。因此,本研究拟基于中国慢性病前瞻性研究(China Kadoorie Biobank,CKB),系统探讨不同遗传风险人群的适宜筛查方案,进一步提高我国肺癌的诊疗水平。
对象与方法1. 研究对象:本研究数据来自CKB项目于2004-2008年在中国10个地区开展的基线调查数据,包括5个城市地区和5个农村地区,详细介绍见参考文献[9-10]。本研究纳入的研究对象为既往未被诊断为肺癌且具有基因分型信息的100 615名研究对象。
2. 研究内容:根据问卷调查获得研究对象的一般人口社会学信息(年龄、性别、文化程度、居住地区等)、病史家族史信息(肿瘤病史、慢性阻塞性肺疾病史和肿瘤家族史)、以及详细的吸烟信息(吸烟状态、起始吸烟年龄、每天吸烟支数和戒烟时长);通过体格检查获得研究对象的身高、体重、以及肺功能等信息;使用项目组自主设计的Affymetrix Axiom® CKB array芯片进行基因分型,经过系统质量控制后使用IMPUTE4和IMPUTE2软件进行全基因组基因型填补。
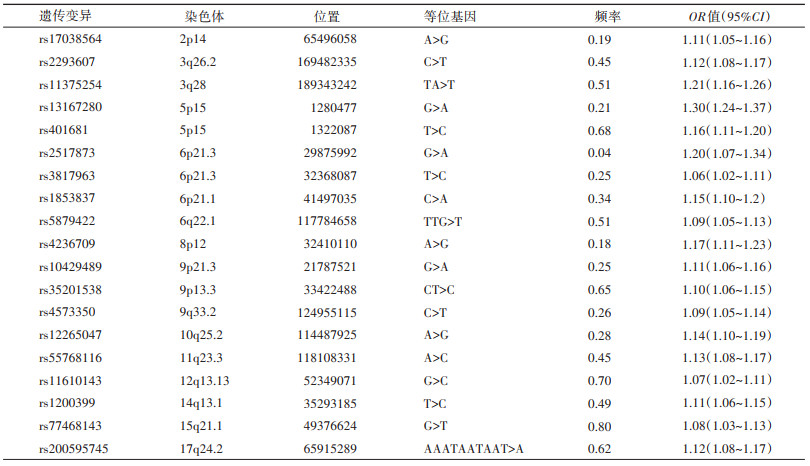
填补后基因组数据库中,使用PLINK2提取rs17038564、rs2293607、rs11375254、rs13167280、rs401681、rs2517873、rs3817963、rs1853837、rs5879422、rs4236709、rs10429489、rs35201538、rs4573350、rs12265047、rs55768116、rs11610143、rs1200399、rs77468143、rs200595745共19个肺癌遗传易感位点的基因型信息,根据每个遗传位点的效应ln(OR)加权求和后计算个体的肺癌多基因遗传风险评分PRS-19(表 1)[8]。
3. 研究方案:参考国际肺癌筛查的高危人群界定标准,在CKB队列中计算55岁、吸烟量为30包/年人群未来5年发生肺癌的绝对发病风险,并以此为参考界值;在吸烟人群中,在吸烟量保持30包/年不变的前提下,计算不同遗传风险人群达到该界值的最低年龄,以此作为建议的筛查起始年龄;同时计算若保持筛查起始年龄55岁不变,不同遗传风险人群达到该临界值的最低吸烟剂量。尽管目前尚无针对非吸烟人群的筛查建议,但是考虑到我国非吸烟人群发病率不断增加,我们计算了不同遗传风险的非吸烟者未来5年发生肺癌的绝对风险,并据此评估我国非吸烟人群是否具有纳入筛查的价值。最后,根据上述结果给出不同遗传风险人群参加肺癌筛查起始年龄的具体建议。
4. 统计学分析:本研究的统计分析在吸烟者和非吸烟者中分别进行,使用rstpm2 R包的柔性参数生存模型(flexible parametric survival models)计算不同条件下研究对象5年内肺癌发病的绝对风险,调整年龄、性别、居住地区、个人肿瘤史、肿瘤家族史、慢性阻塞性肺疾病史、BMI、1秒最大呼气量、以及详细的吸烟信息[11]。根据研究对象遗传风险评分的99%、95%、90%、80%、50%、20%、10%、5%、1%将研究对象分为不同遗传风险人群,分别计算其5年肺癌绝对发病风险。使用R软件(版本号3.5.1)进行数据分析及绘图。
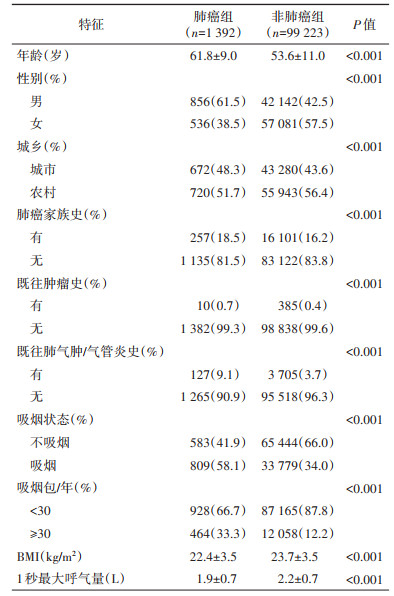
结果1. 一般情况:队列中位随访时间为10.4年,期间新发肺癌患者1 392例。与未发生肺癌者比,新发肺癌患者平均年龄更高,男性、城市居住者、有肿瘤史和家族史者、慢性阻塞性肺疾病患者、吸烟者所占比例更高,而肺功能和BMI更小(表 2)。
2. 不同遗传风险吸烟者的筛查起始年龄:基于CKB队列,当吸烟量为30包/年时,55岁吸烟者在5年内发生肺癌的绝对风险为0.67%(图 1)。若吸烟量为30包/年,对于遗传风险最高的1%人群,50岁时5年绝对发病风险可达0.67%;最高5%的人群,52岁时5年绝对发病风险可达该界值。而对于遗传风险最低的1%人群,年龄达到60岁时5年绝对发病风险才能达到0.67%;最低5%的人群,59岁时才能达到该届值。
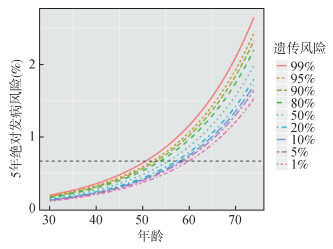
|
| 图 1 不同遗传风险吸烟人群5年绝对发病风险随年龄变化分布 |
3. 不同遗传风险吸烟者的累积吸烟剂量:若要求肺癌筛查年龄从55岁开始,对于遗传风险最高的1%人群,不管累积吸烟剂量为多少都应纳入肺癌筛查;而对于遗传风险最高的5%人群,当累积吸烟达到9包/年时即可纳入筛查。而对于遗传风险最低的1%人群,吸烟量达到59包/年,其5年绝对发病风险才可达到0.67%;而最低5%的人群,吸烟量需要达到51包/年,其5年绝对发病风险才能达到筛查界值(图 2)。
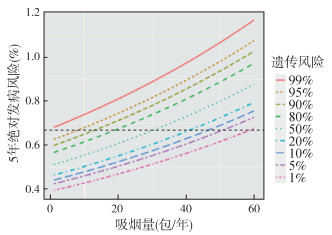
|
| 图 2 不同遗传风险人群5年绝对发病风险随吸烟剂量变化分布 |
4. 不同遗传风险非吸烟者的筛查起始年龄:尽管非吸烟者5年肺癌发病风险明显低于吸烟者,但是我们发现遗传风险最高的1%人群,即使不吸烟,当年龄达到62岁时肺癌的5年绝对发病风险可达0.67%;对于遗传风险最高的5%人群,当达到64岁时肺癌的5年绝对发病风险即可达到筛查界值。而对于遗传风险最低的5%人群,当年龄达到74岁,5年绝对发病风险才能达到筛查届值(图 3)。
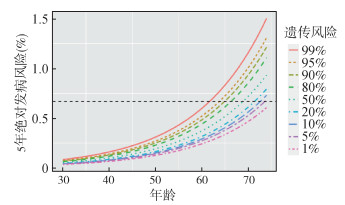
|
| 图 3 不同遗传风险非吸烟人群5年绝对发病风险随年龄变化分布 |
5. 不同遗传风险人群肺癌个体化筛查建议:根据上述计算结果,绘制了不同遗传评分人群建议的肺癌筛查起始年龄分布图(图 4)。在吸烟者中,根据个体遗传风险评分的变化,建议筛查起始年龄从50~60岁不等。而对于我国非吸烟人群,若同样将5年绝对风险定为0.67%不变,则部分非吸烟人群同样具有筛查价值。对于遗传风险评分最高的10%人群,建议可在65岁前进行肺癌筛查;对于遗传风险评分在50%~90%的人群,建议筛查起始年龄在65~69岁之间;对于遗传风险评分在5%~50%的人群,建议筛查起始年龄在69~74岁之间;而对于遗传风险评分最低的5%人群,建议筛查起始年龄为74岁。
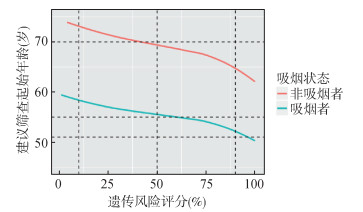
|
| 图 4 不同遗传风险人群建议筛查起始年龄 |
尽管国内外多项临床试验已经表明LDCT筛查可以降低肺癌死亡率,但是NLST试验后续分析表明,所有受试对象中风险最低的20%人群仅占筛查总获益的1%,而风险最高的60%人群占筛查总获益的88%[12]。因此,根据个体的发病风险进行风险分层,制定个体化的筛查方案,是提高肺癌筛查效率的有效途径。本研究基于我国最大的前瞻性研究队列,系统评价了不同遗传风险人群的筛查方案,为优化我国肺癌筛查策略提供了参考。
目前我国将“年龄50~74岁,吸烟30包/年,且戒烟15年以内”作为肺癌高危人群定义的主要标准[13],但是吸烟与肺癌在欧美人群中的关联强度可达7~15,而在中国人群中仅有2~3[14]。此外,在东亚地区(包括中国)超过三分之一的肺癌患者为非吸烟人群,且这一比例正呈逐年上升趋势。因此,在中国人群中开展肺癌筛查多中心临床试验,制定符合我国国情的高危人群界定标准,提供基于中国人群的临床试验证据极为重要且迫切。基于前瞻性队列的分析结果,有望为我国肺癌筛查临床试验的设计以及高危人群的定义提供参考,对于遗传高风险人群,可适当减小年龄或降低吸烟剂量作为入组标准。
非吸烟人群是否应纳入筛查是我们亟须解决的重要挑战之一。由于欧美人群中非吸烟肺癌发病率极低,因此国外的临床试验均未将非吸烟者纳入肺癌筛查。然而,包括我国在内的东亚国家近年来非吸烟人群肺癌发病率正呈逐年升高趋势,且非吸烟人群肺癌发病率显著高于欧美人群[15]。基于CKB前瞻性队列研究,我们发现尽管我国非吸烟者的绝对发病风险显著低于吸烟者,但在遗传高风险人群中当年龄增加到>62岁时,5年绝对发病风险与55岁吸烟者相当,提示这部分人群同样具有纳入肺癌筛查的潜在价值。因此,在未来的肺癌筛查临床试验中,纳入高遗传风险的非吸烟者作为研究对象,有望提供适合我国国情的临床试验证据。
基于个人的危险/保护因素暴露信息,构建风险预测模型,预测其在未来一定的时间内发生某结局的概率,可以更加充分的利用多维变量信息,提升高危人群的富集效率。2017年,Tammemagi等[16]在肺癌PLCOm2012预测模型的基础上,纳入了年龄、文化程度、肺癌家族史、BMI、慢性阻塞性肺疾病病史、胸部X线检查史以及吸烟信息构建了PanCan预测模型,并使用该模型募集了2 537例6年绝对风险>2%的人群进行肺癌筛查,经过5.5年随访,新发肺癌172例,肺癌发病率高达1 381/10万人年,显著的高于NLST(645/10万人年)。但无论是PLCOm2012预测模型还是PanCan预测模型仅纳入了肺癌家族史作为预测变量,而我们的研究表明,即使调整了肿瘤家族史信息,肺癌多基因遗传风险评分仍然是一个有效的预测指标。因此,纳入宏观预测变量和肺癌多基因遗传风险评分构建肺癌风险预测模型,有望进一步改善模型的预测效果,提升肺癌高危人群的富集能力。
综上所述,本研究基于中国最大的慢性病前瞻性研究队列,系统评价了肺癌多基因遗传风险评分在未来肺癌筛查中的潜在应用价值。结果表明,对于不同遗传风险的个体,可采用个体化的肺癌筛查方案,对于高遗传风险的吸烟者,可减小肺癌筛查起始年龄或降低吸烟剂量;此外,高遗传风险的非吸烟者同样具有纳入肺癌筛查的价值。上述研究结果为建立适宜我国基本国情的肺癌筛查方案,富集肺癌筛查高危人群提供了重要参考。
利益冲突 所有作者均声明不存在利益冲突。
志谢 感谢所有CKB项目的成员和现场调查员;感谢项目管理委员会、国家项目办公室、牛津协作中心和10个项目地区办公室的所有工作人员
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [3] |
Allemani C, Matsuda T, di Carlo V, et al. Global surveillance of trends in cancer survival 2000-14(CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries[J]. Lancet, 2018, 391(10125): 1023-1075. DOI:10.1016/s0140-6736(17)33326-3 |
| [4] |
Zeng H, Chen W, Zheng R, et al. Changing cancer survival in China during 2003-15:a pooled analysis of 17 population-based cancer registries[J]. Lancet Glob Health, 2018, 6(5): e555-567. DOI:10.1016/s2214-109x(18)30127-x |
| [5] |
Aberle DR, Adams AM, Berg CD, et al. Reduced lung-cancer mortality with low-dose computed tomographic screening[J]. NEJM, 2011, 365(5): 395-409. DOI:10.1056/NEJMoa1102873 |
| [6] |
de Koning HJ, van der Aalst CM, de Jong PA, et al. Reduced lung-cancer mortality with volume ct screening in a randomized trial[J]. NEJM, 2020, 382(6): 503-513. DOI:10.1056/NEJMoa1911793 |
| [7] |
Care CTFoPH. Recommendations on screening for lung cancer[J]. CMAJ, 2016, 188(6): 425-432. DOI:10.1503/cmaj.151421 |
| [8] |
Dai J, Lv J, Zhu M, et al. Identification of risk loci and a polygenic risk score for lung cancer: a large-scale prospective cohort study in Chinese populations[J]. Lancet Respir Med, 2019, 7(10): 881-891. DOI:10.1016/S2213-2600(19)30144-4 |
| [9] |
Chen Z, Lee L, Chen J, et al. Cohort profile: the Kadoorie Study of Chronic Disease in China (KSCDC)[J]. Int J Epidemiol, 2005, 34(6): 1243-1249. DOI:10.1093/ije/dyi174 |
| [10] |
李立明, 吕筠, 郭彧, 等. 中国慢性病前瞻性研究: 研究方法和调查对象的基线特征[J]. 中华流行病学杂志, 2012, 33(3): 249-255. Li LM, Lyu J, Guo Y, et al. The China Kadoorie Biobank: related methodology and baseline characteristics of the participants[J]. Chin J Epidemol, 2012, 33(3): 249-255. DOI:10.3760/cma.j.issn.0254-6450.2012.03.001 |
| [11] |
Muller DC, Johansson M, Brennan P. Lung Cancer Risk Prediction Model Incorporating Lung Function: Development and Validation in the UK Biobank Prospective Cohort Study[J]. J Clin Oncol, 2017, 35(8): 861-869. DOI:10.1200/JCO.2016.69.2467 |
| [12] |
Kovalchik SA, Tammemagi M, Berg CD, et al. Targeting of low-dose CT screening according to the risk of lung-cancer death[J]. NEJM, 2013, 369(3): 245-254. DOI:10.1056/NEJMoa1301851 |
| [13] |
中华预防医学会. 中国肺癌筛查标准(T/CPMA 013-2020)[J]. 中华肿瘤杂志, 2021, 43(1): 1-7. Chinese Preventive Medicine Association. Lung cancer screening guideline of China (T/CPMA 013-2020)[J]. Chin J Oncol, 2021, 43(1): 1-7. DOI:10.3760/cma.j.cn112152-20210106-00019 |
| [14] |
Pesch B, Kendzia B, Gustavsson P, et al. Cigarette smoking and lung cancer-relative risk estimates for the major histological types from a pooled analysis of case-control studies[J]. Int J Cancer, 2012, 131(5): 1210-1219. DOI:10.1002/ijc.27339 |
| [15] |
Jenks S. Is lung cancer incidence increasing in never-smokers?[J]. JNCI, 2016, 108(1). DOI:10.1093/jnci/djv418 |
| [16] |
Tammemagi MC, Schmidt H, Martel S, et al. Participant selection for lung cancer screening by risk modelling (the Pan-Canadian Early Detection of Lung Cancer[J]. Lancet Oncol, 2017, 18(11): 1523-1531. DOI:10.1016/S1470-2045(17)30597-1 |
 2021, Vol. 42
2021, Vol. 42