文章信息
- 齐玥, 刘静, 王淼, 孙佳艺, 刘军, 邓秋菊, 赵冬.
- Qi Yue, Liu Jing, Wang Miao, Sun Jiayi, Liu Jun, Deng Qiuju, Zhao Dong
- 携带载脂蛋白E的HDL-C与冠心病发病风险的前瞻性队列研究
- Association between apolipoprotein E-containing HDL-C and coronary heart disease risk: a community-based cohort study
- 中华流行病学杂志, 2021, 42(2): 297-302
- Chinese Journal of Epidemiology, 2021, 42(2): 297-302
- http://dx.doi.org/10.3760/cma.j.cn112338-20200310-00302
-
文章历史
收稿日期: 2020-03-10
既往大量观察性研究发现HDL-C水平降低是动脉粥样硬化性心血管疾病事件发生的独立危险因素[1]。但以升高HDL-C为靶标来降低动脉粥样硬化性心血管疾病风险的大型随机对照药物临床试验均未能在降低心血管病风险方面获益[2-4]。事实上,HDL是血液中组成最复杂的一类脂蛋白,而载脂蛋白是HDL代谢及发挥抗动脉粥样硬化作用的重要决定因素[5-6]。除HDL的结构蛋白载脂蛋白A1(APOA1)外,载脂蛋白E(APOE)可参与HDL合成,促进盘状和球状HDL颗粒的形成和成熟,其途径与载脂蛋白APOA1相同且独立于APOA1[7]。根据是否携带载脂蛋白APOE可将HDL-C分为携带APOE的HDL-C(APOE-HDL-C)和不携带APOE的HDL-C,在健康个体内,APOE-HDL-C占总HDL-C不足10%[8]。APOE可促进HDL对体外脂质累积巨噬细胞的胆固醇外流能力[9]。欧美人群的横断面研究显示APOE-HDL-C与冠心病和脑卒中患病有关[10],但这些研究样本量较小且目前缺乏自然人群研究。本研究通过社区人群队列研究,分析APOE-HDL-C水平与10年冠心病发生风险的关系,旨在为识别心血管病高危个体、寻找新的HDL相关干预靶点、尽早有针对性地采取防治措施、遏制动脉粥样硬化的进展,从而延缓或避免心血管病终末事件的发生提供依据。
对象与方法1. 研究对象:来自中国多省市心血管病队列研究(Chinese Multi-provincial Cohort Study,CMCS)[11]。该研究从1992-1993年入选全国11省市35~64岁16 811名无心血管病的人群进行危险因素调查,在“八五”课题结束后3个省市2 440名调查人群退出,其余省市人群随访至2013年12月31日,随访观察期间所纳入的各队列人群均未接受过有关心血管疾病及其危险因素的人群干预研究。北京地区研究人群于2002年参加了第二次危险因素调查,其余5个省份(天津、上海、辽宁、四川、黑龙江)研究人群于2007年进行了第二次危险因素调查。本研究是CMCS研究的一部分,入选参加第二次危险因素调查的6 226名研究对象作为本研究基线,排除基线有心血管病者312名,第二次危险因素调查至随访结束时失访者421名,无血标本者17名,HDL-C相关指标等数据不完整者59名,最终共纳入5 417名研究对象。本研究方案通过首都医科大学附属北京安贞医院伦理委员会审查(批准文号:ks2019029),所有研究对象均签署知情同意书。
2. 研究方法:基线调查均严格按工作手册统一要求进行,调查人员均经过统一培训,主要包括问卷调查、体格检查和实验室检查。采用统一的调查问卷收集人口学信息、心血管病史、吸烟史和服药情况等。体格检查包括血压、身高、体重等。采集研究人群空腹 > 8 h的静脉血,采血后3 h内1 760 g离心20 min,分离血标本进行分装。采血当天使用新鲜血清测定TC、LDL-C、HDL-C、TG、FPG和高敏C反应蛋白水平等。其中,TC、TG、FPG的测定采用酶法,LDL-C和HDL-C的测定采用匀相法。高敏C反应蛋白的测定采用免疫透射比浊法。其他分装血标本置于-80 ℃冰箱冷冻保存。2015年采用日本生研公司的消除法试剂在日立7180型全自动生化分析仪上检测APOE-HDL-C水平[8]。高值质控批间变异系数为1.53%,低值质控批间变异系数为1.33%。计算APOE-HDL-C/总HDL-C比值,评估APOE-HDL-C在总HDL-C中的相对比例。
3. 指标定义及分组:①高血压定义为SBP≥140 mmHg(1 mmHg=0.133 kPa)和/或DBP≥90 mmHg,或调查前2周内口服降压药物。②吸烟定义为每天至少吸1支烟。③糖尿病定义为FPG水平≥7 mmol/L或既往明确诊断有糖尿病。④BMI定义为体重(kg)与身高平方(m2)的比。⑤按照基线调查中研究对象的HDL-C相关指标水平,包括总HDL-C水平、APOE-HDL-C水平和APOE-HDL-C/总HDL-C比值等,将研究人群分组。HDL-C相关指标分组:参考MS诊断标准中HDL-C分组标准作为第1组的分组切点定义标准[12],其后采用等步长方法(每增加10 mg/dl)定义其余分组切点,HDL-C分组切点:男性:< 40、40~、50~、≥60 mg/dl;女性:< 50、50~、60~、≥70 mg/dl。APOE-HDL-C分组切点:男性 < 4.0、4.0~、5.0~、≥6.0 mg/dl;女性 < 5.0、5.0~、6.0~、≥7.0 mg/dl。APOE-HDL-C/总HDL-C比值按四分位分组的切点:< 8.6%、8.6%~、9.3%~、≥10.0%。
4. 急性冠心病事件收集:从基线调查开始,每1~2年对入选人群进行1次随访,截至2013年12月31日,随访率为81.0%。随访的观察终点为急性冠心病事件,包括急性心肌梗死、冠心病猝死和其他冠心病死亡。
5. 统计学分析:正态分布的连续变量以x±s表示。非正态分布的连续变量以P50(P25,P75)表示。分类资料以频数(构成比)表示。HDL-C相关指标及其与其他变量的相关分析采用经年龄和性别校正的Pearson相关分析(非正态分布变量先进行对数转换)。急性冠心病事件的绝对发病风险采用人年发病率表示。本研究的随访人年从研究对象完成基线调查的时间开始算起,到最早出现急性冠心病事件时间、失访或2013年12月31日为止。发病密度组间差异的比较采用χ2检验。采用Cox比例风险模型分析HDL-C相关指标与冠心病发病风险的风险比(HR)值及其95%CI,并对已知或可能影响发病风险的因素进行调整,包括年龄(每增加5岁)、性别、BMI、吸烟、SBP(每增加10 mmHg)、LDL-C(每增加30 mg/dl)、糖尿病、口服调脂药物、对数转换TG、对数转换高敏C反应蛋白、地区(北京市、外省市)。建立冠心病发病风险的预测模型,并通过预测模型计算不同HDL-C相关指标分层下的个体冠心病发病绝对风险,模型中选择Cox比例风险模型中的所有调整因素。在不同心血管危险因素水平下,进行APOE-HDL-C/总HDL-C比值最高四分位与最低四分位的冠心病发病风险的亚组分析。为避免基线急性冠心病事件和其他潜在疾病可能导致的反向因果关系,通过剔除随访第一年内发生的病例进行敏感性分析。数据分析采用SAS 9.4软件,取双侧检验,以P < 0.05为差异有统计学意义。
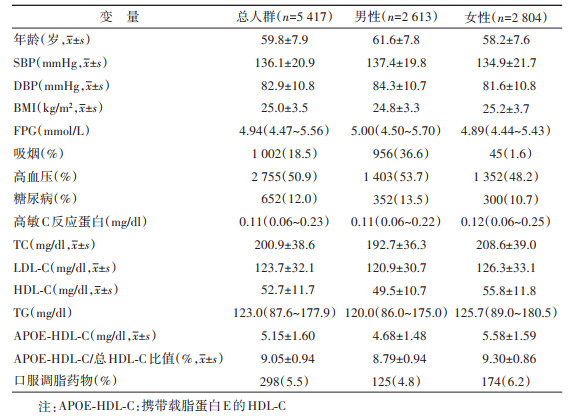
结果1. 基线特征:研究人群年龄为(59.8±7.9)岁,其中女性2 804人(51.8%)。基线总HDL-C、APOE-HDL-C水平分别为(52.7±11.7)mg/dl和(5.15±1.60)mg/dl。APOE-HDL-C/总HDL-C比值为9.05%±0.94%。见表 1。
2. 相关性分析:基线HDL-C与APOE-HDL-C水平(r=0.978,P < 0.001)、APOE-HDL-C/总HDL-C比值(r=0.604,P < 0.001)均呈显著正相关。APOE-HDL-C与其他因素间的相关性与总HDL-C相同。如APOE-HDL-C与TC(r=0.419,P < 0.001)、LDL-C(r=0.208,P < 0.001)呈正相关,与TG(r=-0.301,P < 0.001)呈负相关。但APOE-HDL-C/总HDL-C比值则有所区别,其与TG呈正相关(r=0.113,P < 0.001),与血糖、血压等无关。
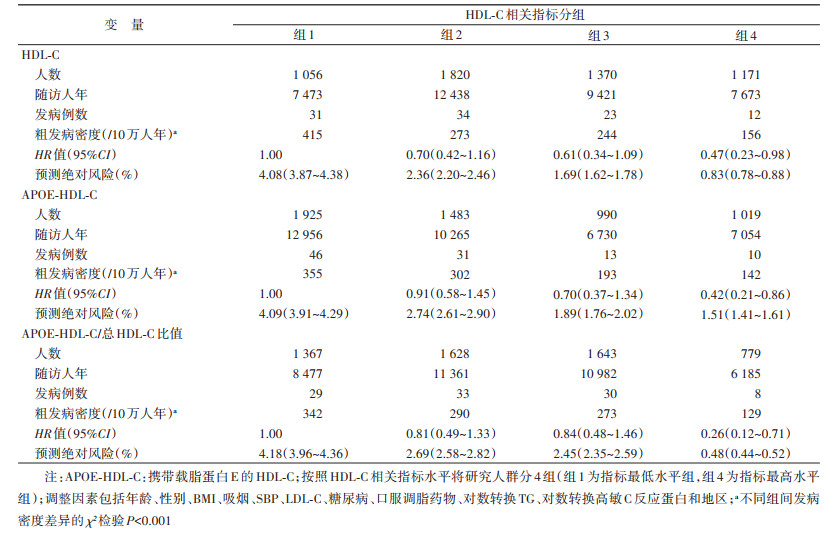
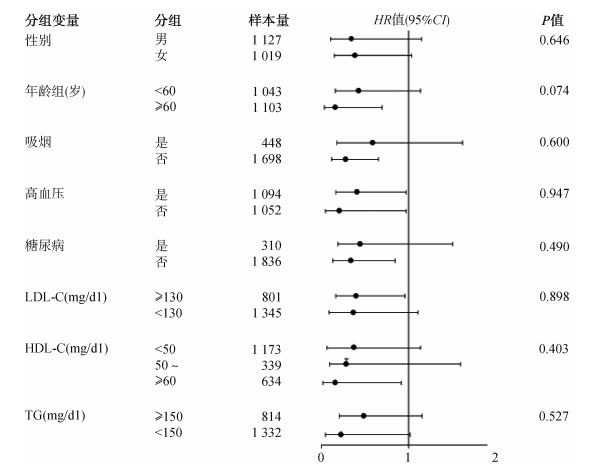
3. HDL-C相关指标与冠心病发病风险的关联:队列人群随访(6.8±3.1)年,累计随访37 005人年。随访期间共发生急性冠心病事件100例,粗发病密度为270/10万人年。随着HDL-C相关指标水平的升高,急性冠心病事件发病密度降低,其中APOE-HDL-C/总HDL-C比值最高组冠心病事件发病密度最低,为129/10万人年(表 2)。在控制潜在混杂因素后,Cox比例风险模型分析结果显示:HDL-C、APOE-HDL-C、APOE-HDL-C/总HDL-C比值等每增加相应的一个标准差,相关的急性冠心病事件发病的HR值(95%CI)分别为0.78(0.62~0.98)、0.78(0.62~0.98)、0.75(0.61~0.93)。与HDL-C相关指标最低分位组相比(表 2),HDL-C、APOE-HDL-C、APOE-HDL-C/总HDL-C比值最高分位组的急性冠心病事件发病的HR值(95%CI)分别为0.47(0.23~0.98)、0.42(0.21~0.86)、0.26(0.12~0.71)。进一步在APOE-HDL-C/总HDL-C多因素Cox比例风险模型中调整HDL-C,结果显示,与APOE-HDL-C/总HDL-C比值最低分位组相比,APOE-HDL-C/总HDL-C比值最高分位组的急性冠心病事件发病风险降低75%(HR=0.25,95%CI:0.10~0.58)。亚组分析显示(图 1),APOE-HDL-C/总HDL-C比值与急性冠心病事件发病风险在不同心血管危险因素水平下均呈负相关。剔除随访第一年发生的病例后进行敏感性分析,结果显示APOE-HDL-C/总HDL-C比值与冠心病发病风险关联未发生显著改变。
|
| 注:APOE-HDL-C:携带载脂蛋白E的HDL-C;调整因素包括年龄、性别、BMI、吸烟、SBP、LDL-C、糖尿病、口服调脂药物、对数转换TG、对数转换高敏C反应蛋白和地区 图 1 不同心血管危险因素水平下APOE-HDL-C/总HDL-C比值与冠心病发病风险的关系 |
4. 不同HDL-C相关指标分层下个体冠心病发病绝对风险:通过预测模型计算不同HDL-C相关指标分层下的个体冠心病发病绝对风险,结果显示,APOE-HDL-C/总HDL-C比值最高分位组的个体冠心病预测发病绝对风险最低,为0.48%(0.44%~0.52%),显著低于HDL-C最高分位组个体冠心病预测发病绝对风险[0.83%(0.78%~0.88%)]。见表 2。
讨论本研究在中国多省市心血管病研究队列中分析APOE-HDL-C与急性冠心病事件发病风险的关联。结果显示,基线APOE-HDL-C/总HDL-C比值最高者,急性冠心病事件发病风险显著降低,APOE-HDL-C/总HDL-C比值与急性冠心病事件发病风险关联强于总HDL-C。
已有研究结果提示APOE-HDL-C与冠心病和脑卒中患病相关。一项英国病例-对照研究显示,与男性正常对照组个体相比,男性心肌梗死存活患者的APOE-HDL-C显著降低[10]。但美国一项病例-对照研究应用蛋白质组学检测发现冠心病患者HDL中富集APOE[13]。前期研究对APOE-HDL-C与动脉粥样硬化性心血管病研究结论不一致,且研究样本量较小,缺乏自然人群研究。前期本团队在1 112名北京地区的社区人群中发现,APOE-HDL-C水平升高可显著降低冠心病发病风险[14],但其关联强度是否高于HDL-C尚不明确。为进一步明确APOE-HDL-C与冠心病发病风险的关系,以及其预测能力是否优于HDL-C,本研究在5 417例大样本前瞻性研究队列中探索上述关联。结果发现,APOE-HDL-C/总HDL-C比值与冠心病发病风险显著关联,APOE-HDL-C/总HDL-C比值最高分位组的急性冠心病事件发病风险降低74%,个体冠心病预测发病绝对风险最低,显著低于HDL-C最高水平组的冠心病预测发病绝对风险,提示基线APOE-HDL-C/总HDL-C比值与急性冠心病事件发病风险显著负相关,且预测作用优于总HDL-C。APOE-HDL-C可作为反映HDL抗动脉粥样硬化功能的新生物标志物。
本研究虽然显示APOE-HDL-C与心血管病事件的发生有关,但心血管病事件只是动脉粥样硬化过程的临床终末表现。在临床事件发生前,血管壁的动脉粥样硬化性病理改变已经存在[15]。临床试验研究SATURN在美国冠心病患者中应用瑞舒伐他汀治疗后发现[16],APOE-HDL-C水平增高与血管内超声测量的动脉瘤容积减小显著相关。由于欧美研究仅有一次动脉粥样硬化测量结果,无法阐明二者的因果关系。APOE-HDL-C是否在心血管病临床终末事件发生前的早期就已经开始影响血管床动脉粥样硬化病理改变尚需进一步研究证实。
临床研究中由于人群样本的异质性,其他疾病危险因素的干扰,更重要的是无伤害原则,在不能进行随机干预时,大多临床研究只能得到相关性的结果。要明确HDL携带的APOE是否有抗动脉粥样硬化功能,尚需在疾病动物模型上进行研究。有研究者在载脂蛋白APOA1和APOE双敲除小鼠模型中通过腺病毒分别转染载脂蛋白APOE3或APOA1观察到[17],“含APOE3但不含APOA1的HDL颗粒”与两种载脂蛋白均缺失的HDL颗粒相比,小鼠RAW264.7单核巨噬细胞的胆固醇流出能力无差异。然而近期研究者在人THP1细胞中观察到,HDL颗粒携带的APOE可促进其体外脂质累积THP1巨噬细胞的胆固醇外流能力[9]。因此APOE对HDL逆转运功能的影响尚不明确,尚需进一步研究证实。
本研究采用了一种新研发的APOE-HDL-C检测方法[8]。而既往研究较多采用酶联免疫吸附或蛋白质组学检测方法,实际操作复杂且重复性较低,较难应用于大型队列研究或临床使用。而本研究采用的消除法,在全自动生化分析仪上检测APOE-HDL-C水平,精密度、选择性、重复性及检测通量均较高,更适用于大型流行病学研究。分析中虽然考虑了已知或可能的混杂因素,但还存在一些未知原因或未能检测的因素,如调脂药物类型等,可能对研究结果造成一定影响。HDL-C相关指标仅有一次测量,因此研究无法排除研究指标个体内变异及动态变化对研究结果的影响。本研究为队列研究,失访人群可能会对研究结果造成一定的偏倚。对失访人群和最终纳入人群的基线血脂水平进行了比较,未发现明显差异。
综上所述,APOE-HDL-C/总HDL-C比值与急性冠心病事件发生风险显著负相关,且其关联强度明显高于总HDL-C水平,提示APOE-HDL-C是更能反映HDL功能的新标志物。探索APOE-HDL-C与动脉粥样硬化间的关系,或许有助于阐明HDL-C在动脉粥样硬化形成中的作用机制,指引未来通过识别心血管病高危个体,尽早有针对性地采取新的HDL-C相关干预措施来减少动脉粥样硬化形成。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
The Emerging Risk Factors Collaboration. Major lipids, apolipoproteins, and risk of vascular disease[J]. JAMA, 2009, 302(18): 1993-2000. DOI:10.1001/jama.2009.1619 |
| [2] |
Lincoff AM, Nicholls SJ, Riesmeyer JS, et al. Evacetrapib and cardiovascular outcomes in high-risk vascular disease[J]. N Engl J Med, 2017, 376(20): 1933-1942. DOI:10.1056/NEJMoa1609581 |
| [3] |
The HPS3/TIMI55-REVEAL Collaborative Group. Effects of anacetrapib in patients with atherosclerotic vascular disease[J]. N Engl J Med, 2017, 377(13): 1217-1227. DOI:10.1056/NEJMoa1706444 |
| [4] |
Keene D, Price C, Shun-Shin MJ, et al. Effect on cardiovascular risk of high density lipoprotein targeted drug treatments niacin, fibrates, and CETP inhibitors: Meta-analysis of randomised controlled trials including 117411 patients[J]. BMJ, 2014, 349: g4379. DOI:10.1136/bmj.g4379 |
| [5] |
Kingwell BA, Chapman MJ, Kontush A, et al. HDL-targeted therapies: Progress, failures and future[J]. Nat Rev Drug Discov, 2014, 13(6): 445-464. DOI:10.1038/nrd4279 |
| [6] |
Gillard BK, Rosales C, Xu BQ, et al. Rethinking reverse cholesterol transport and dysfunctional high-density lipoproteins[J]. J Clin Lipidol, 2018, 12(4): 849-856. DOI:10.1016/j.jacl.2018.04.001 |
| [7] |
Kypreos KE, Zannis VI. Pathway of biogenesis of apolipoprotein E-containing HDL in vivo with the participation of ABCA1 and LCAT[J]. Biochem J, 2007, 403(2): 359-367. DOI:10.1042/BJ20061048 |
| [8] |
Takahashi Y, Ito Y, Wada N, et al. Development of homogeneous assay for simultaneous measurement of apoE-deficient, apoE-containing, and total HDL-cholesterol[J]. Clin Chim Acta, 2016, 454: 135-142. DOI:10.1016/j.cca.2016.01.013 |
| [9] |
Horiuchi Y, Ohkawa R, Lai SJ, et al. Characterization of the cholesterol efflux of apolipoprotein E-containing highdensity lipoprotein in thp-1 cells[J]. Biol Chem, 2019, 400(2): 209-218. DOI:10.1515/hsz-2018-0284 |
| [10] |
Ćwiklińska A, Strzelecki A, Kortas-Stempak B, et al. ApoE-containing HDL and the development of atherosclerosis[J]. Postepy Hig Med Dosw (Online), 2015, 69: 1-9. DOI:10.5604/17322693.1134724 |
| [11] |
Liu J, Hong YL, D'Agostino RB, et al. Predictive value for the Chinese population of the framingham CHD risk assessment tool compared with the chinese multiprovincial cohort study[J]. JAMA, 2004, 291(21): 2591-2599. DOI:10.1001/jama.291.21.2591 |
| [12] |
全文胜, 潘长玉. 国际糖尿病联盟关于代谢综合征定义的全球共识[J]. 中华内分泌代谢杂志, 2005, 21: 附录4b. Quan WS, Pan CY. Worldwide consensus of definition of metabolic syndrome by international diabetes federation[J]. Chin J Endocrinol Metabolism, 2005, 21: Suppl 4b. |
| [13] |
Vaisar T, Pennathur S, Green PS, et al. Shotgun proteomics implicates protease inhibition and complement activation in the antiinflammatory properties of HDL[J]. J Clin Invest, 2007, 117(3): 746-756. DOI:10.1172/JCI26206 |
| [14] |
Qi Y, Liu J, Wang W, et al. Apolipoprotein E-containing high-density lipoprotein (HDL) modifies the impact of cholesterol-overloaded HDL on incident coronary heart disease risk: A community-based cohort study[J]. J Clin Lipidol, 2018, 12(1): 89-98. DOI:10.1016/j.jacl.2017.11.003 |
| [15] |
Rohatgi A. Reverse cholesterol transport and atherosclerosis[J]. Arterioscler Thromb Vasc Biol, 2019, 39(1): 2-4. DOI:10.1161/ATVBAHA.118.311978 |
| [16] |
Hoogeveen RC, Shao MY, Rishi P, et al. Effect of high-intensity statin therapy on high-density lipoprotein (HDL) subfractions and regression of coronary atheroma: The saturn trial[EB/OL]. Arterioscler Thromb Vasc Biol, 2016. http://www.myamericanheart.org/idc/groups/ahamah-public/@wcm/@sop/@scon/documents/downloadable/ucm_485231.pdf.
|
| [17] |
Filou S, Lhomme M, Karavia EA, et al. Distinct roles of Apolipoproteins A1 and E in the modulation of high-density lipoprotein composition and function[J]. Biochemistry, 2016, 55(27): 3752-3762. DOI:10.1021/acs.biochem.6b00389 |
 2021, Vol. 42
2021, Vol. 42