文章信息
- 田剑波, 温艳, 杨卓煜, 郑亚迪, 吴峥, 李江, 李霓, 赫捷.
- Tian Jianbo, Wen Yan, Yang Zhuoyu, Zheng Yadi, Wu Zheng, Li Jiang, Li Ni, He Jie
- 全球结直肠癌筛查指南及共识质量评价
- Quality assessment of global colorectal cancer screening guidelines and consensus
- 中华流行病学杂志, 2021, 42(2): 248-257
- Chinese Journal of Epidemiology, 2021, 42(2): 248-257
- http://dx.doi.org/10.3760/cma.j.cn112338-20200902-01119
-
文章历史
收稿日期: 2020-09-02
2. 国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院癌症早诊早治办公室, 北京 100021;
3. 国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院胸外科, 北京 100021
2. Office of Cancer Screening, National Cancer Center/National Clinical Research Center for Cancer/Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021, China;
3. Department of Thoracic Surgery, National Cancer Center/National Clinical Research Center for Cancer/Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021, China
结直肠癌(colorectal cancer)是严重威胁人类健康的恶性肿瘤,是我国重大公共卫生问题之一。据国际癌症研究署(International Agency for Research on Cancer,IARC)估计数据显示,2018年全球结直肠癌新发病例数共计180万余例,死亡例数共计88万余例,是全球第三大最常见的癌症,也是导致癌症死亡的第二大主要原因[1]。若能对结直肠癌进行早期筛查、早发现、早治疗,结直肠癌患者的5年生存率可达80%以上[2]。得益于较早地开展人群结直肠癌筛查项目和危险因素控制,发达国家结直肠癌发病率以及死亡率均持续下降[1-2]。然而,近些年随着我国经济水平的发展、生活方式、饮食结构的改变,我国结直肠癌的发病率和死亡率仍呈上升的趋势[3],亟须制定有效可行的结直肠癌筛查指南/共识。尽管目前多个国家及地区相继制订了结直肠癌筛查指南/共识及规范,然而由于各国社会经济条件、遗传背景、医疗资源的分布和可及性、适用人群和制定流程的差异,其颁布的指南/共识质量和标准存在一定的差异,对筛查的实践和推广造成一定的挑战。国际上普遍采用开发指南研究和评估工具Ⅱ(The Appraisal of Guidelines for Research & Evaluation Ⅱ,AGREE Ⅱ)[4]和国际实践指南报告标准(Reporting Items for Practice Guidelines in Healthcare,RIGHT)[5]对卫生政策、公共卫生和临床医学指南/共识的报告标准进行系统评价[6]。目前已有多个国家和机构发布了结直肠癌筛查指南/共识[8-26],其数量在快速更新,其指南/共识的质量需要进一步地系统评价。本研究在已发表文章《结直肠癌筛查领域指南方法学质量的系统评价》基础上[6],应用AGREE Ⅱ、RIGHT工具对结直肠筛查指南/共识进行质量评价,为我国高质量的结直肠癌筛查指南/共识制定提供参考。
资料与方法1. 文献检索策略:以结直肠癌、结直肠肿瘤、筛检、筛查、指南、共识、Colorectal cancer、Colorectal neoplasms、Screening、Consensus、Early Detection of Cancer、Guideline、Recommendation为检索关键词,系统检索中国知网、万方数据知识服务平台、维普网及中国生物医学文献服务系统、PubMed、Embase、Web of Science、Cochrane Library和Guidelines International Network。同时还检索美国预防服务工作组(U.S. Preventive Services Task Force)、美国癌症学会(American Cancer Society)、IARC、澳大利亚癌症委员会(Australia Cancer Council)、大不列颠及爱尔兰肛肠协会(Association of Coloproctology of Great Britain & Ireland)、美国临床肿瘤学会(American Society of Clinical Oncology)、美国国家综合癌症网络(National Comprehensive Cancer Network)等机构官网刊登的指南/共识作为补充,计算机检索时限均为建库至2020年9月1日。同时手工检索已经发表和通过引文追溯得到的指南/共识文献。
2. 文献筛选:纳入标准:①公开发布的结直肠癌筛查指南/共识;②语种为中文或英文。排除标准:①关于指南/共识的解读、评价、介绍、应用效果评价等文献;②非结直肠癌、非筛查类和非独立内容呈现的指南/共识;③指南/共识的翻译版本或者更新指南/共识之前的旧版本;④重复发表的指南/共识;⑤综述文章、会议摘要或无全文的文献。
3. 资料提取:由2名评价人员根据纳入排除标准分别进行文献筛选,并进行核对,如有分歧由交由第三方专家进行决定。将所纳入的指南/共识根据国家/组织(发布组织所在地区为准)、名称、发布机构、研究方法、证据分级、更新时间、更新情况、评价情况、高危人群(年龄、家族史、癌前疾病、其他)、筛查频率、筛查地点、筛查益处、受试者参与、药物预防干预(阿司匹林)、外科预防性切除干预等资料进行提取描述。
4. 质量评价:评价者使用AGREE Ⅱ[4]、RIGHT[5]工具分别对指南/共识的方法学和报告质量进行评价,具体方法参见文献[7]。AGREE Ⅱ评价根据6个领域(范围和目的、参与人员、严谨性、清晰性、应用性、独立性)的得分情况综合判断所评指南/共识是否值得推荐应用,并将其分为3个推荐等级:A级:积极推荐(≥4个领域的分值≥50.0%),B级:推荐(3个领域的分值≥50%),C级:一定条件下推荐(≤2个领域的分值≥50.0%)。RIGHT评价根据7个领域(基本信息、背景、证据、推荐意见、评审和质量保证、资金资助和利益冲突、其他方面)的得分判断指南/共识的报告质量,并将其分为3个水平:总报告率≥70.0%认为指南/共识报告水平良好、40.0%~70.0%认为中等、≤40.0%认为较差。
5. 一致性评价:评价人员对评价结果的一致性判断,评价人员均需具备较好的英文阅读能力和循证医学方法学的基础,在实施评价之前,由项目组对其进行组内培训,对文献评价的方法、AGREE Ⅱ、RIGHT工具评价标准及评价注意事项进行详细介绍。评价过程中研究人员不进行相关交流,待评价结束后,共同评价结果,分歧较大的部分,交由第三方专家进行评价。
6. 统计学分析:文献资料管理采用EndNote软件,采用Excel软件进行评分记录及分析。采用Stata 14软件进行统计学分析,对指南/共识的版本和国家进行亚组分析,比较是否存在差异,采用平均差(Mean difference,MD)、OR值及其95%CI来描述。对评价人员评分结果的一致性进行组内相关系数(intra-class correlation coefficient,ICC)检验[27]。ICC值为0.10~0.20说明评价者间一致性差;0.21~0.40说明一致性较差;0.41~0.60说明一致性中等;0.61~0.80说明一致性良好;0.81~1.00说明一致性非常好[28]。
结果1. 文献筛选及纳入情况:共检索出相关文献604篇,经过剔除重复和不相关文献后获得指南/共识221部;浏览题目及摘要,排除126部明显不符合纳入标准的文献;阅读可能符合纳入标准的95部文献全文,排除综述、非筛查指南/共识和旧版指南/共识文献76部,最终纳入结直肠癌筛查领域具备详细研究方法的指南/共识共19部,其中英文15部、中文4部。文献筛选流程见图 1。

|
| 图 1 结直肠癌筛查文献筛选流程 |
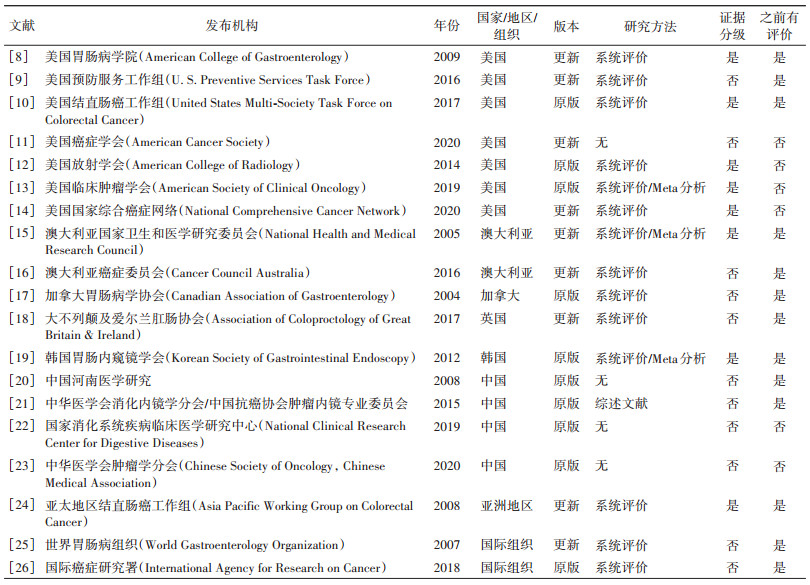
2. 纳入的筛查指南/共识基本特征:19部指南/共识发布时间为2004-2020年,发布指南/共识的国家包括美国、中国、澳大利亚、加拿大、英国、韩国,其中美国发布的指南/共识最多(7部),中国颁布4部。9部为此前发布指南/共识的更新版本,18部指南/共识均为各国或组织相关协会/学会/委员会发布,1部指南/共识未指明发布机构,14部指南/共识对现有文献进行了系统评价,8部指南/共识对所纳入的证据进行了分级。见表 1。
3. 纳入的指南/共识推荐筛查内容:筛查年龄被指定为最大范围为45~75岁,但各个指南/共识之间推荐差异较小。其中6部指南/共识推荐≥50岁,5部指南/共识推荐50~75岁,2部指南/共识推荐50~74岁,另外5部指南/共识分别推荐40~74岁、45~75岁、50~70岁、50~65岁、60~74岁,并有1部指南/共识未描述推荐筛查年龄。16部指南/共识均推荐有一级结直肠癌家族史的人群应接受筛查,并且其中15部指南/共识同时推荐有结直肠癌前病变(溃疡性结肠炎、克罗恩病、结直肠腺瘤性息肉等)的人群应接受筛查,12部指南/共识建议具有结直肠癌相关症状、某些遗传综合征患者以及腹部和骨盆区域因癌症接受放射治疗的人群应接受筛查。在筛查方式和筛查频率方面,所有指南/共识均提出了筛查方式的建议,其中16部指南/共识提出了筛查频率的建议。在效果评价方面,18部指南/共识提及结直肠癌筛查带来的益处,另有13部指南/共识提及结直肠癌潜在的危害。此外,14部指南/共识有具体受试者参与的详细记录,纳入指南/共识中有6部指南/共识建议采用药物预防干预(阿司匹林),7部指南/共识建议采取外科预防性切除干预。见表 2。
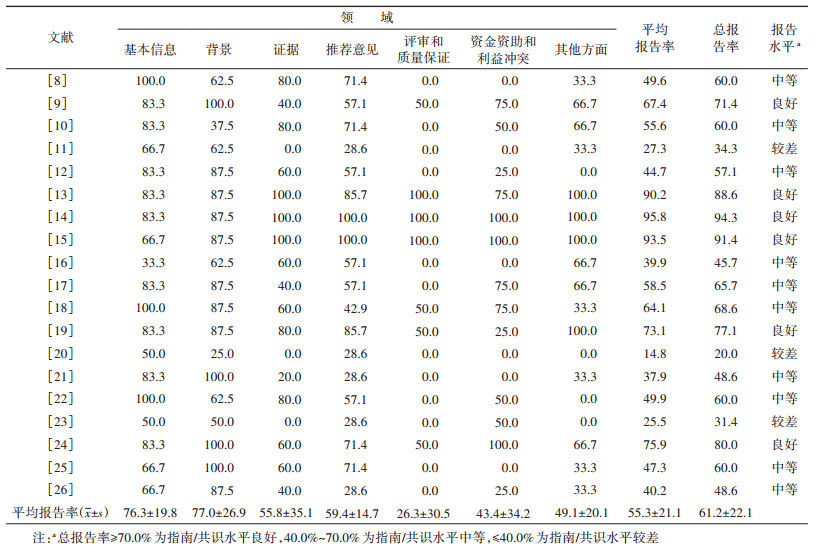
4. 纳入指南/共识的方法学质量评价:AGREE Ⅱ评价结果显示,19部指南/共识中整体得分≥50.0%的有12部,A级13部、B级2部、C级4部。各指南/共识在范围和目的、清晰性领域得分较高,但在参与人员、严谨性、应用性和独立性领域得分差异较大。各领域得分见表 3。
5. 纳入指南/共识的报告质量评价:RIGHT评价7个领域平均报告率见表 4。依据质量等级评价显示,6部指南/共识质量报告良好(31.6%),其他13部指南/共识报告质量有待提高(68.4%)。19部指南/共识报告中存在的问题主要体现:①背景:本领域不规范的条目集中在未明确描述指南/共识使用地的具体环境(10部)以及对参与指南/共识制定贡献者的角色和责任描述不清晰(8部);②证据:共有13部指南/共识未能在使用文献综述和系统评价的方法时明确呈现关键问题(11部)和分类方法(13部),并且仍有较多指南/共识未能明确描述检索策略和评价过程(5部)和未提供证据质量评价和分级的方法(7部);③推荐意见:大多数指南/共识在本领域出现的问题集中于未考虑目标人群的价值观和偏好(11部)以及对推荐意见公平性、可行性和可接受性的考虑(10部),且针对决策过程和方法的描述欠佳(12部);④评审和质量保证:各指南/共识在该领域整体表现较差,仅有5部指南/共识提到并进行了独立评审,3部指南/共识描述了是否通过质量保证程序;⑤资金资助和利益冲突:多数指南/共识在本领域4个条目均存在问题,只有4部指南/共识描述了指南指定各个阶段的资金资助来源情况和资助者的作用,8部指南/共识对有关利益冲突的声明和管理进行了描述;⑥其他方面:只有4部指南/共识对制定过程中存在的局限性进行了描述,8部指南/共识描述了当前实践与研究证据之间的差异和对未来研究的建议。
其中6部更新或最近发布的筛查指南/共识(之前没有文献对其评价)[11-14, 22-23]中AGREE Ⅱ推荐等级为A级有4部、C级有2部,整体质量较高。同时这些指南/共识中有4部(66.7%)经RIGHT评价显示为质量中等或以上(2部良好、2部中等),报告规范相比之前有较大程度的提高。
6. 一致性检验:使用AGREE Ⅱ工具评价时,2名评价人员针对范围和目的、参与人员、严谨性、清晰性、应用性、独立性6个领域进行评价的一致性检验结果分别为0.64、0.69、0.94、0.56、0.76、0.70,评价结果的总一致性较好(ICC=0.85,95%CI:0.73~0.93)。
使用RIGHT工具评价中,2名评价人员针对基本信息、背景、证据、推荐意见、评审和质量保证、资金资助和利益冲突、其他方面7个领域进行评价的一致性检验结果分别为0.91、0.97、0.96、0.93、0.84、0.96、0.91和0.98,评价的总一致性非常好(ICC=0.98,95%CI:0.94~0.99)。
7. 亚组分析:根据指南/共识发布国家/地区所在地区和是否有更新版本进行亚组分析(表 5),结果显示,AGREE Ⅱ的整体得分发达国家略优于中国(MD=0.24,95%CI:0.03~0.46)。AGREE Ⅱ评价结果显示,发达国家的指南/共识在范围和目的(MD=0.26,95%CI:0.07~0.47)、参与人员(MD=0.33,95%CI:0.05~0.62)和独立性(MD=0.39,95%CI:0.02~0.76)方面优于中国筛查指南/共识。RIGHT评价结果显示,背景(OR=3.05,95%CI:1.31~7.09)、证据(OR=5.33,95%CI:1.75~16.29)、推荐意见(OR=3.45,95%CI:1.44~8.25)、评审和质量保证(OR=1.50,95%CI:1.17~1.93)、其他方面(OR=16.50,95%CI:1.96~139.15)和总报告率(OR=3.03,95%CI:2.06~4.44)方面发达国家的指南/共识优于中国。此外,有更新版的指南/共识与无更新版的指南/共识相比,AGREE Ⅱ评价评分无差异,而在RIGHT评价的总报告率(OR=1.64,95%CI:1.19~2.24)上,有更新版的指南/共识报告较好。
结直肠癌是中国第三大常见癌症,也是导致死亡的主要癌症之一,而早期筛查能大幅降低该疾病的死亡率和医疗负担[1]。
本研究结果显示,目前国内外结直肠癌筛查指南/共识共19部。尽管目前结直肠癌筛查指南/共识的数量仍是美国占比最高,但是中国结直肠癌指南/共识的数量正在上升。在这些指南/共识中,其中13部[8-10, 15-21, 24-26]由2019年北京协和医学院肿瘤医院、国家癌症中心李江等[6]对其已进行了系统评价。新评价的指南/共识有6部[11-14, 22-23],其中美国发布4部(2部是更新指南/共识),中国发布的有2部,新增的发布机构包括美国放射学会、美国临床肿瘤学会、中国国家消化系统疾病临床医学研究中心和中华医学会肿瘤学分会早诊早治学组等[11-14, 22-23]。近年来,指南/共识的发布数目逐渐增加,一方面是因为指南/共识的有效期一般认为是2年,更新时间也是需在2年以内[29],发布时间和更新距今时间过长会降低在临床上的指导作用,因此指南/共识发表后的更新提高了临床的时效性和有效性。另一方面,目前随着新型筛选技术的发展和成熟,筛查指南/共识需整合更综合、系统的筛查技术和方案,进而提高其筛查效果。我们看到在这6部新发布的指南/共识中,有4部经AGREE Ⅱ评价达到A级,整体质量较高;4部经RIGHT评价质量中等或以上(2部良好、2部中等)。与之前发布指南/共识相比,新发布的这批指南/共识报告质量和规范程度得到很大程度的提高。此外,新发布的筛查指南/共识推荐的筛查内容中也覆盖了多个层面,比如这6部指南/共识中有4部(66.7%)有药物预防干预(阿司匹林)资料,在筛查方式、筛查频率方面、受试者参与率方面都有详细介绍。值得注意的是,其中一个最明显的改变是这次更新的指南/共识中,首次发布筛查起始年龄提前(美国癌症学会发布的筛查起始年龄为45岁[11];中华医学会肿瘤学分会发布的起始年龄为40岁[23])。这些内容说明随着筛查策略、技术的成熟以及指南/共识制定流程的规范,及时的更新和制定新的筛查指南/共识对于提高结直肠癌筛查指南/共识质量至关重要,同样这也是我们在短时间内对新发布或者更新版本的指南/共识进行系统评价的重要原因之一。
本研究纳入的19部结直肠癌筛查指南/共识在起始筛查年龄方面较为一致,多数推荐从50岁起开始,筛查截止年龄则根据资源、经济、人口构成不同有所变化。美国癌症学会和中华医学会肿瘤学分会提前了起始筛查年龄,将筛查人群分别扩大至45~75岁和40~74岁[11-23]。由于具有结直肠癌家族史和癌前病变等特征的高风险人群在发病年龄和发病风险以及临床预后方面和普通人群相差较大,多数指南/共识针对这类高风险人群制订了不同的筛查方案,比如美国预防服务工作组开展的指南/共识[9],推荐对一般人群的筛查方案主要以免疫法粪便隐血试验或大便隐血试验为初筛,初筛阳性则进行结肠镜检查。多数指南/共识在制订过程中同时考虑了筛查益处和筛查危害,然而只有极少数指南/共识描述了筛查地点。值得注意的是,在最近更新的指南/共识中,受试者意愿得到更多重视,筛查选择方案多样化趋势增强[11-14, 22-23],这也在一定程度上反映随着筛查技术和方案的发展和成熟,越来越多的方案如无创的DNA筛检、液体活检等可供受试者选择。
本研究使用AGREE Ⅱ和RIGHT对指南/共识共同进行评价。根据AGREE Ⅱ的评价结果,纳入的19部指南/共识中,13部指南/共识的推荐等级为A级。纳入指南/共识的质量整体较高,其在范围和目的及清晰性两个领域表现优秀,得分均超过80.0%。但在严谨性、应用性、参与人员和独立性4个领域的质量还有待提高。在后续的指南/共识制定过程中,应该从以下几个方面提高:①严谨性方面,应该明确选择证据的标准,确定证据的推荐优势和劣势,清晰阐述形成推荐意见的方法;②应用性领域上,应用过程中的促进和阻碍因素的描述欠缺,在推荐建议应用时潜在的资源和工具方面的描述仍需提高,指南/共识的最终目的是服务于临床工作,所以指南/共识应该具有足够的应用性。减少语种、不同的知识背景等方面的阻碍因素才能确保指南/共识的实施;③在参与人员领域方面,后续制定指南/共识应该充分描述指南/共识的适用者,指南/共识开发小组成员组成涵盖多个领域的专业人员,目标人群的观点和选择应该要更加全面和严谨;④在独立性领域方面,大部分指南/共识得分均 < 50.0%,但其中仍有4部[8, 14, 22, 25]的推荐等级是A级,主要原因可能是指南/共识没有强调指南/共识制订小组成员的利益冲突,指南/共识的制定过程中应该避免受到任何基金会、药商或机械商的观点影响指南/共识的内容。另外,根据RIGHT评价工具的评分结果,19部指南/共识中,只有6部指南/共识质量报告良好,其他指南/共识报告质量中等或较差,报告规范性有待提高。纳入指南/共识除了基本信息和背景两个领域报告水平良好之外,在其他方面表现不佳,比如在评审和质量保证领域的报告水平较差,仅美国和澳大利亚的3部[13-15]指南/共识描述了外部评审方法以及质量控制程序,其他指南/共识均缺乏相关描述,不利于保证指南/共识质量以及适用性。另外,几乎所有指南/共识均未描述当前实践与研究证据之间的差异,可能会影响指南/共识对筛查实践的指导,不利于未来对指南/共识的进一步改进和完善。此外初级卫生保健机构、中低收入国家或住院部门等不同的具体应用环境,对指南/共识的成功应用有着重要影响,但多数指南/共识未明确其应用的具体环境。这几个方面在指南/共识后续制定的过程中需要注意,提高指南/共识的报告规范程度。
总之,近年来发布的指南/共识在方法学和报告规范性方面质量均有所提高,但我国发布的指南/共识的质量低于发达国家。我国目前的4部筛查指南/共识整体质量不高。AGREE Ⅱ评价达到A级只有1部、C级的有2部;同时,在RIGHT评价中也位于中等和较差的水平,特别是在范围和目的、严谨性、参与人员和独立性领域以及RIGHT的报告背景、证据、推荐意见、评审和质量保证和其他方面领域仍需进一步提升。目前结直肠癌筛查的指导证据多来自欧美地区的研究,但由于我国结直肠癌流行特征、医疗资源可及性和分布、居民收入以及人群种族背景等均与欧美地区有着较大差异,我国亟待开展一些符合我国国情的更高循证级别的研究,比如随机对照研究,制定出高质量的指南/共识以指导和规范结直肠癌筛查方案。此外,有更新版本的指南/共识和无更新版本的指南/共识相比,更新版本的RIGHT的总报告率要高于未更新版本,说明更新版本的指南/共识更加规范,其推荐意见的可信度更高,在临床上的指导作用进一步提升。
本研究存在局限性。首先,由于语言的限制,本研究中仅对中、英文的指南/共识进行了评价,后续的研究尽可能纳入更多的语种。另外,尽管AGREE Ⅱ和RIGHT在国际上得到广泛的推广和应用,并被认为是指南/共识质量评价的金标准[30],但缺少对指南/共识内容进行质量评估,可能导致指南/共识在临床有效性方面有一定的局限。
整体而言,目前全球结直肠癌筛查指南/共识发布数量呈上升趋势且质量整体较高,报告规范方面有所欠缺。但我国结直肠癌筛查指南/共识在方法学质量、报告规范性和应用性方面和欧美发达国家仍然有一定的差距,因此我们亟待开展一些符合我国国情的更高循证级别的筛查研究。同时在传统的环境筛选因素基础上,整合遗传易感因素,进一步优化结直肠癌筛选策略和方法,为我国的结直肠癌筛查指南/共识制定提供高级别理论证据和方案选择,以期降低结直肠癌发病率和死亡率。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
DeSantis CE, Lin CC, Mariotto AB, et al. Cancer treatment and survivorship statistics, 2014[J]. CA Cancer J Clin, 2014, 64(4): 252-271. DOI:10.3322/caac.21235 |
| [3] |
郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 41(1): 19-28. Zheng RS, Sun KX, Zhang SW, et al. Report of cancer epidemiology in China, 2015[J]. Chin J Oncol, 2019, 41(1): 19-28. DOI:10.3760/cma.j.issn.0253-3766.2019.01.005 |
| [4] |
Brouwers MC, Kho ME, Browman GP, et al. AGREE Ⅱ: advancing guideline development, reporting, and evaluation in health care[J]. Prev Med, 2010, 51(5): 421-424. DOI:10.1016/j.ypmed.2010.08.005 |
| [5] |
Chen YL, Yang KH, Marušić A, et al. A reporting tool for practice guidelines in health care: the RIGHT statement[J]. Ann Intern Med, 2017, 166(2): 128-132. DOI:10.7326/M16-1565 |
| [6] |
李江, 要鹏韬, 牛军强, 等. 结直肠癌筛查领域指南方法学质量的系统评价[J]. 中华预防医学杂志, 2019, 53(4): 398-404. Li J, Yao PT, Niu JQ, et al. Systematic review of the methodology quality and reporting quality in colorectal cancer screening guidelines[J]. Chin J Prev Med, 2019, 53(4): 398-404. DOI:10.3760/cma.j.issn.0253-9624.2019.04.013 |
| [7] |
李江, 杨珂璐, 蔡依彤, 等. 全球乳腺癌筛查指南质量评价[J]. 中华流行病学杂志, 2021, 42(2): 219-226. Li J, Yang KL, Cai YT, et al. Quality assessment of global breast cancer screening guidelines[J]. Chin J Epidemiol, 2021, 42(2): 219-226. DOI:10.3760/cma.j.cn11233820200806-01032 |
| [8] |
Dominic OG, McGarrity T, Dignan M, et al. American college of gastroenterology guidelines for colorectal cancer screening 2008[J]. Am J Gastroenterol, 2009, 104(10): 2626-2627. DOI:10.1038/ajg.2009.419 |
| [9] |
US Preventive Services Task Force. Screening for colorectal cancer: US preventive services task force recommendation statement[J]. JAMA, 2016, 315(23): 2564-2575. DOI:10.1001/jama.2016.5989 |
| [10] |
Robertson DJ, Lee JK, Boland CR, et al. Recommendations on fecal immunochemical testing to screen for colorectal Neoplasia: a consensus statement by the US multi-society task force on colorectal cancer[J]. Gastroenterology, 2017, 152(5): 1217-1237. DOI:10.1053/j.gastro.2016.08.053 |
| [11] |
American Cancer Society. American Cancer Society Guideline for Colorectal Cancer Screening[EB/OL]. https://www.cancer.org/cancer/colon-rectal-cancer/detectiondiagnosis-staging.html.
|
| [12] |
Yee J, Kim DH, Rosen MP, et al. ACR appropriateness criteria colorectal cancer screening[J]. J Am Coll Radiol, 2014, 11(6): 543-551. DOI:10.1016/j.jacr.2014.02.006 |
| [13] |
Lopes G, Stern MC, Temin S, et al. Early detection for colorectal cancer: ASCO resource-stratified guideline[J]. J Glob Oncol, 2019, 5: 1-22. DOI:10.1200/JGO.18.00213 |
| [14] |
Provenzale D, Ness RM, Llor X, et al. NCCN Guidelines Insights: Colorectal Cancer Screening, Version 2.2020[J]. J Natl Compr Canc Netw, 2020, 18(10): 1312-1320. DOI:10.6004/jnccn.2020.0048 |
| [15] |
Australian Cancer Network Colorectal Cancer Guidelines Revision Committee. Clinical practice guidelines for the prevention, early detection and management of colorectal cancer[J]. Sydney: The Cancer Council Australia and Australian Cancer Network, 2005. |
| [16] |
Cancer Council Australia. Bowel cancer screening[EB/OL]. (2016-05-27)[2020-09-18]. https://wiki.cancer.org.au/policy_mw/index.php?oldid=7253.
|
| [17] |
Leddin D, Hunt R, Champion M, et al. Canadian association of gastroenterology and the Canadian digestive health foundation: guidelines on colon cancer screening[J]. Can J Gastroenterol, 2004, 18(2): 93-99. DOI:10.1155/2004/983459 |
| [18] |
Moran B, Cunningham C, Singh T, et al. Association of Coloproctology of Great Britain & Ireland (ACPGBI): Guidelines for the Management of Cancer of the Colon, Rectum and Anus (2017)Surgical Management[J]. Colorectal Dis, 2017, 19(Suppl 1): 18-36. DOI:10.1111/codi.13704 |
| [19] |
Lee BI, Hong SP, Kim SE, et al. Korean guidelines for colorectal cancer screening and polyp detection[J]. Clin Endosc, 2012, 45(1): 25-43. DOI:10.5946/ce.2012.45.1.25 |
| [20] |
佚名. 结直肠癌和腺瘤性息肉筛查指南(2008年版)[J]. 河南医学研究, 2008(4): 371. Anonymous. Screening guidelines for colorectal cancer and adenomatous polyps[J]. Henan Medical Research, 2008(4): 371. |
| [21] |
中华医学会消化内镜学分会, 中国抗癌协会肿瘤内镜学专业委员会. 中国早期结直肠癌筛查及内镜诊治指南(2014年, 北京)[J]. 中华消化内镜杂志, 2015, 32(6): 341-360. Chinese Society of Digestive Endoscopology, Cancer Endoscopy Committee of China Anti Cancer Association. Guidelines for screening, endoscopy, diagnosis and treatment of early colorectal cancer in China[J]. Chin J Dig Endosc, 2015, 32(6): 341-360. DOI:10.3760/cma.j.issn.1007-5232.2015.06.001 |
| [22] |
国家消化系统疾病临床医学研究中心(上海), 国家消化道早癌防治中心联盟, 中华医学会消化内镜学分会, 等. 中国早期结直肠癌筛查流程专家共识意见(2019, 上海)[J]. 中华消化内镜杂志, 2019, 36(10): 709-719. National Clinical Research Center for Digestive Diseases (Shanghai), National Early Gastrointestinal‑Cancer Prevention & Treatment Center Alliance (GECA), Chinese Society of Digestive Endoscopology, et al. Chinese consensus of early colorectal cancer screening (2019, Shanghai)[J]. Chin J Dig Endosc, 2019, 36(10): 709-719. DOI:10.3760/cma.j.issn.1007-5232.2019.10.004 |
| [23] |
中华医学会肿瘤学分会早诊早治学组. 中国结直肠癌早诊早治专家共识[J]. 中华医学杂志, 2020, 100(22): 16911698. Early Diagnosis and Treatment Group of Oncology Branch of Chinese Medical Association. Expert consensus in early diagnosis and treatment of colorectal cancer in China[J]. Natl Med J China, 2020, 100(22): 1691-1698. DOI:10.3760/cma.j.cn11213720190924-02103 |
| [24] |
Sung JJY, Lau JYW, Young GP, et al. Asia Pacific consensus recommendations for colorectal cancer screening[J]. Gut, 2008, 57(8): 1166-1176. DOI:10.1136/gut.2007.146316 |
| [25] |
Winawer SCM, Classen M, Lambert R, et al. World gastroenterology organization international digestive cancer alliance practice guidelines: Colorectal cancer screening[EB/OL]. (2007-10-04)[2020-09-18]. https://www.worldgastroenterology.org/UserFiles/file/guidelines/colorectal-cancer-screening-english-2007.pdf.
|
| [26] |
Baglioni P. The IARC perspective on colorectal cancer screening[J]. N Engl J Med, 2018, 379(3): 301-302. DOI:10.1056/NEJMc1807173 |
| [27] |
Landis JR, Koch GG. The measurement of observer agreement for categorical data[J]. Biometrics, 1977, 33(1): 159-174. DOI:10.2307/2529310 |
| [28] |
Kramer MS, Feinstein AR. Clinical biostatistics. LIV. The biostatistics of concordance[J]. Clin Pharmacol Ther, 1981, 29(1): 111-123. DOI:10.1038/clpt.1981.18 |
| [29] |
Shekelle PG, Ortiz E, Rhodes S, et al. Validity of the Agency for Healthcare Research and Quality clinical practice guidelines: how quickly do guidelines become outdated?[J]. JAMA, 2001, 286(12): 1461-1467. DOI:10.1001/jama.286.12.1461 |
| [30] |
王吉耀. 制定临床实践指南评价的"中国标准"[J]. 中华医学杂志, 2018, 98(20): 1542-1543. Wang JY. Developing appraisal of guidelines research and evaluation in China[J]. Natl Med J China, 2018, 98(20): 1542-1543. DOI:10.3760/cma.j.issn.0376-2491.2018.20.003 |
 2021, Vol. 42
2021, Vol. 42