文章信息
- 曹毛毛, 李江, 孙殿钦, 李贺, 何思怡, 雷林, 彭绩, 陈万青.
- Cao Maomao, Li Jiang, Sun Dianqin, Li He, He Siyi, Lei Lin, Peng Ji, Chen Wanqing
- 全球肝癌筛查指南及共识质量评价
- Quality assessment of global liver cancer screening guidelines and consensus
- 中华流行病学杂志, 2021, 42(2): 234-240
- Chinese Journal of Epidemiology, 2021, 42(2): 234-240
- http://dx.doi.org/10.3760/cma.j.cn112338-20200806-01036
-
文章历史
收稿日期: 2020-08-06
2. 深圳市慢性病防治中心肿瘤防控科 518020
2. Department of Cancer Prevention and Control, Shenzhen Center for Chronic Disease Control, Shenzhen 518020, China
肝癌是常见的恶性肿瘤之一。GLOBOCAN数据显示2020年全球肝癌发病数和死亡数分别为905 677人和830 180人,占全球发病和死亡顺位的第6位和第3位,主要发生在亚洲地区[1]。我国肿瘤登记数据显示,2015年肝癌标化发病率和死亡率分别为17.64/10万和15.33/10万。在恶性肿瘤发病顺位中位列第4位,死亡位列第2位[2]。肝癌常见的危险因素包括HBV、HCV感染、黄曲霉毒素以及各种原因导致的肝硬化等[3]。危险因素的复杂多样为推行肝癌一级预防带来了一定困难。此外,我国肝癌晚期患者居多,治疗效果差、复发率高,2015年肝癌患者5年相对生存率仅为12.1%[4]。而肝癌筛查可有效改善肝癌生存率,是缓解人群肝癌疾病负担的重要手段。循证实践指南和共识是基于现有资料和证据的全面、客观的总结,是改善肝癌筛查质量和使肝癌筛查得以推广的重要基础。本研究基于系统文献检索,采用开发指南研究和评估工具Ⅱ(The Appraisal of Guidelines for Research & Evaluation Ⅱ,AGREE Ⅱ)[5]和国际实践指南报告标准(Reporting Items for Practice Guidelines in Healthcare,RIGHT)[6]评价全球范围内现有的肝癌筛查指南/共识,为我国肝癌筛查循证指南的制定提供参考依据。
资料与方法1. 文献检索:以Liver neoplasms、Liver cancer、Hepatocellular carcinoma、Guidelines、Recommendations、Standard、Screening、Early detection、肝癌、肝肿瘤、肝细胞癌、指南、共识、规范、标准、筛查、早诊早治、诊断为关键词系统检索PubMed、Cochrane Library、中国知网、万方数据知识服务平台、中国生物医学文献服务系统。并同时检索国际指南协作网(Guideline International Network)和中国临床指南文库(China Guidelines Clearinghouse)截至2020年6月30日前发表的所有中、英文指南/共识。并搜索美国预防服务工作组(U.S. Preventive Services Task Force)、美国癌症学会(American Cancer Society)、国际癌症研究署(International Agency for Research on Cancer)、澳大利亚癌症委员会(Australia Cancer Council)、国际指南协作网(Guideline International Network)、英国国家健康与临床优化研究所(the National Institute for Health and Care Excellence)、亚太肝病研究协会(Asian Pacific Association for the Study of the Liver)、美国肝病研究协会(American Association for the Study of Liver Diseases)等机构官网刊登的指南/共识作为补充。
2. 纳入与排除标准:纳入标准:公开发布的肝癌筛查所有相关的英文或中文的独立指南/共识,并符合1990年美国医学研究所(Institute of Medicine)对指南的定义[7],为全面梳理国内外肝癌筛查指南/共识,本研究中规范等同于指南;排除标准:重复文献、无全文或仅有摘要、指南解读及评价类文献、指南翻译、已更新的旧版指南。
3. 评价方法:采用AGREE Ⅱ和RIGHT评价工具对纳入的指南进行方法学质量评价。AGREE Ⅱ评估系统共包括6个领域(范围和目的、参与人员、严谨性、清晰性、应用性、独立性),23个评分条目。RIGHT报告清单从基本信息、背景、证据、推荐意见、评审和质量保证、资金资助和利益冲突以及其他方面共7个领域进行评价,涵盖22个条目,35个具体标准。每个条目根据指南报告情况均采用“是”“否”进行判定。具体评价方法见文献[8]。
4. 信息提取与质量控制:由项目组2名经培训后的评价人员独立提取文献信息,评价过程中不进行交流,如遇分歧则咨询第三方专家。提取信息包括基本信息(名称、发布机构、发布时间、地区、是否更新等)和推荐信息(筛查的目标人群以及筛查的技术和频率)。使用Endnote软件进行文献管理和去重。
5. 统计学分析:采用Excel 2018软件进行资料整理和分析,AGREE Ⅱ评分和RIGHT的报告率采用百分比表示。利用SPSS软件计算组内相关系数(intra-class correlation coefficient,ICC),若ICC值为0.10~0.20,说明评价者间一致性差;0.21~0.40说明一致性较差;0.41~0.60说明一致性中等;0.61~0.80说明一致性良好;0.81~1.00说明一致性非常好。对2名评价人员的指南评分进行一致性检验,结果显示ICC值(95%CI)为0.93(95%CI:0.92~0.95),评价结果一致性非常好。
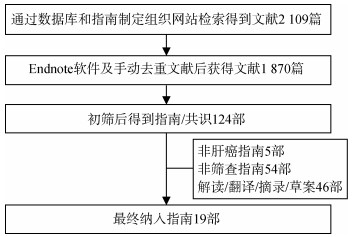
结果1. 筛选流程:共检索到文献2 109篇。按照排除标准最终筛选出中文指南/共识1部,英文指南/共识18部,文献筛选流程及结果见图 1。
|
| 图 1 肝癌筛查指南/共识文献筛选流程 |
2. 基本特征:19部指南/共识均为各国组织相关协会/学会/委员会发布,指南发布时间为2003-2019年。8部为更新版本指南/共识;在所纳入的指南/共识中,筛查均为指南中的部分内容被呈现,纳入的19部指南的基本特征见表 1。19部指南中均认为肝硬化患者是肝癌的高危人群。其次,HBV和HCV感染可作为肝癌高危人群的判定条件。17部(84.21%)指南/共识认为腹部超声结合或不结合甲胎蛋白(a-fetoprotein,AFP)筛查、间隔6个月是推荐的肝癌筛查方式(10部指南/共识推荐二者联合使用)。此外,日本肝脏研究协会将肝癌筛查的目标人群分为高危人群和超高危人群,电子计算机断层扫描(computed tomography,CT)/磁共振成像(magnetic resonance imaging,MRI)是超高危人群筛查的主要技术手段(表 2)。
3. AGREE Ⅱ评价:19部指南中,推荐等级为A级的指南共9部,B级的指南5部。纳入指南在6个领域的得分:①范围和目的:平均分最高,19部指南得分均值为63.0分,其中2部指南得分 > 90分。②参与人员:19部指南得分均值为54.4分,其中9部指南得分 < 50分。③严谨性:19部指南得分均值为54.5分,其中10部指南得分≥50分。④清晰性:19部指南得分平均值为59.0分,其中3部指南得分 < 50分。⑤应用性:该领域各指南得分均偏低,仅1部指南得分 > 50分。⑥独立性:10部指南得分≥50分,整体得分水平仅高于应用性(表 3)。
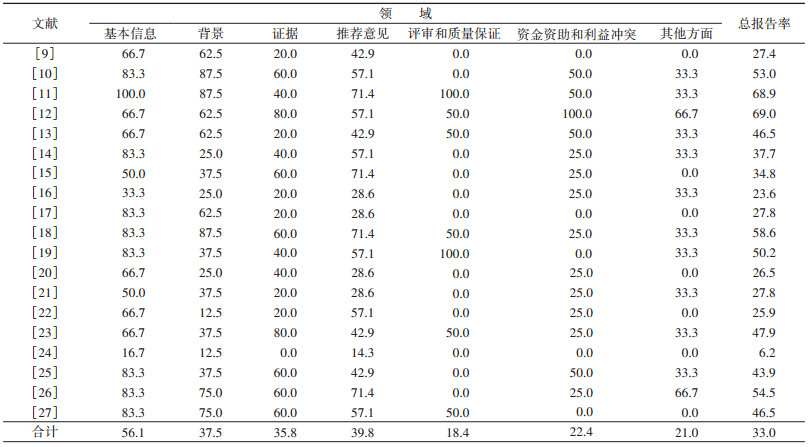
4. RIGHT评价情况:RIGHT总体报告率为33.0%,在所评价的7个领域中,除基本信息和推荐意见外(分别为56.1%和39.8%),其他5个领域报告率均较低。纳入指南在7个领域的报告情况:①基本信息:该领域不规范条目主要集中于未单独列出所涉及的缩略语(14部)和指南标题中未详细描述指南发布年份(12部)。②背景:本领域不规范的条目集中在未明确阐述指南需要特别考虑的亚组人群(14部)和主要的使用者以及应用环境(13部)。③证据:19部指南均未报告结局遴选和分类的方法,15部指南未描述证据检索过程。④推荐意见:各指南在本领域出现的问题集中体现于在制定指南时未考虑目标人群的价值观和偏好(19部)以及公平性、可行性和可接受性等情况(19部)。⑤评审和质量保证:本领域各指南表现较差,只有5部指南描述了是否经过外部评审以及4部指南提及是否通过质量保证程序。合计报告率仅为18.4%。⑥资金资助和利益冲突:本领域的3个条目都有较多指南存在问题,只有1部指南提及了指南制定的资金资助者的作用,1部指南对是否存在利益冲突以及管理方法进行了描述。⑦其他方面:本领域报告率较低,为21.0%。仅3部指南描述了当前实践与研究证据之间的差异以及提供对未来研究的建议。19部指南均未对制定过程中的局限性进行描述(表 4)。
本研究采用AGREE Ⅱ和RIGHT对全球肝癌筛查指南进行质量评价,结果显示,指南质量参差不齐,但推荐意见较为明确,对肝癌高危人群行腹部超声结合AFP筛查是目前较为推崇的筛查方式。
目前,尚无高质量的随机对照试验表明筛查可以降低肝癌死亡率[28],因而基于循证医学的肝癌筛查指南对于有效推行肝癌筛查则至关重要。合格的指南制作团队应包含多领域人员,例如临床专业人员、患者、方法学家、流行病学家等[29]。除此之外,仍需平衡性别和地区差异。具有不同背景的小组成员有益于降低指南的片面性,指南中应详细报告指南制定的专家组成员及其分工。目前,指南多由各协会、各领域的专家所制定,较少考虑患者意愿。但符合专家观点的指南对于患者而言并不一定适用。因而,未来在制定指南时,应充分认识纳入多学科成员的重要性,在形成推荐意见时考虑不同的价值观和偏好。为实现这一目标,应广泛面向公众进行患者招募,鼓励患者积极参与培训,共同促进指南的制定。
本研究纳入的指南中应用性和独立性亦存在普遍问题。指南能否实施和有效应用与该地区经济、医疗水平等密切相关[30]。亚洲2009肿瘤学峰会也指出目前指南在制定时未考虑资源分布不平衡的现状[26]。除忽略成本和资源问题外,也未提及指南在应用时可能存在的阻碍和促进因素,易导致指南不易于推广。未来指南制定应多关注指南实施的具体环境,制定相应手册、指南的在线版、指南的移动应用程序或其他易于传播的工具,有利于目标人群更好地理解指南内容。此外,多数指南未考虑目标人群的选择意愿。随着医疗卫生的进步和健康意识的加强,越来越多的人倾向健康的生活方式,注重指南目标人群的价值观、偏好以及对卫生服务的体验和期望是指南开发过程中必须考虑的因素。苏格兰地区学院之间的指南网络认为国家制定的指南可由地方进行严格评价,以适应地方医疗和经济的发展水平,发现实施中的问题,进而进行针对性的修改,可更好地促进指南的本土化[31]。
如何有效汇报和处理资金资助和利益冲突的声明和管理一直是亟待解决的难题,是指南制定过程中最常见的偏倚来源。利益冲突的不完全报告可直接降低指南的质量、可信度与权威性。在纳入的指南中该领域的AGREE Ⅱ得分仅高于应用性。RIGHT评价的7个领域中,利益冲突的报告率低于30%。为便于比较,全球应使用统一规则、标准汇报利益冲突,包括各参与者的利益关系、是否存在外部赞助支持等,以提高指南的透明度。WHO指南制定原则将利益声明分为利益冲突很小、利益冲突严重但仅与指南制定小组部分工作有关、利益冲突严重且和指南制定小组大部分工作有关[32]。评审和质量保证是确保指南准确性和严谨性的核心,外审是指在指南全文正式发表前,制订小组外的专家或其他利益相关方对指南及其推荐意见进行的发布前评审[33]。评审专家小组应对指南方法学、指南推荐内容以及指南相关因素进行评估,对指南制定小组提出质疑,对每一条推荐意见均无疑问才能予以公开发布。而所纳入的指南中仅有3部指南提及同行评审,但均未详细说明评审内容及评审结果。该领域仍需加强汇报的规范化和透明化。
指南的应用对肝癌筛查的标准化和统一化至关重要。即使尚无高质量的随机对照试验表明肝癌筛查可以有效降低肝癌死亡率,但研究发现随着筛查应用,显著延长了肝癌患者的生存率,且具有一定的成本效益[34]。江苏省启东市是我国主要的肝癌高发地区,20世纪70年代初期开始采用AFP进行肝癌筛查,后续转变为联合应用AFP和超声。陈建国等[35]通过对比每年参加2次的筛查和不能连续参加定期筛查的268例肝癌患者生存率,结果表明前者1、3、5、8年生存率分别为77.16%、49.04%、38.53%和24.25%,后者1、3、5、8年生存率分别为36.25%、21.21%、21.21%和0%,提示肝癌筛查对于提高肝癌生存率具有重要作用。
高质量的循证医学指南对于我国的肝癌防控具有重大意义,不仅可以为临床实践提供重要的参考依据,也是引导居民养成健康的生活方式的重要工具。在提高筛查质量的同时,可降低成本和患者风险。目前,肝癌筛查仅在指南中部分呈现,仍未有独立的实践指南。虽然针对高危人群实行AFP联合腹部超声、间隔6个月是普遍的肝癌筛查方式,但各地区情况迥异,为有效地推行肝癌筛查造成一定困难。随着我国研究质量的提高和证据的不断累积,应参考AGREE Ⅱ和RIGHT综合评价指标制定符合我国国情的肝癌筛查指南。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
International Agency for Research on Cancer. Global cancer observatory: cancer today[EB/OL]. Lyon, France: International Agency for Research on Cancer.[2020-0420]. https://gco.iarc.fr/today.
|
| [2] |
安澜, 曾红梅, 郑荣寿, 等. 2015年中国肝癌流行情况分析[J]. 中华肿瘤杂志, 2019, 41(10): 721-727. An L, Zeng HM, Zheng RS, et al. Liver cancer epidemiology in China, 2015[J]. Chin J Oncol, 2019, 41(10): 721-727. DOI:10.3760/cma.j.issn.0253-3766.2019.10.001 |
| [3] |
Chen WQ, Xia CF, Zheng RS, et al. Disparities by province, age, and sex in site-specific cancer burden attributable to 23 potentially modifiable risk factors in China: a comparative risk assessment[J]. Lancet Glob Health, 2019, 7(2): e257-269. DOI:10.1016/s2214-109x(18)30488-1 |
| [4] |
Zeng HM, Chen WQ, Zheng RS, et al. Changing cancer survival in China during 2003-15: a pooled analysis of 17 population-based cancer registries[J]. Lancet Glob Health, 2018, 6(5): e555-567. DOI:10.1016/s2214-109x(18)30127-x |
| [5] |
Brouwers MC, Kho ME, Browman GP, et al. AGREE Ⅱ: advancing guideline development, reporting and evaluation in health care[J]. CMAJ, 2010, 182(18): E839-842. DOI:10.1503/cmaj.090449 |
| [6] |
Chen YL, Yang KH, Marušić A, et al. A reporting tool for practice guidelines in health care: the RIGHT statement[J]. Ann Intern Med, 2017, 166(2): 128-132. DOI:10.7326/M16-1565 |
| [7] |
Institute of Medicine(US), Committee to advise the public health service on clinical practice guidelines[M]//Field MJ, Lohr KN. Clinical practice guidelines: directions for a new program[M]. Washington, DC: National Academies Press, 1990.
|
| [8] |
李江, 杨珂璐, 蔡依彤, 等. 全球乳腺癌筛查指南质量评价[J]. 中华流行病学杂志, 2021, 42(2): 219-226. Li J, Yang KL, Cai YT, et al. Quality assessment of global breast cancer screning guidelines[J]. Chin J Epidemiol, 2021, 42(2): 219-226. DOI:10.3760/cma.j.cn11233820200806-01032 |
| [9] |
中华人民共和国国家卫生健康委员会医政医管局. 原发性肝癌诊疗规范(2019年版)[J]. 中华肝脏病杂志, 2020, 28(2): 112-128. Medical Administration of National Health Commission of the People's Republic of China. Guidelines for diagnosis and treatment of primary liver cancer in China (2019 edition)[J]. Chin J Hepatol, 2020, 28(2): 112-128. DOI:10.3760/cma.j.issn.1007-3418.2020.02.004 |
| [10] |
Korean Liver Cancer Association (KLCA) and National Cancer Center (NCC). 2018 Korean liver cancer association-national cancer center Korea practice guidelines for the management of hepatocellular carcinoma[J]. Korean J Radiol, 2019, 20(7): 1042-1113. DOI:10.3348/kjr.2019.0140 |
| [11] |
Marrero JA, Kulik LM, Sirlin CB, et al. Diagnosis, staging, and management of hepatocellular carcinoma: 2018 practice guidance by the American association for the study of liver diseases[J]. Hepatology, 2018, 68(2): 723-750. DOI:10.1002/hep.29913 |
| [12] |
European Association for the Study of the Liver. EASL clinical practice guidelines: management of hepatocellular carcinoma[J]. J Hepatol, 2018, 69(1): 182-236. DOI:10.1016/j.jhep.2018.03.019 |
| [13] |
Lu SN, Wang JH, Wu CW, et al. Management consensus guideline for hepatocellular carcinoma: 2016 updated by the Taiwan Liver Cancer Association and the Gastroenterological Society of Taiwan[J]. J Formos Med Assoc, 2018, 117(5): 381-403. DOI:10.1016/j.jfma.2017.09.007 |
| [14] |
Omata M, Cheng AL, Kokudo N, et al. Asia-Pacific clinical practice guidelines on the management of hepatocellular carcinoma: a 2017 update[J]. Hepatol Int, 2017, 11(4): 317-370. DOI:10.1007/s12072-017-9799-9 |
| [15] |
Carrilho FJ, de Mattos AA, Vianey AF, et al. Brazilian society of hepatology recommendations for the diagnosis and treatment of hepatocellular carcinoma[J]. Arq Gastroenterol, 2015, 52(Suppl 1): 2-14. DOI:10.1590/s0004-28032015000500001 |
| [16] |
Sastre J, Díaz-Beveridge R, García-Foncillas J, et al. Clinical guideline SEOM: hepatocellular carcinoma[J]. Clin Transl Oncol, 2015, 17(12): 988-995. DOI:10.1007/s12094-0151451-3 |
| [17] |
Kudo M, Matsui O, Izumi N, et al. JSH consensus-based clinical practice guidelines for the management of hepatocellular carcinoma: 2014 update by the liver cancer study group of Japan[J]. Liver Cancer, 2014, 3(3/4): 458-468. DOI:10.1159/000343875 |
| [18] |
Kumar A, Acharya SK, Singh SP, et al. The Indian National Association for Study of the Liver (INASL) Consensus on prevention, diagnosis and management of hepatocellular carcinoma in India: the Puri recommendations[J]. J Clin Exp Hepatol, 2014, 4(Suppl 3): S3-26. DOI:10.1016/j.jceh.2014.04.003 |
| [19] |
Méndez-Sánchez N, Ridruejo E, de Mattos AA, et al. Latin American Association for the Study of the Liver (LAASL) clinical practice guidelines: management of hepatocellular carcinoma[J]. Ann Hepatol, 2014, 13(Suppl 1): S4-40. DOI:10.1016/S1665-2681(19)30919-6 |
| [20] |
Eskens FALM, van Erpecum KJ, de Jong KP, et al. Hepatocellular carcinoma: Dutch guideline for surveillance, diagnosis and therapy[J]. Neth J Med, 2014, 72(6): 299-304. |
| [21] |
Bolondi L, Cillo U, Colombo M, et al. Position paper of the Italian Association for the Study of the Liver (AISF): the multidisciplinary clinical approach to hepatocellular carcinoma[J]. Dig Liver Dis, 2013, 45(9): 712-723. DOI:10.1016/j.dld.2013.01.012 |
| [22] |
Verslype C, Rosmorduc O, Rougier P. Hepatocellular carcinoma: ESMO-ESDO clinical practice guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2012, 23(Suppl 7): Ⅶ41-48. DOI:10.1093/annonc/mds225 |
| [23] |
Abdo AA, Hassanain M, Aljumah AR, et al. Saudi guidelines for the diagnosis and management of hepatocellular carcinoma: technical review and practice guidelines[J]. Ann Saudi Med, 2012, 32(2): 174-199. DOI:10.5144/0256-4947.2012.174 |
| [24] |
Ferenci P, Fried M, Labrecque D, et al. Hepatocellular carcinoma (HCC): a global perspective[J]. J Clin Gastroenterol, 2010, 44(4): 239-245. DOI:10.1097/MCG.0b013e3181d46ef2 |
| [25] |
Asia-Pacific Working Party on Prevention of Hepatocellular Carcinoma. Prevention of hepatocellular carcinoma in the Asia-Pacific region: consensus statements[J]. J Gastroenterol Hepatol, 2010, 25(4): 657-663. DOI:10.1111/j.1440-1746.2009.06167.x |
| [26] |
Poon D, Anderson BO, Chen LT, et al. Management of hepatocellular carcinoma in Asia: consensus statement from the Asian Oncology Summit 2009[J]. Lancet Oncol, 2009, 10(11): 1111-1118. DOI:10.1016/s1470-2045(09)70241-4 |
| [27] |
Ryder SD. Guidelines for the diagnosis and treatment of hepatocellular carcinoma (HCC) in adults[J]. Gut, 2003, 52(Suppl 3): iii1-8. DOI:10.1136/gut.52.suppl_3.iii1 |
| [28] |
Ji MF, Liu ZW, Chang ET, et al. Mass screening for liver cancer: results from a demonstration screening project in Zhongshan City, China[J]. Sci Rep, 2018, 8(1): 12787. DOI:10.1038/s41598-018-31119-9 |
| [29] |
靳英辉, 张林, 黄笛, 等. 临床实践指南制定方法——指南制定参与人员及组成分配[J]. 中国循证心血管医学杂志, 2018, 10(4): 385-391. Jin YH, Zhang L, Huang D, et al. Methodology for clinical practice guidelines-members, groups or committee of guideline development[J]. Chin J Evid Based Cardiovasc Med, 2018, 10(4): 385-391. DOI:10.3969/j.issn.16744055.2018.04.01 |
| [30] |
Alonso-Coello P, Irfan A, Solà I, et al. The quality of clinical practice guidelines over the last two decades: a systematic review of guideline appraisal studies[J]. Qual Saf Health Care, 2010, 19(6): e58. DOI:10.1136/qshc.2010.042077 |
| [31] |
董碧蓉, 岳冀蓉, 徐英. 制定循证指南的原则[J]. 中国循证医学杂志, 2006, 6(2): 80-83. Dong BR, Yue JR, Xu Y. The principles of developing evidence-based guideline[J]. Chin J Evid-Based Med, 2006, 6(2): 80-83. DOI:10.3969/j.issn.1672-2531.2006.02.003 |
| [32] |
丁泓帆, 杨楠, 邓围, 等. WHO指南制定的基本原则和方法[J]. 中国循证医学杂志, 2016, 16(4): 471-477. Ding HF, Yang N, Deng W, et al. Principles and methods of WHO guidelines development[J]. Chin J Evid-Based Med, 2016, 16(4): 471-477. DOI:10.7507/1672-2531.20160072 |
| [33] |
谭力铭, 薛竑飏, 范曼如, 等. 临床实践指南制订方法——指南发布前的外部评审[J]. 中国循证心血管医学杂志, 2019, 11(7): 771-773. Tan LM, Xue HY, Fan MR, et al. Methodology for clinical practice guidelines-external review of guidelines prior to publication[J]. Chin J Evid Based Cardiovasc Med, 2019, 11(7): 771-773. DOI:10.3969/j.issn.1674-4055.2019.07.02 |
| [34] |
Ronot M, Pommier R, Dioguardi Burgio M, et al. Hepatocellular carcinoma surveillance with ultrasoundcost-effectiveness, high-risk populations, uptake[J]. Br J Radiol, 2018, 91(1090): 20170436. DOI:10.1259/bjr.20170436 |
| [35] |
陈建国, 张永辉, 朱健, 等. 启东肝癌的早诊早治及筛查效果评价[J]. 中华肿瘤杂志, 2017, 39(12): 946-951. Chen JG, Zhang YH, Zhu J, et al. Early diagnosis and early treatment for liver cancer in Qidong: survival of patients and effectiveness of screening[J]. Chin J Oncol, 2017, 39(12): 946-951. DOI:10.3760/cma.j.issn.0253-3766.2017.12.013 |
 2021, Vol. 42
2021, Vol. 42