文章信息
- 李子帅, 曹广文.
- Li Zishuai, Cao Guangwen
- 乙型肝炎病毒变异诱发肝细胞癌的分子机制及其研究进展
- Molecular mechanism and research progress of hepatocellular carcinoma induced by hepatitis B virus mutation
- 中华流行病学杂志, 2021, 42(1): 15-21
- Chinese Journal of Epidemiology, 2021, 42(1): 15-21
- http://dx.doi.org/10.3760/cma.j.cn112338-20200923-01178
-
文章历史
收稿日期: 2020-09-23
原发性肝癌位居我国人口恶性肿瘤死亡原因的第二位,居人群平均寿命以下恶性肿瘤死亡原因的第一位[1]。我国原发性肝癌中95%是肝细胞癌(hepatocellular carcinoma,HCC),约90%的HCC是HBV感染所致[2]。我国人口占全球的18%,慢性HBV感染者占全球的39%(0.94亿/2.4亿),HCC占全球的半数以上[3]。我国HBV感染者中32%的男性和9%的女性将在人口平均年龄之前(75岁)死于HCC,现存HBV感染者中2 000万人将因HCC而过早死亡[4]。HCC恶性程度高,早期诊断难,手术根治疗率较低,术后易复发,导致发病率和死亡率接近1:1。降低HCC导致生命折损的关键在于确定何种HBV感染者更易发生HCC或术后复发,发现可控病因并有针对地开展精准防治[5]。我们通过研究HBV慢性感染诱发HCC的分子机制,并归纳该领域的相关进展,提出了癌症进化发育学(Cancer Evo-Dev)这一新学说,为癌症预防控制提供新的理论依据。
1.我国HBV的基因组流行学和致癌过程中的“末路进化”问题:
(1)我国HBV基因组流行病学特征:我们建立了准确、快速、联合和低成本地鉴定HBV基因型/亚型的Multiplex-PCR方法[6],并在我国大陆共160个疾病监测点对1~59岁自然人群共抽样81 775例开展了HBV基因组流行病学研究,对4 150例HBsAg阳性者进行HBV基因分型,发现我国主要的HBV基因型为C(68.3%)、B(25.5%)、混合型(5.7%)和D(1.5%);其主要亚型为C2(58.0%)、B2(27.3%)和C1(10.7%)。HBV C2分布由北向南逐渐降低,HBV B2和C1则与之相反。在南部山区和少数民族居住区,HBV基因型/亚型分布差异较大。在闽南沿海地区,B基因型占80%(与中国台湾地区相似);C1型集中在广东省;在西藏自治区发现了一种新基因亚型,命名为C9;在新疆维吾尔自治区发现HBV基因型D中有27.8%前S区没有33个碱基缺失,D型HBV发生特征性改变,属于古老型HBV D型,在人类学研究中有重大价值。在生物学特征方面,HBV B2在低年龄组复制能力强,HBV浓度和HBeAg阳性率均高于同年龄组HBV C2感染者,但随着年龄增加较易被清除;而HBV C2则相反。在无症状HBV感染者中,PreS缺失、T31C、T1753V和A1762T/G1764A等HCC相关变异在HBV C2中的发生频率显著高于HBV B2;而G1896A和G1899A等与急性/暴发感染相关变异在HBV B2中的频率显著高于HBV C2[7]。在HBV亚型与肝病关系方面,我们发现:① HBV B2易横向传播导致急性乙型肝炎(乙肝),致急性乙肝能力是HBV C2的4倍,而HBV C2所致急性乙肝的慢性化发生率是HBV B2的6.97倍[8];②HBV C2造成肝硬化和HCC的能力显著高于HBV B2,尤其是在40岁以上、男性、病毒载量≥104拷贝/ml的人群;③ HBV B2导致的年轻HCC术后易复发,原因是病毒浓度高[9]。
(2)我国HBV主要亚型的进化特征、致癌的强度差异和致癌机制的异同:我们用无症状携带者的HBV DNA测序结果确定了各亚型的野生序列,并以此为参照,发现了66种未被报道肝病相关HBV变异;其中HBV C2和B2中主要HCC相关变异谱有一致性,肝硬化相关HBV变异谱也类似。应用1998年在上海市建立的HCC病因学前瞻队列,我们首次发现并相互验证了基因型C的C1673T、A1726C、A1727T、C1730G、C1766T、T1768A、C1773T和C1799G等变异是HCC的独立危险因素[10]。HBV C2亚型的21个PreS1野生型位点中81.0%与肝硬化有关,而对应的变异位点与HCC显著相关[11-12],PreS1区序列差异可指示不同肝病结局。通过对C型HBV感染者的随访队列研究,我们发现在C型HBV感染者中,HBV核苷酸突变(C1653T、T1753V、A1762T/G1764A、T1674CG、A3120T和A2962G)可以增加肝癌发生的危险性[13-14]。占我国68.3%的C型HBV在感染后,比占25.5%的B型HBV更易引起慢性感染[7, 9]。就我国人口中这两种常见HBV基因型,C型更容易引起肝硬化和HCC[9, 15]。主要原因:一是C型与HLA-Ⅱ型抗原DP、DQ和DR交互作用,引发免疫失衡、慢性感染及慢性非可控性炎症[16-18],进而诱发HBV变异和选择,促进突变型HBV的产生,促进HCC发生发展;二是慢性炎症促进的白介素(IL)-6等炎症分子表达,后者激活载脂蛋白B mRNA编辑酶催化多肽(apolipoprotein B mRNA-editing enzyme catalytic polypeptides,APOBEC)3B的表达,同时抑制尿嘧啶-DNA糖基化酶(uracil-DNA glycosylase,UNG)表达,导致APOBEC3B-UNG平衡失调,引起大量HCC相关体细胞突变和病毒变异,促进变异细胞去分化过程,最终导致HCC发生发展[19]。B型HBV主要在年轻人群中传播,因为病毒浓度比较高,易引起急性肝病,引发急性炎症被清除[8],且诱发的突变多是急性/暴发感染相关变异,致癌能力相对较弱,但是在年轻感染者中容易导致HCC术后复发[9]。
(3)HBV致癌过程中的“末路进化”特征:在慢性病毒感染诱导的癌症中,除了宿主细胞,病毒同样进行进化过程。HBV属于肝病毒科,在物种的长期进化中具有进化保守性。然而,在慢性感染期间,HBV基因组的进化在部分感染者中尤为明显。具有显著肝癌风险的HBV突变主要位于增强子Ⅱ/基本核心启动子和PreS区域,而在HBV诱导的致癌“三部曲”(慢性肝炎-肝硬化-HCC)中,这些突变的种类和频率经常连续累积[16, 20-21]。有些HBV突变发生在早期,如A1762T/G1764A,而有些突变如T1753V、C1653T、G1899A和PreS缺失则在病毒进化后期才明显[22]。机体对慢性HBV感染的反应常以免疫应答引起的肝细胞损伤和转氨酶释放为特征,而且通常伴随着HBeAg血清转换和HBV变异的增加,这表明免疫细胞对病毒突变体具有定向选择作用。在婴儿期或儿童期或成年人感染早期获得的HBV通常是野生型[16, 20]。在慢性炎症过程中,特别是在HBeAg由阳性转变为阴性后,变异的HBV亚群逐渐增加。在免疫选择的作用下,变异HBV基因型的主要特征之一是CD8+T细胞表位缺乏。虽然与HCC相关的HBV变异株存在于胎儿脐带血中,但新生儿感染通常是由野生型HBV引起的,而不是由变异亚群引起的。在1~15岁的HBV感染儿童中,HCC相关突变的频率随着年龄的增加而增加。然而,与他们至少有25年的慢性HBV感染史的母亲相比,新生儿HCC相关HBV变异较少[22]。野生型HBV具有感染肝细胞,促进病毒传播,并有助于维持其病毒种类的优势。然而,HBV致癌进化虽然可以引起恶性转化,但已经失去了人与人之间感染的优势。因此,HBV致癌进化随携带者死亡而终止,这被称为HBV的“末路进化”演变。
2.炎症免疫通路基因遗传多态性与病毒变异的交互作用:
(1)HBV相关HCC遗传易感位点与免疫和炎症相关基因表达水平密切相关:早期研究发现HBV C2促癌作用依赖于NF-κB遗传多态性[23],随后通过全基因组关联分析筛查中国人HCC、肝硬化和慢性乙肝的遗传易感位点,我们发现了2个新的HCC易感位点,即STAT4基因rs7574865和人类白细胞抗原(human leukocyte antigen,HLA)基因HLA-DQ rs9275319位点。转录因子STAT4 rs7574865 G等位基因显著增加HCC发病危险。在HCC患者中,无论癌组织还是癌旁肝组织,携带rs7574865 GG基因型者STAT4表达水平均显著低于TT基因型者,STAT4在癌组织中表达水平显著低于癌旁肝组织,提示STAT4发挥肿瘤抑制功能。HLA-DQ支撑抗原提呈细胞表面HLA-Ⅱ类复合物的形成。位于HLA基因HLA-DQB1和HLA-DQA2之间rs9275319位点A等位基因显著增加HCC风险。在HLA-DQB1和HLA-DQA2的33个等位基因中,2个等位基因(HLA-DQB1*0401和HLA-DQA1*0303)与rs9275319存在中等程度的连锁不平衡关系,而且与HCC危险性显著相关[24]。由此可见,遗传因素是通过调控免疫/炎症分子的表达,影响机体免疫功能,造成肝脏局部慢性活动性炎症;慢性炎症通过对HBV变异和体细胞变异的选择,进而促进HCC发生发展。
(2)免疫/炎症通路关键基因的遗传多态性通过调控免疫功能参与HCC相关HBV变异的选择,并与HBV变异协同促癌:STAT3和NF-κB是乙肝致癌过程中最主要的炎症信号通路,其活性增强促进癌症发生发展。研究发现STAT3基因的rs2293152 GG基因型显著增加HBV感染者发生HCC的风险,rs2293152少见基因型显著促进A1762T/G1764A和T1674C/G的免疫选择,而且rs2293152等STAT3遗传位点与促癌HBV变异存在显著的交互作用,协同促进癌症发生[21]。在HBV致癌过程中关键炎症通路NF-κB复合体核心因子NF-κB1和功能抑制分子NFKBIA启动子遗传多态性是HBV C2感染者发生HCC的主要危险因素。我们发现NFKBIA基因启动子-826(rs2233406)和-881(rs3138053)的少见等位基因显著增加HCC风险,主要是因为这2个等位基因组合导致NFKBIA表达量降低,NF-κB活性升高,促进炎症对A1762T/G1764A、T1753V、preS缺失等促癌HBV变异的免疫选择,进而促进HCC发生发展;而且rs2233406少见等位基因与A1762T/G1764A的交互作用显著增加了HBV C2感染者发生HCC的风险[20]。在中国人群中,HLA-DP遗传位点rs3077、rs3135021和rs9277535主要等位基因与HBV感染慢性化密切相关,常导致免疫系统无力彻底清除HBV,进而长期维持炎症微环境,促进HCC相关HBV变异的免疫选择;HLA-DQ遗传位点rs9275319的少见等位基因与乙肝慢性化呈负相关;rs2856718的少见等位基因与HCC发生呈负相关。促进HBV免疫清除的HLA-DP基因型与C1653T、T1674C/G、A1846T、G1896A、preS缺失等促癌HBV变异呈负相关,与G1652A、T1673C、G1719T、G1730C、G1799C等抑癌HBV变异呈正相关。HLA-DP和HLA-DQ遗传易感性与HBV变异在促进乙肝恶性转化中存在显著的交互作用,这些HBV变异只有在合适的HLA遗传背景下才能够显著促进HCC的发生[16-17]。以上这些能促进乙肝慢性化和促癌HBV变异免疫选择的HLA-Ⅱ型抗原遗传位点在中国汉族人群中往往是高频等位基因,但在高加索人群中往往是低频等位基因[25]。该研究结果部分解释了为何中国人群感染HBV后容易导致慢性化,且易发生HCC。
3. APOBECs家族构建炎-癌转化的桥梁:APOBECs家族具有脱氨基活性,可以将单链DNA和RNA上的胞嘧啶转化为尿嘧啶(C > U),对应核苷酸链出现G > A或C > T变异,导致基因组变异[26]。该家族的核酸编辑作用是目前所知分布最广的癌症体细胞变异形式。炎症可通过诱导APOBECs表达,促进病毒和宿主基因组变异。因此,我们认为APOBECs是联系炎症和癌症的桥梁,APOBECs应该是HBV促进HCC发生发展的核心分子[27]。
(1)APOBECs驱动HBV及人体细胞变异:生理情况下,APOBECs在肝组织内衡量表达,但在HBV等病原体感染时,如图 1所示炎症因子如干扰素α(Interferon α,IFN-α)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、IL-6和IL-1β可以通过NF-κB和STAT1等信号通路刺激APOBECs过量表达,引起大量HCC相关体细胞突变和病毒变异,最终导致HCC发生发展[19]。已发现的APOBECs家族成员有11个,包括APOBEC1(A1)、APOBEC2(A2)、APOBEC3A~H(3A、3B、3C、3D、3E、3F、3H)、APOBEC4(A4)以及活化诱导脱氨酶(activation induced cytidine deaminase,AID)。其中,APOBEC3和AID是该家族中主要起免疫活性作用的成员,APOBEC3可高效抑制多种反转录病毒的复制过程,具有显著的抗病毒固有免疫活性[28]。研究发现在女性宫颈感染期间,APOBEC3诱导的人乳头瘤病毒-16(human papillomaviruses 16,HPV16)基因组突变与病毒清除相关[29]。HBV感染机体后,一方面,APOBEC3通过诱导大量C > U突变,进而启动包括抑制表面蛋白编码区(S区)启动子表达、降解前基因组RNA以及阻碍病毒基因组核衣壳化等多个步骤,高效抑制HBV的复制[27]。共价闭合环状DNA(covalently closed circular DNA,cccDNA)是维持HBV慢性感染的关键,APOBEC3同样可以诱导其降解[30]。尽管APOBEC3可显著降解HBV RNA及HBV cccDNA,但是仍有少许HBV发生逃逸而幸存,且这些幸存者携带有在APOBECs作用下的变异特征。另一方面,APOBECs家族某些成员如A3B、A3C和AID可显著地促进HBV产生变异。APOBEC3/AID常导致HBV基因组中C > T和G > A突变。AID可以结合HBV核心蛋白并包被进核衣壳中,引起新合成的HBV RNA上大量G > A或C > T突变的产生。APOBEC3家族的抗病毒DNA胞嘧啶脱氨酶被认为是癌症的第二大突变来源,仅次于年龄因素。近日研究发现人类APOBEC3A在小鼠结肠和肝脏组织中的表达增加了肿瘤的发生[31]。在活化诱导型胞苷脱氨酶转基因动物模型中,通过组成性表达活化诱导型胞苷脱氨酶,进而诱发TP53和β-catenin基因突变,可导致肝癌(13.75%)、肺癌(8.75%)和胃癌(1.25%)[27]。
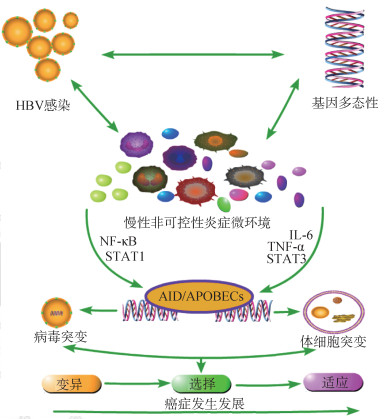
|
| 图 1 载脂蛋白B mRNA编辑酶催化多肽(APOBECs)家族构建炎-癌转化桥梁 |
(2)APOBECs与UNG形成动态平衡:UNG是核酸碱基切除修复通路中的关键分子,可以识别并切除APOBECs诱导的C > U突变,引发核酸链水解以进行错配修复[32]。然而,遗传易感性、病毒变异和不平衡的免疫系统相互作用,阻碍了HBV等病原体的绝对消除,导致伴随APOBEC表达的慢性炎症。在炎症微环境中,促炎症细胞因子/趋化因子和NF-κB/TNF-α信号通路持续激活,在转录水平显著增加APOBECs的表达。由此产生的持续高水平的APOBEC表达可以编辑在转录和复制过程中暂时产生的单链DNA,从而导致人类基因组的突变。APOBECs和UNG之间的平衡被打破,总的诱变水平超过下游修复通路的储备能力,体细胞突变大量产生并积累,从而促进癌症发生发展过程。APOBEC3B rs2267401-G等位基因和UNG rs3890995-C等位基因显著增加肝癌风险,rs2267401 T > G和rs3890995 T > C分别增强了APOBEC3B启动子和UNG增强子的活性。IL-6可显著增强APOBEC3B启动子活性,抑制UNG增强子活性,且对携带rs2267401-G的APOBEC3B启动子和携带rs3890995-C的UNG增强子作用更为明显。易感于IL-6诱导的APOBEC3B-UNG失衡的基因多态性通过促进APOBEC标签HBV突变的产生而增加HCC的风险[19]。因此,APOBEC家族在高危感染、炎症、癌基因和体细胞突变之间提供了联系。
(3)AID/APOBECs调控去甲基化和EMT:AID/APOBEC不仅促进体细胞超突变,而且直接通过脱掉5-甲基胞嘧啶或5-羟甲基胞嘧啶的氨基,并结合碱基切除修复来交换胞嘧啶,从而促进基因去甲基化,消除表观遗传记忆,稳定胚胎干细胞的多能性状态[33]。上皮间质转化(epithelial to mesenchymal transition,EMT)是癌症发展背后的推动力,其各种形式是由转录因子Snai1(SNAI1)、SNAI2、ZEB1(ZEB1)和ZEB2(ZEB2)驱动的[34]。AID的表达是由炎症信号诱导的,炎症信号诱导未转化的上皮细胞和癌细胞发生EMT。AID调控主要EMT-TFs(SNAI1、SNAI2、ZEB1和ZEB2)在EMT中的表达。AID敲除后,几个关键的EMT-TFs表达受到抑制,导致EMT过程停滞,阻止了细胞获得侵袭性特性,SNAI1、SNAI2、ZEB1和ZEB2启动子附近的CpG岛的甲基化程度增加[35-36]。AID介导的、依赖于CpG岛甲基化的突变被证明是癌症发生的共同特征[37]。因此,我们有理由推测,胚胎因子作为肿瘤生物标志物的重新表达可能是由AID/APOBECs引起的表观遗传重编程所致,其表达是由促炎因子诱导的。
4.癌症进化发育学及其在肿瘤防治中的应用价值与展望:在以上三部分研究结果基础上,我们首次提出了癌症进化发育学这一癌症发生新理论假说:由遗传易感性和环境暴露(如病毒感染)的相互作用引起的免疫失衡维持慢性不可控性炎症,不可控性炎症通过失衡包括APOBECs在内的致突变因素和包括UNG在内的突变修复因素来促进病毒和宿主基因组的突变,从而促进与癌症相关的体细胞突变和病毒突变,大多数具有基因组突变和变异病毒的细胞在炎性微环境中的生存竞争中被淘汰,只有小部分改变生存信号通路并表现出“干性”特征的突变细胞能够存活并发挥致癌细胞的功能[38]。其特点是病毒和宿主细胞都经历了一个“突变-选择-适应”的进化过程。癌症的发展一般具有“反向进化”和“逆向分化”的特点。
肿瘤早期特异性预防的关键是在肿瘤发生前确定何种危险因素暴露人群易发生肿瘤,鉴定高危癌前病变,提高肿瘤病因学认知。癌症进化发育学提出在遗传易感性存在的条件下,HBV感染容易导致炎症慢性化,抗病毒治疗可以降低炎症,进而降低HCC的发生率和延长HCC患者有效生存,做到HCC特异性预防,实现HCC预防工作“关口前移”,以达到预防医学“治未病”的目的[39]。其次,在癌症进化晚期,治疗的重点在于有效的靶向、个体化治疗,以提高患者生存质量,延长有效生存时间。癌症进化发育学指出HBV及其癌变前肝细胞经过炎症诱导的“变异-选择-适应”的进化过程,使癌症起始细胞经获得逆向进化机会,表现出癌症进化的异质性,这为通过选择针对枢纽分子的高效靶向抑制剂阻断信号通路来靶向治疗晚期癌症提供了理论依据[40]。癌症进化发育学说还可以指导癌症分子分型,明确癌症进化阶段和干预节点。例如,在癌症进化发育学相关的一项队列研究中,我们发现抗病毒治疗是HCC术后复发和死亡的唯一独立保护因素,然而对患者残肝基因组(癌旁肝组织中)中整合且表达了C端截短型HBx基因(Ct-HBx)的患者,抗病毒治疗并不能有效提高患者的预后。变异型HBx基因的整合既是HBV慢性感染发生HCC的危险因素,也是HCC术后复发的决定因素,这对HBV-HCC术后复发转移的精准防治具有实际指导价值[41]。随着癌症进化发育学的不断完善,这一学说将为抗癌工作者提供更加有效的特异性预防新策略、发现癌症发生和复发转移新标志和靶向治疗癌症的新靶标,进一步提高癌症治疗的科学性和有效性。
5.总结:在对HBV诱发HCC研究的基础上,我们首次提出了癌症进化发育学说,其核心理论体系反映了病毒相关癌症发生和发展过程中的慢性活动性炎症促进病毒和体细胞“变异-选择-适应”的癌症进化发育过程。癌症进化发育学说确定了什么样的癌前病变或损伤将发展成癌症,证明了什么样的预防方案或治疗方案可以降低癌症的发病率和延缓其发生,并专门针对推动癌症进化和发展的关键途径,以降低发病率和死亡率。对于控制HBV诱导的HCC这一高度致命的恶性肿瘤,积极的预防应该是重中之重,癌症进化发育学说有助于实现“4P模式医学”(预测性、预防性、个性化和大众参与性),从而促进HCC的预防和控制。此外,癌症进化发育学说对几乎所有组织类型恶性肿瘤的发病机制及公共卫生预防和控制方面都将发挥建设性指导作用。我们推测,癌症进化发育学同样可以指导其他炎症相关肿瘤的预测、个体化预防和靶向治疗。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Wang S, Du XY, Han X, et al. Influence of socioeconomic events on cause-specific mortality in urban Shanghai, China, from 1974 to 2015:a population-based longitudinal study[J]. CMAJ, 2018, 190(39): E1153-1161. DOI:10.1503/cmaj.180272 |
| [2] |
Yang F, Ma LT, Yang Y, et al. Contribution of hepatitis B virus infection to the aggressiveness of primary liver cancer:a clinical epidemiological study in Eastern China[J]. Front Oncol, 2019, 9: 370. DOI:10.3389/fonc.2019.00370 |
| [3] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30. DOI:10.3322/caac.21590 |
| [4] |
张宏伟, 曹广文. 上海市肝癌预防研究工作的成就与挑战[J]. 上海预防医学, 2019, 31(1): 33-40. Zhang HW, Cao GW. Achievements and challenges of primary liver cancer prophylaxis in Shanghai, China[J]. Shanghai J Prev Med, 2019, 31(1): 33-40. DOI:10.19428/j.cnki.sjpm.2019.19205 |
| [5] |
曹广文. 我国恶性肿瘤防治研究和实践需要技术、管理和观念的创新[J]. 中华流行病学杂志, 2017, 38(1): 3-12. Cao GW. Innovations on technology, management and concept are indispensible for scientific research, prevention and treatment of malignant tumor in China[J]. Chin J Epidemiol, 2017, 38(1): 3-12. DOI:10.3760/cma.j.issn.0254-6450.2017.01.002 |
| [6] |
Chen JS, Yin JH, Tan XQ, et al. Improved multiplex-PCR to identify hepatitis B virus genotypes A-F and subgenotypes B1, B2, C1 and C2[J]. J Clin Virol, 2007, 38(3): 238-243. DOI:10.1016/j.jcv.2006.12.007 |
| [7] |
Yin JH, Zhang HW, He YC, et al. Distribution and hepatocellular carcinoma-related viral properties of hepatitis B virus genotypes in Mainland China:a community-based study[J]. Cancer Epidemiol Biomarkers Prev, 2010, 19(3): 777-786. DOI:10.1158/1055-9965.Epi-09-1001 |
| [8] |
Zhang HW, Yin JH, Li YT, et al. Risk factors for acute hepatitis B and its progression to chronic hepatitis in Shanghai, China[J]. Gut, 2008, 57(12): 1713-1720. DOI:10.1136/gut.2008.157149 |
| [9] |
Yin JH, Zhang HW, Li CZ, et al. Role of hepatitis B virus genotype mixture, subgenotypes C2 and B2 on hepatocellular carcinoma:compared with chronic hepatitis B and asymptomatic carrier state in the same area[J]. Carcinogenesis, 2008, 29(9): 1685-1691. DOI:10.1093/carcin/bgm301 |
| [10] |
Yin JH, Xie JX, Liu SJ, et al. Association between the various mutations in viral core promoter region to different stages of hepatitis B, ranging of asymptomatic carrier state to hepatocellular carcinoma[J]. Am J Gastroenterol, 2011, 106(1): 81-92. DOI:10.1038/ajg.2010.399 |
| [11] |
Yin JH, Xie JX, Zhang HW, et al. Significant association of different preS mutations with hepatitis B-related cirrhosis or hepatocellular carcinoma[J]. J Gastroenterol, 2010, 45(10): 1063-1071. DOI:10.1007/s00535-010-0253-1 |
| [12] |
Liu SJ, Xie JX, Yin JH, et al. A matched case-control study of hepatitis B virus mutations in the preS and core promoter regions associated independently with hepatocellular carcinoma[J]. J Med Virol, 2011, 83(1): 45-53. DOI:10.1002/jmv.21829 |
| [13] |
刘吉洛, 蒲蕊, 马龙腾, 等. C型HBV感染者发展为肝癌的危险因素及风险预测[J]. 中华流行病学杂志, 2018, 39(11): 1459-1464. Liu JL, Pu R, Ma LT, et al. Risk factors analysis and a new risk scoring system predicting hepatocarcinogenesis for chronic genotype C HBV infected patients[J]. Chin J Epidemiol, 2018, 39(11): 1459-1464. DOI:10.3760/cma.j.issn.0254-6450.2018.11.008 |
| [14] |
蒲蕊, 丁一波, 侯晓玫, 等. 乙型肝炎病毒感染者中病毒基因型与对应的病毒变异对肝癌发生的影响:队列研究[J]. 上海预防医学, 2015, 27(7): 374-380, 391. Pu R, Ding YB, Hou XM, et al. Impact of viral genotypes and their mutations on the occurrence of hepatocellular carcinoma among HBV infected patients:a cohort study[J]. Shanghai J Prev Med, 2015, 27(7): 374-380, 391. DOI:10.19428/j.cnki.sjpm.2015.07.002 |
| [15] |
Yin JH, Zhao J, Zhang HW, et al. HBV genotype C is independently associated with cirrhosis in community-based population[J]. World J Gastroenterol, 2010, 16(3): 379-383. DOI:10.3748/wjg.v16.i3.379 |
| [16] |
Zhang Q, Yin JH, Zhang YW, et al. HLA-DP polymorphisms affect the outcomes of chronic hepatitis B virus infections, possibly through interacting with viral mutations[J]. J Virol, 2013, 87(22): 12176-12186. DOI:10.1128/jvi.02073-13 |
| [17] |
Ji XW, Zhang Q, Li B, et al. Impacts of human leukocyte antigen DQ genetic polymorphisms and their interactions with hepatitis B virus mutations on the risks of viral persistence, liver cirrhosis, and hepatocellular carcinoma[J]. Infect Genet Evol, 2014, 28: 201-209. DOI:10.1016/j.meegid.2014.09.032 |
| [18] |
Deng Y, Li P, Liu WB, et al. The genetic polymorphism down-regulating HLA-DRB1 enhancer activity facilitates HBV persistence, evolution and hepatocarcinogenesis in the Chinese Han population[J]. J Viral Hepat, 2020, 27(11): 1150-1161. DOI:10.1111/jvh.13353 |
| [19] |
Liu WB, Wu JF, Yang F, et al. Genetic polymorphisms predisposing the interleukin 6-induced APOBEC3B-UNG imbalance increase HCC risk via promoting the generation of APOBEC-signature HBV mutations[J]. Clin Cancer Res, 2019, 25(18): 5525-5536. DOI:10.1158/1078-0432.Ccr-18-3083 |
| [20] |
Zhang Q, Ji XW, Hou XM, et al. Effect of functional nuclear factor-kappaB genetic polymorphisms on hepatitis B virus persistence and their interactions with viral mutations on the risk of hepatocellular carcinoma[J]. Ann Oncol, 2014, 25(12): 2413-2419. DOI:10.1093/annonc/mdu451 |
| [21] |
Xie JX, Zhang YW, Zhang Q, et al. Interaction of signal transducer and activator of transcription 3 polymorphisms with hepatitis B virus mutations in hepatocellular carcinoma[J]. Hepatology, 2013, 57(6): 2369-2377. DOI:10.1002/hep.26303 |
| [22] |
Li ZX, Xie ZY, Ni HX, et al. Mother-to-child transmission of hepatitis B virus:evolution of hepatocellular carcinoma-related viral mutations in the post-immunization era[J]. J Clin Virol, 2014, 61(1): 47-54. DOI:10.1016/j.jcv.2014.06.010 |
| [23] |
He YC, Zhang HW, Yin JH, et al. IkappaBalpha gene promoter polymorphisms are associated with hepatocarcinogenesis in patients infected with hepatitis B virus genotype C[J]. Carcinogenesis, 2009, 30(11): 1916-1922. DOI:10.1093/carcin/bgp226 |
| [24] |
Jiang DK, Sun JL, Cao GW, et al. Genetic variants in STAT4 and HLA-DQ genes confer risk of hepatitis B virus-related hepatocellular carcinoma[J]. Nat Genet, 2013, 45(1): 72-75. DOI:10.1038/ng.2483 |
| [25] |
Li ZX, Hou XM, Cao GW. Is mother-to-infant transmission the most important factor for persistent HBV infection?[J]. Emerg Microbes Infect, 2015, 4(5): e30. DOI:10.1038/emi.2015.30 |
| [26] |
Alexandrov LB, Nik-Zainal S, Wedge DC, et al. Signatures of mutational processes in human cancer[J]. Nature, 2013, 500(7463): 415-421. DOI:10.1038/nature12477 |
| [27] |
Deng Y, Du Y, Zhang Q, et al. Human cytidine deaminases facilitate hepatitis B virus evolution and link inflammation and hepatocellular carcinoma[J]. Cancer Lett, 2014, 343(2): 161-171. DOI:10.1016/j.canlet.2013.09.041 |
| [28] |
Salter JD, Bennett RP, Smith HC. The APOBEC protein family:united by structure, divergent in function[J]. Trends Biochem Sci, 2016, 41(7): 578-594. DOI:10.1016/j.tibs.2016.05.001 |
| [29] |
Zhu B, Xiao YZ, Yeager M, et al. Mutations in the HPV16 genome induced by APOBEC3 are associated with viral clearance[J]. Nat Commun, 2020, 11: 886. DOI:10.1038/s41467-020-14730-1 |
| [30] |
Lucifora J, Xia YC, Reisinger F, et al. Specific and nonhepatotoxic degradation of nuclear hepatitis B virus cccDNA[J]. Science, 2014, 343(6176): 1221-1228. DOI:10.1126/science.1243462 |
| [31] |
Law EK, Levin-Klein R, Jarvis MC, et al. APOBEC3A catalyzes mutation and drives carcinogenesis in vivo[J]. J Exp Med, 2020. DOI:10.1084/jem.20200261 |
| [32] |
Serebrenik AA, Starrett GJ, Leenen S, et al. The deaminase APOBEC3B triggers the death of cells lacking uracil DNA glycosylase[J]. Proc Natl Acad Sci USA, 2019, 116(44): 22158-22163. DOI:10.1073/pnas.1904024116 |
| [33] |
Kumar R, DiMenna L, Schrode N, et al. AID stabilizes stem-cell phenotype by removing epigenetic memory of pluripotency genes[J]. Nature, 2013, 500(7460): 89-92. DOI:10.1038/nature12299 |
| [34] |
Brabletz T, Kalluri R, Nieto MA, et al. EMT in cancer[J]. Nat Rev Cancer, 2018, 18(2): 128-134. DOI:10.1038/nrc.2017.118 |
| [35] |
Che ZF, Fan JF, Zhou ZY, et al. Activation-induced cytidine deaminase expression facilitates the malignant phenotype and epithelial-to-mesenchymal transition in clear cell renal cell carcinoma[J]. DNA Cell Biol, 2020, 39(7): 1299-1312. DOI:10.1089/dna.2019.5119 |
| [36] |
Muñoz DP, Lee EL, Takayama S, et al. Activation-induced cytidine deaminase (AID) is necessary for the epithelial-mesenchymal transition in mammary epithelial cells[J]. Proc Natl Acad Sci USA, 2013, 110(32): E2977-2986. DOI:10.1073/pnas.1301021110 |
| [37] |
Rogozin IB, Lada AG, Goncearenco A, et al. Activation induced deaminase mutational signature overlaps with CpG methylation sites in follicular lymphoma and other cancers[J]. Sci Rep, 2016, 6: 38133. DOI:10.1038/srep38133 |
| [38] |
Liu WB, Wu JF, Du Y, et al. Cancer evolution-development:experience of hepatitis B virus-induced hepatocarcino-genesis[J]. Curr Oncol, 2016, 23(1): e49-56. DOI:10.3747/co.23.2836 |
| [39] |
刘文斌, 曹广文. 癌症进化发育学:基于炎-癌转化研究的新学说[J]. 中国肿瘤生物治疗杂志, 2017, 24(2): 103-111. Liu WB, Cao GW. Cancer evolution-development:novel theory based on studies of inflammation-cancer transformation[J]. Chin J Cancer Biother, 2017, 24(2): 103-111. DOI:10.3872/j.issn.1007-385X.2017.02.001 |
| [40] |
Cao GW. Cancer Evo-Dev, a novel hypothesis derived from studies on hepatitis B virus-induced carcinogenesis[J]. Hepatoma Res, 2017, 3(10): 241-259. DOI:10.20517/2394-5079.2017.45 |
| [41] |
Yin JH, Li N, Han YF, et al. Effect of antiviral treatment with nucleotide/nucleoside analogs on postoperative prognosis of hepatitis B virus-related hepatocellular carcinoma:a two-stage longitudinal clinical study[J]. J Clin Oncol, 2013, 31(29): 3647-3655. DOI:10.1200/JCO.2012.48.5896 |
 2021, Vol. 42
2021, Vol. 42


