文章信息
- 李小雪, 丁玲, 宋丽, 高雯, 李俐, 吕元婧, 王铭, 郝敏, 王志莲, 王金桃.
- Li Xiaoxue, Ding Ling, Song Li, Gao Wen, Li Li, Lyu Yuanjing, Wang Ming, Hao Min, Wang Zhilian, Wang Jintao
- 人乳头瘤病毒感染和阴道微环境紊乱与宫颈病变的关系
- Relations of human papillomavirus infection, vaginal micro-environmental disorder with cervical lesion
- 中华流行病学杂志, 2020, 41(12): 2135-2140
- Chinese Journal of Epidemiology, 2020, 41(12): 2135-2140
- http://dx.doi.org/10.3760/cma.j.cn112338-20191022-00753
-
文章历史
收稿日期: 2019-10-22
2. 山西医科大学第二人民医院妇产科, 太原 030001
2. Department of Obstetrics and Gynecology, Second Hospital of Shanxi Medical University, Taiyuan 030001, China
宫颈癌是女性常见的恶性肿瘤之一,在女性恶性肿瘤中居第2位[1]。全球女性宫颈癌的年新发病例约52.8万例,死亡病例约26.6万例[2]。中国每年宫颈癌的新发病例约有10.2万[3],且呈现上升趋势[4]。人乳头瘤病毒(HPV)持续感染是宫颈癌及宫颈病变发生发展的最主要原因,研究发现宫颈癌患者中HPV感染率高达99.7%[5]。有资料显示,宫颈癌的发生除取决于HPV感染外,还受到营养状况[6]、大气状况[7]、阴道微环境[8]等因素的影响。近年来,随着人们对阴道微环境的认识不断完善与深入,阴道微环境与宫颈病变的关系研究逐渐成为当前宫颈癌病因研究的热点。衡量女性生殖系统健康的指标是阴道微环境平衡,阴道微环境紊乱可引发不同类型的妇科疾病。阴道微环境因子中的pH值、H2O2和清洁度,可以从阴道酸碱度、乳酸杆菌功能、微生物代谢产物等方面较全面地反映阴道微生态状况。目前研究表明,阴道微环境紊乱可能与HPV感染和阴道炎的发生有关[9-12],而HPV感染和细菌性阴道炎与宫颈癌的发生密切相关[13-14]。据此推测,宫颈病变的发生可能与阴道微环境紊乱有关,然而相关研究目前未见报道。本研究综合探讨了HPV感染和阴道微环境紊乱与宫颈病变的关系及其交互效应,为宫颈病变的病因学和发病机制的研究提供理论依据,以期为宫颈病变的预防、检测和治疗提供指导方向。
对象与方法1.研究对象:于2014年6-12月在山西省介休市建立的社区自然人群队列中,排除了妊娠期妇女,其他生殖器感染性疾病者,其他恶性肿瘤、免疫系统、消化系统、血液系统和精神疾病患者及子宫切除术史者。在知情同意的情况下,选取基线调查时经液基薄层细胞检测技术(TCT)筛查,随后通过阴道镜检查,最终经病理学确诊的1 019人纳入本研究,包括正常宫颈(NC)妇女623人,低度宫颈病变(CIN Ⅰ)妇女303人和高度宫颈病变(CIN Ⅱ/Ⅲ)妇女93人。以此形成的病例(CIN)组和对照(NC)组进行了病例对照研究。本研究获山西医科大学伦理学委员会批准。
2.资料收集:采用结构式调查问卷的方式,收集研究对象的人口学特征、生活习惯、生殖状况和既往病史等资料。使用无菌棉棒在阴道侧壁上1/3处采集分泌物,将棉棒放入装有生理盐水的塑料软试管中,待棉棒上的分泌物充分释放后,弃棉棒,得到分泌物样本液。同时用HPV专用宫颈刷于宫颈口顺时针旋转3~5圈,采集宫颈脱落细胞,将采集到的细胞置于盛有细胞保存液的样品管中,在-80 ℃的环境中保存待检,用于HPV检测。
3.实验方法:所有实验均由具有检验医师资格证的专业人员完成,实验前进行专项培训,统一检测标准和方法。①HPV分型检测:采用导流杂交法(潮州凯普生物化学有限公司)检测21种HPV亚型(包括15种高危型和6种低危型);HPV阳性表现为清晰可见的蓝紫色圆点。②阴道pH值检测:使用胶头滴管吸取少量分泌物样本液,滴于精密pH试纸,3 s后观察颜色变化,并与标准比色卡对比,记录pH值(≤4.5为正常,>4.5为异常)。③阴道H2O2检测:严格按照需氧菌性阴道炎(AV)/细菌性阴道炎5项联合测定试剂盒(北京中生金域诊断技术有限公司)说明书要求操作;阴性为正常,阳性为异常。④阴道清洁度检测:取适量分泌物样本液涂片,使用高倍显微镜观察;Ⅰ~Ⅱ度为正常,Ⅲ~Ⅳ度为异常。
4.统计学方法:核实原始资料后,将数据录入数据库,导入SPSS 20.0软件进行统计描述和统计分析。定量资料采用x±s来进行统计描述,定性资料采用χ2、趋势性χ2检验。应用logistic回归模型中的OR值(95%CI)评估因素与疾病间的关联强度。应用相加交互作用模型及交互作用相对超额危险度(RERI)、归因危险比(API)和交互作用指数(S)进行交互作用分析。检验水准为α=0.05。
结果1.一般人口学特征和相关因素分析:本研究对象共1 019人,包括NC组妇女623人(61.1%)、CIN Ⅰ组妇女303人(29.8%)和CIN Ⅱ/Ⅲ组妇女93人(9.1%)。NC、CIN Ⅰ、CIN Ⅱ/Ⅲ组的年龄分别为(49.00±13.00)、(50.00±14.00)、(50.00±17.00)岁。对3组妇女的人口学特征和相关因素进行分析,结果显示各组妇女在职业构成(χ2=6.37,P=0.041)、被动吸烟情况(χ2=14.17,P=0.001)、洗阴频率(χ2=10.57,P=0.032)、换洗内裤频率(χ2=16.34,P=0.003)、性生活后洗阴情况(χ2=7.24,P=0.027)、避孕史(χ2=7.59,P=0.023)方面差异有统计学意义,但在年龄、人均年收入、文化程度、婚姻状况、吸烟、洗澡方式、洗澡频率等方面差异无统计学意义(P>0.05)。
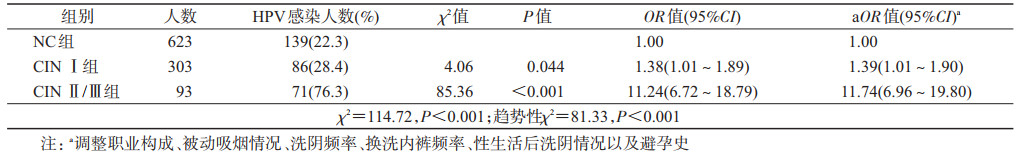
2. HPV感染与宫颈病变的关系:在NC、CIN Ⅰ和CIN Ⅱ/Ⅲ组,HPV(χ2=114.72,P<0.001)的感染率差异有统计学意义。且随着宫颈病变的加重,HPV的感染率呈逐渐升高趋势(趋势性χ2=81.33,P<0.001)。在调整宫颈病变的相关因素后,HPV感染与CIN Ⅰ和CIN Ⅱ/Ⅲ的OR值均有统计学意义,且逐渐升高(表 1)。
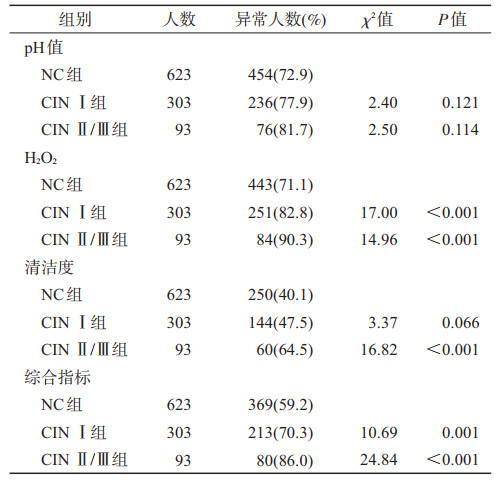
3.阴道微环境紊乱与宫颈病变的关系:按阴道微环境因子在CIN中的aOR值大小对阴道H2O2、清洁度和pH值定义权重值,依次为3、2、1。然后计算3项指标总的综合得分(将每种指标的分类赋值乘以相应权重值,再求总和),进而得到阴道微环境的综合指标。进一步以NC组的P50点值4为界进行分类赋值,综合得分<4者判定为正常,赋值为0;≥4者判定为异常,赋值为1,进行阴道微环境因子与宫颈病变关系分析。结果显示,H2O2(χ2=26.60,P<0.001)、清洁度(χ2=21.02,P<0.001)和综合指标(χ2=30.91,P<0.001)的异常率在不同宫颈病变组间差异均有统计学意义,pH值(χ2=5.10,P=0.078)。随着宫颈病变的程度加重,pH值(趋势性χ2=5.06,P=0.024)、H2O2(趋势性χ2=26.19,P<0.001)、清洁度(趋势性χ2=19.55,P<0.001)和综合指标(趋势性χ2=30.50,P<0.001)的异常率均呈逐渐升高趋势。见表 2。在调整宫颈病变的相关因素后,H2O2与CIN Ⅰ和CIN Ⅱ/Ⅲ、清洁度与CIN Ⅱ/Ⅲ、综合指标与CIN Ⅰ和CIN Ⅱ/Ⅲ的OR值均有统计学意义,而pH值与CIN Ⅰ和CIN Ⅱ/Ⅲ的OR值未显示有统计学意义(图 1)。
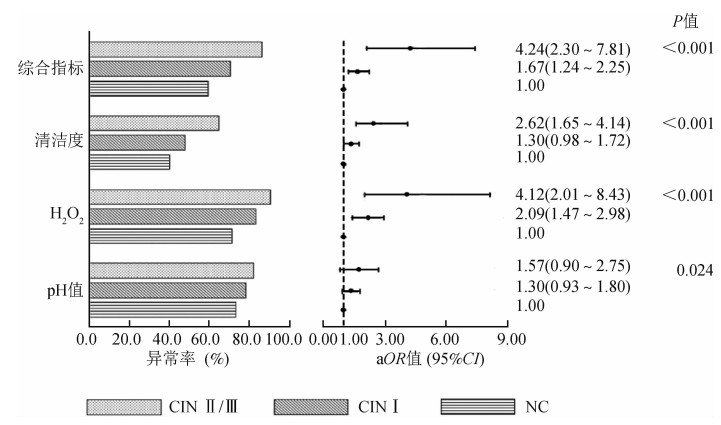
|
| 图 1 阴道微环境紊乱与宫颈病变的关系 |
4. HPV感染与阴道微环境紊乱的交互作用分析:以NC组为对照,应用相加交互作用模型对不同宫颈病变组进行HPV感染与阴道微环境紊乱的交互作用分析。结果显示,HPV感染与阴道微环境的综合指标在CIN Ⅱ/Ⅲ组中呈正相加交互作用,交互作用指标API和S显示正相加效应,而在CINⅠ组中未发现类似的交互效应。见表 3。
目前研究结果表明,HPV感染与宫颈病变的发生密切相关[13]。本研究结果显示,随着宫颈病变的进展,HPV的感染率有逐渐升高的趋势。关联强度分析发现,HPV感染可能会增加宫颈病变的发生风险,进一步证实了HPV感染是宫颈病变的主要病因,提示应该在育龄妇女中积极开展HPV筛查,尽早发现高危人群,这对于进一步采取预防措施并控制宫颈病变的发生发展具有重要意义。
阴道微环境是一个动态变化的微生态系统。正常情况下,阴道优势菌乳酸杆菌可分泌H2O2等物质,H2O2可以抵御生殖道致病菌,特别是性传播致病菌[15]。阴道pH值是阴道酸性环境的衡量指标。乳酸杆菌通过产生乳酸等酸性物质来降低阴道pH值,从而维持阴道的酸性环境[16]。乳酸可以阻断组蛋白去乙酰化酶,从而促进基因转录和DNA修复;还可诱导上皮细胞自噬,降解细胞内微生物,促进稳态[17]。阴道清洁度异常最重要的表现是细菌性阴道炎[18]。致癌性的亚硝胺从细菌性阴道炎相关的异常菌群中产生,并刺激一些细胞因子释放,然后单独或与病毒等其他介质共同作用于宫颈,进而发生恶变[19]。研究发现H2O2异常、清洁度异常以及pH值的升高均可能导致细菌性阴道炎[10]和需氧菌性阴道炎[11],而阴道细菌性阴道炎感染者比非感染者宫颈癌变/癌前病变的发病率明显增加,阴道菌群紊乱者比正常对照者在不同程度CIN组的患病率均高[20]。本研究发现,阴道H2O2、清洁度异常均可增加宫颈病变的患病风险。pH值异常与宫颈病变的关联强度虽没有意义,但非常接近有意义的范围,因此对于pH值异常与宫颈病变的关系可以有一定的提示作用。且随着宫颈病变的进展,pH值、H2O2和清洁度异常率均逐渐升高,提示阴道微环境因子可以作为宫颈病变的早期预警标志。阴道微环境因子中的pH值、H2O2和清洁度,可以从阴道酸碱度、乳酸杆菌功能、微生物代谢产物等方面较全面地反映阴道微生态状况。本研究采用综合权重评分法得到阴道pH值、H2O2和清洁度的综合指标,进一步较全面地评价阴道微环境与宫颈病变的关系发现,阴道微环境的综合指标可能会增加宫颈病变的患病风险,尤其对于CIN Ⅱ/Ⅲ,这为阴道微环境综合指标对宫颈病变的预警作用提供了重要的、较为全面的综合参考依据。因此,维持阴道微环境中酸碱度、产H2O2的乳酸杆菌比例及清洁度正常,从而保持阴道微环境稳定,这对于预防宫颈病变从而减缓甚至阻断宫颈癌的进程具有重要意义。
Brotman等[21]发现乳酸杆菌可能会减少女性感染HPV的概率。Korshunov等[22]研究表明,宫颈上皮内瘤变患者阴道内乳酸杆菌比例减少,各种条件致病菌比例增多。其中,加德纳菌属可通过激活炎症反应,释放细胞溶解素,降解阴道黏膜保护因子,增加HPV的感染风险[23-24]。Kyongo等[25]发现加德纳菌属可上调IL-1和IL-6等促炎细胞因子,IL-1可促进宫颈癌组织淋巴管的生成,与宫颈病变密切相关[26],IL-6水平升高可降低机体清除HPV病毒的能力,这有助于促进炎性和高度增殖的阴道微环境,长期保持可能会导致宫颈癌变的发生[27]。然而,HPV感染与阴道微环境紊乱在宫颈病变发生中的相互关系尚不清楚。本研究应用相加交互作用模型,进一步对不同宫颈病变组中阴道微环境综合指标与HPV感染的交互作用进行分析,结果显示,HPV感染与阴道微环境的综合指标在CIN Ⅱ/Ⅲ的发生中具有正相加交互作用,提示在HPV感染伴有阴道微环境紊乱的女性,发生CIN Ⅱ/Ⅲ的风险要高于单纯HPV感染或阴道微环境紊乱者。因此,在密切关注HPV感染女性的同时,同样应加强对这些女性的阴道微环境因子的检测力度,对于预防和控制宫颈病变的恶性转化具有重要意义。同时,本研究显示,在CINⅠ组妇女中,HPV感染与阴道微环境紊乱未显示交互效应的存在,特别值得注意的是,无论HPV感染与否,阴道微环境紊乱致CINⅠ的OR值差别不大,表明阴道微环境紊乱在CINⅠ组妇女中受HPV感染的影响不大,而无论HPV有无感染,阴道微环境紊乱致CINⅠ的OR值都具有统计学意义,提示,在宫颈病变发生的早期,阴道微环境紊乱对宫颈病变的发生起着不可忽视的作用,加强阴道微环境的检测对于宫颈病变的早期发现和预防具有潜在价值。
单个阴道微环境因子作为诊断阴道微生态的指标均有不同程度的局限性。阴道微环境综合指标的应用能提高阴道微环境与宫颈病变关系评估的准确性。本研究采用综合权重评分法,不仅兼顾了pH值、H2O2和清洁度3项指标的基本参数,而且根据研究目的对不同指标的参数加以权重,在统一标准下对3项指标的综合价值进行评价,具有较高的科学性和可靠性。尽管本研究在不同宫颈病变中对阴道微环境紊乱与宫颈病变的关系做了初步探讨,但不能明确阴道微环境紊乱与宫颈病变的因果关系,还需开展前瞻性队列研究。此外,鉴于阴道微环境的复杂性和宫颈病变影响因素的多样性,对于HPV感染与阴道微环境紊乱在宫颈病变中的关系及其交互效应的探讨尚需深入。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Turkistanli EC, Sogukpinar N, Saydam BK, et al. Cervical cancer prevention and early detection-the role of nurses and midwives[J]. Asian Pac J Cancer Prev, 2003, 4(1): 15-21. |
| [2] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [3] |
Chen WQ, Sun KX, Zheng RS, et al. Cancer incidence and mortality in China, 2014[J]. Chin J Cancer Res, 2018, 30(1): 1-12. DOI:10.21147/j.issn.1000-9604.2018.01.01 |
| [4] |
Chen WQ, Zheng RS, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [5] |
Corusić A, Skrgatić L, Mahovlić V, et al. Cervical cancer as a public health issue-what next?[J]. Coll Antropol, 2010, 34(1): 301-307. |
| [6] |
Wang ZL, Wang JT, Fan JR, et al. Risk factors for cervical intraepithelial neoplasia and cervical cancer in Chinese women:large study in Jiexiu, Shanxi Province, China[J]. J Cancer, 2017, 8(6): 924-932. DOI:10.7150/jca.17416 |
| [7] |
Scheurer ME, Danysh HE, Follen M, et al. Association of traffic-related hazardous air pollutants and cervical dysplasia in an urban multiethnic population:a cross-sectional study[J]. Environ Health, 2014, 13: 52. DOI:10.1186/1476-069x-13-52 |
| [8] |
Audirac-Chalifour A, Torres-Poveda K, Bahena-Román M, et al. Cervical microbiome and cytokine profile at various stages of cervical cancer:a pilot study[J]. PLoS One, 2016, 11(4): e0153274. DOI:10.1371/journal.pone.0153274 |
| [9] |
Clarke MA, Rodriguez AC, Gage JC, et al. A large, population-based study of age-related associations between vaginal pH and human papillomavirus infection[J]. BMC Infect Dis, 2012, 12: 33. DOI:10.1186/1471-2334-12-33 |
| [10] |
Ravel J, Gajer P, Abdo Z, et al. Vaginal microbiome of reproductive-age women[J]. Proc Natl Acad Sci USA, 2011, 108 Suppl 1: 4680-4687. DOI:10.1073/pnas.1002611107 |
| [11] |
Wang ZL, Fu LY, Xiong ZA, et al. Diagnosis and microecological characteristics of aerobic vaginitis in outpatients based on preformed enzymes[J]. Taiwanese J Obstetr Gynecol, 2016, 55(1): 40-44. DOI:10.1016/j.tjog.2015.06.012 |
| [12] |
Castelão C, da Silva AP, Matos A, et al. Association of myeloperoxidase polymorphism (G463A) with cervix cancer[J]. Mol Cell Biochem, 2015, 404(1/2): 1-4. DOI:10.1007/s11010-015-2359-5 |
| [13] |
Wang HL, Lu X, Yang XD, et al. Association of MBL2 exon1 polymorphisms with high-risk human papillomavirus infection and cervical cancers:a Meta-analysis[J]. Arch Gynecol Obstet, 2016, 294(6): 1109-1116. DOI:10.1007/s00404-016-4201-z |
| [14] |
Lu H, Jiang PC, Zhang XD, et al. Characteristics of bacterial vaginosis infection in cervical lesions with high risk human papillomavirus infection[J]. Int J Clin Exp Med, 2015, 8(11): 21080-21088. |
| [15] |
O'Hanlon DE, Lanier BR, Moench TR, et al. Cervicovaginal fluid and semen block the microbicidal activity of hydrogen peroxide produced by vaginal lactobacilli[J]. BMC Infect Dis, 2010, 10: 120. DOI:10.1186/1471-2334-10-120 |
| [16] |
Petrova MI, Lievens E, Malik S, et al. Lactobacillus species as biomarkers and agents that can promote various aspects of vaginal health[J]. Front Physiol, 2015, 6: 81. DOI:10.3389/fphys.2015.00081 |
| [17] |
Witkin SS, Linhares IM. Why do lactobacilli dominate the human vaginal microbiota?[J]. BJOG:An Int J Obstetr Gynaecol, 2017, 124(4): 606-611. DOI:10.1111/1471-0528.14390 |
| [18] |
Mitra A, MacIntyre DA, Marchesi JR, et al. The vaginal microbiota, human papillomavirus infection and cervical intraepithelial neoplasia:what do we know and where are we going next?[J]. Microbiome, 2016, 4: 58. DOI:10.1186/s40168-016-0203-0 |
| [19] |
Behbakht K, Friedman J, Heimler I, et al. Role of the vaginal microbiological ecosystem and cytokine profile in the promotion of cervical dysplasia:a case-control study[J]. Infect Dis Obstetr Gynecol, 2002, 10: 658314. DOI:10.1155/s1064744902000200 |
| [20] |
Klomp JM, Boon ME, van Haaften M, et al. Cytologically diagnosed Gardnerella vaginalis infection and cervical (pre)neoplasia as established in population-based cervical screening[J]. Am J Obstetr Gynecol, 2008, 199(5): 480. DOI:10.1016/j.ajog.2008.04.036 |
| [21] |
Brotman RM, Shardell MD, Gajer P, et al. Interplay between the temporal dynamics of the vaginal microbiota and human papillomavirus detection[J]. J Infect Dis, 2014, 210(11): 1723-1733. DOI:10.1093/infdis/jiu330 |
| [22] |
Korshunov VM, Kafarskaia LI, Bagirova MS, et al. The effect of Solco Trichovac on the vaginal microflora of patients with a papillomavirus infection associated with a cervical intraepithelial neoplasm[J]. Zh Mikrobiol Epidemiol Immunobiol, 1994(5): 13-17. |
| [23] |
Patterson JL, Stull-Lane A, Girerd PH, et al. Analysis of adherence, biofilm formation and cytotoxicity suggests a greater virulence potential of Gardnerella vaginalis relative to other bacterial-vaginosis-associated anaerobes[J]. Microbiology, 2010, 156(2): 392-399. DOI:10.1099/mic.0.034280-0 |
| [24] |
潘颖.高危型HPV感染及不同级别宫颈病变女性阴道菌群多样性分析[D].衡阳: 南方医科大学, 2016. Pan Y. Diversity analysis of vaginal microbiota on women with high-risk human papillomavirus infection and different levels of cervical lesions[D]. Hengyang: Southern Medical University, 2016. |
| [25] |
Kyongo JK, Crucitti T, Menten J, et al. Cross-sectional analysis of selected genital tract immunological markers and molecular vaginal microbiota in sub-saharan african women, with relevance to HIV risk and prevention[J]. Clin Vaccine Immunol, 2015, 22(5): 526-538. DOI:10.1128/CVI.00762-14 |
| [26] |
Ding H, Cai J, Mao M, et al. Tumor-associated macrophages induce lymphangiogenesis in cervical cancer via interaction with tumor cells[J]. APMIS, 2014, 122(11): 1059-1069. DOI:10.1111/apm.12257 |
| [27] |
Artaza-Irigaray C, Molina-Pineda A, Aguilar-Lemarroy A, et al. E6/E7 and E6* From HPV16 and HPV18 Upregulate IL-6 Expression Independently of p53 in Keratinocytes[J]. Front Immunol, 2019, 10: 1676. DOI:10.3389/fimmu.2019.01676 |
 2020, Vol. 41
2020, Vol. 41