文章信息
- 卢明, 陈宏达, 刘成成, 张愉涵, 魏锣沛, 吕章艳, 任建松, 石菊芳, 邹霜梅, 李霓, 代敏.
- Lu Ming, Chen Hongda, Liu Chengcheng, Zhang Yuhan, Wei Luopei, Lyu Zhangyan, Ren Jiansong, Shi Jufang, Zou Shuangmei, Li Ni, Dai Min
- 定量免疫粪便隐血试验对进展期结直肠肿瘤筛检效能的评价
- Diagnostic performance of quantitative fecal immunochemical test in detection of advanced colorectal neoplasia
- 中华流行病学杂志, 2020, 41(12): 2104-2111
- Chinese Journal of Epidemiology, 2020, 41(12): 2104-2111
- http://dx.doi.org/10.3760/cma.j.cn112338-20191216-00888
-
文章历史
收稿日期: 2019-12-16
2. 浙江大学医学院附属第二医院科研部, 杭州 310009;
3. 天津医科大学肿瘤医院流行病与卫生统计室, 国家肿瘤临床医学研究中心, 天津市肿瘤防治重点实验室 300060;
4. 国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院病理科, 北京 100021
2. Department of Science and Development, The Second Affiliated Hospital of Zhejiang University School of Medicine, Hangzhou 310009, China;
3. Department of Epidemiology and Biostatistics, National Clinical Research Center for Cancer, Key Laboratory of Cancer Prevention and Therapy, Tianjin Medical University Cancer Hospital, Tianjin 300060, China;
4. Department of Pathology, National Cancer Center/National Clinical Research Center for Cancer/Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021, China
结直肠癌是影响我国居民健康的主要癌种之一。2015年,结直肠癌世标发病率和世标死亡率分别为17.81/10万和8.12/10万,位列我国癌症谱的第三和第五位[1]。既往研究已证实筛查可以有效降低结直肠癌的发病率和死亡率[2-3]。目前指南推荐的结直肠癌筛查手段包括结肠镜、乙状结肠镜、粪便隐血试验(fecal occult blood test,FOBT)等,其中FOBT是目前应用最为广泛的无创结直肠癌筛查技术[4-5]。近10年来,免疫粪便隐血试验(fecal immunochemical testing,FIT)由于较高的灵敏度和特异度,且不受饮食和药物限制,已经逐步取代传统的愈创木脂粪便隐血试验(guaiac-based fecal occult blood testing)[6]。根据检测技术原理的不同,FIT可分为定性和定量FIT两类[7]。定性FIT采用免疫层析法,基于厂家预先设定的阳性截断值给出定性结果(阳性、阴性);定量FIT则通常采用免疫比浊法定量检测粪血红蛋白(hemoglobin,Hb)浓度,可根据筛查目标人群特征,选择适宜的阳性截断值判定检测结果。相比定性FIT,定量FIT具有结果判读不易受主观因素影响、不同产品检查结果符合率高、产品质量控制佳等优点[8-10]。目前,定量FIT在国外人群筛查项目的应用研究较多[11-13],但定量FIT在我国人群中的应用效果评价研究较为缺乏。因此,本研究基于1项正在开展的大样本多中心人群结直肠癌筛查随机对照试验,对定量FIT的进展期结直肠肿瘤筛检效能进行评价,为进一步优化中国人群结直肠癌筛查策略提供理论参考。
对象与方法1.研究对象:本研究基于1项正在开展的多中心人群结直肠癌筛查随机对照试验(Target-C研究,中国临床试验平台注册号:ChiCTR1800015506)。研究方案见文献[14]。此研究于2018年5月启动,共在6个现场(浙江省温岭市和兰溪市、安徽省合肥市、江苏省徐州市、湖南省长沙市、云南省昆明市)实施。所有研究中心按照统一的纳入、排除标准招募50~74岁符合研究要求的受试者接受结直肠癌筛查。排除标准:①结直肠癌病史;②既往接受结肠切除手术;③近5年内接受过结肠镜检查、纤维乙状结肠镜、CT仿真结肠镜等检查;④近1年内接受粪便隐血检测;⑤有出血、腹痛等下消化道疾病症状或缺铁性贫血等;⑥患有其他严重共患疾病。满足研究条件的研究对象按照1:2:2随机分组:①单次结肠镜组;②连年FIT组;③连年风险评估组。风险评估组采用亚太结直肠筛查评分[15]作为初筛手段对受试者进行风险度分层,推荐评估结果为结直肠癌高风险的人群接受结肠镜检查;评估结果为低风险的人群接受FIT检查。如FIT检测阳性者则接受进一步诊断性结肠镜检查。本研究对所有受试者在入组时进行统一的流行病学问卷调查,收集受试者的基本信息、生活习惯、家族史和既往疾病史等信息。此外,本研究要求所有接受结肠镜检查的受试者在检查前提供粪便样本。收集到的粪便样本将按照严格的程序进行统一处理和保存,用于后续科研分析。所有收集到的信息都经过专人核查并录入统一的数据管理平台。本研究已通过国家癌症中心/中国医学科学院北京协和医学院肿瘤医院伦理委员会审查(批准文号:18-013/1615)。所有受试者均已经签署知情同意书。
本研究纳入了Target-C研究在基线筛查阶段(2018年5月至2019年5月)中所有完成结肠镜检查且提供粪便样本的受试者,共计3 407例。由于受试者来源于不同筛查干预组,本研究根据受试者的结肠镜检查指征分为筛查目的和诊断目的两类。筛查目的定义为受试者未经过初筛直接接受结肠镜检查(单次结肠镜组);诊断目的指受试者经初筛为阳性(FIT阳性或风险评估高风险)而接受诊断性结肠镜检查。
2.结肠镜检查及诊断结果分类:
(1)结肠镜检查:所有结肠镜检查均在项目指定的医院由高年资内镜医师开展。受试者在接受结肠镜检查前均被要求做好充分肠道准备工作。在检查时,结肠镜进镜深度需到达回盲部。若镜下发现息肉样病变和溃疡,均需取组织活检以明确病理诊断,并记录息肉的大小、形态、蒂部情况及数目。首次肠镜检查不充分者,要求1个月内经充分准备后再行检查。
(2)诊断结果分类:受试者的诊断结果分为5类:结直肠癌、进展期腺瘤、非进展期腺瘤、良性病变、正常。其中良性病变包括增生性息肉、结肠炎、憩室等非腺瘤性病变;进展期腺瘤定义为直径≥1 cm、或绒毛状结构、或伴高级别上皮内瘤变的腺瘤。结直肠癌临床分期采用国际抗癌联盟TNM分期(第八版)[16]。进展期结直肠肿瘤包括结直肠癌及进展期腺瘤。本研究结直肠以脾曲为界,分为近端结肠和远端结/直肠,近端结肠包括回盲部、盲肠、升结肠、肝曲、横结肠和脾曲,远端结/直肠包括降结肠、乙状结肠和直肠。为了保证多中心研究病理诊断标准的一致性和准确性,所有结直肠癌、进展期腺瘤及随机选取的部分非进展期腺瘤(10%)的病理切片均由中国医学科学院肿瘤医院病理专家进行中心复阅,诊断不一致者经过会诊讨论决定。
3.粪便样本采集与保存:根据研究设计,受试者需在结肠镜检查前24 h内留取粪便。粪便标本需保存于统一发放的无菌粪便采集管(德国SARSTEDT公司)中,并使用装有冰袋的保温袋将粪便采集管包裹好后,置于家用4 ℃冰箱中保存。待结肠镜检查当天,将采集的粪便标本交至研究中心医院,由工作人员暂存于当地的-80 ℃冰箱内,后期集中经干冰冷链运输至中国医学科学院肿瘤医院生物样本库储存,以用于后续研究。
4. FIT:本研究采用的定量FIT产品为OC-Sensor(日本Eiken Chemical公司),该产品使用的粪便采集管为OC自动粪便采集管-3(OC auto-sampling bottle 3),检测仪器为OC Sensor io自动粪便隐血检测仪。实验室检测由经过培训的工作人员开展,操作步骤严格按照预先制定的《粪便标本预处理标准化操作流程(SOP)》执行:①分装:将粪便从-80 ℃冰箱取出,用一次性灭菌刀于粪便不同部位切取3小块粪便(约1 g),装入新的灭菌粪便采集管内;②解冻:将新分装的粪便标本转移至4 ℃冰箱,解冻5 min;③采集:从4 ℃冰箱中将解冻后的粪便取出,用OC自动粪便采集管-3附带的采集棒混匀粪便标本,保证最终采集棒的凹槽充盈粪便;④溶解:将采集管手动摇晃10次后,置于4 ℃冰箱中,第二天集中检测;⑤检测:按照标准化检测操作流程,将隔夜放置的OC自动粪便采集管-3放入检测仪器中检测,记录检测结果。FIT检测试剂操作者不知晓所有待检测样本的疾病分组。
5.统计学分析:采用R 3.5.2软件对数据进行统计学分析[17]。采用不同检测阳性截断值,计算灵敏度、特异度、阳性预测值、阴性预测值作为指标评价FIT对结直肠癌肿瘤的筛检效能。基于定量粪便隐血检测数值,采用logistic回归分析绘制受试者工作特征曲线(receiver operating characteristic curve,ROC),并计算曲线下面积(areas under the curve,AUC)以及95%CI。此外,采用单因素和多因素logistic回归评价年龄、性别、结肠镜检查指征等因素对FIT诊断结直肠癌和进展期腺瘤灵敏度的影响,计算OR值及其95%CI。本研究将所有未患进展期结直肠肿瘤受试者(包括非进展期腺瘤、良性病变、正常)作为阴性人群以计算特异度。率的比较采用χ2检验或Fisher检验,中位数比较Wilcoxon秩和检验,ROC曲线下面积比较采用z检验,以P<0.05为差异有统计学意义。
结果1.基本信息:共纳入3 407名研究对象,其中男性占51.5%(1 753例),年龄为(60.5±6.3)岁,以50~64岁年龄段居多(2 331例,68.4%)。结合结肠镜和病理诊断,3 407例受试者共包括结直肠癌28例(0.8%)、进展期腺瘤255例(7.5%)、非进展期腺瘤677例(19.9%)以及良性病变和正常2 447例(71.8%)。对于结肠镜检查指征,以筛查或诊断为目的接受结肠镜检查的受试者分别为1 476例(43.3%)和1 931例(56.7%)。见表 1。
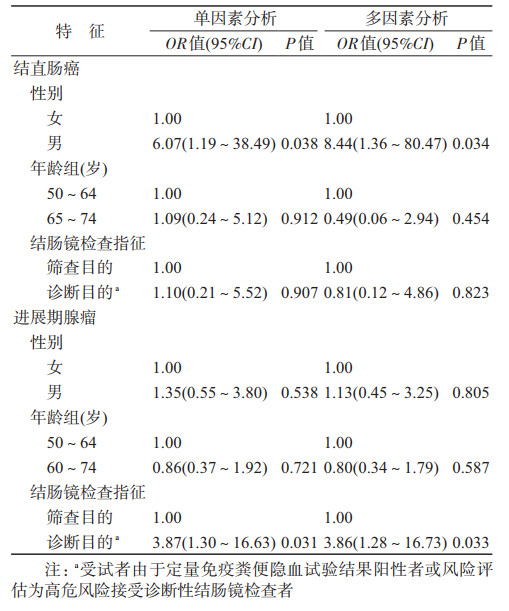
2. FIT对不同结直肠病变的筛检效能:当采用厂家推荐的阳性截断值(20 μg Hb/g)时,定量FIT对结直肠癌和进展期腺瘤的灵敏度分别为57.1%(95%CI:37.2%~75.5%)和11.0%(95%CI:7.4%~15.5%),特异度为98.4%(95%CI:97.8%~98.8%)。分病变部位来看,定量FIT对身体近端和远端部位结直肠癌的诊断灵敏度差异无统计学意义(60.0% vs. 55.6%,P=0.717),此外,与早期结直肠癌(TNM Ⅰ/Ⅱ期)患者相比,定量FIT对晚期癌患者(TNM Ⅲ/Ⅳ期)的灵敏度更高,差异无统计学意义(100.0% vs. 50.0%,P=0.119)。定量FIT对进展期腺瘤的灵敏度为11.0%(95%CI:7.4%~15.5%),且对远端和近端差异无统计学意义(2.0% vs. 1.6%,P=0.121),对伴高级别腺上皮内瘤变的腺瘤和具有绒毛状结构的腺瘤差异无统计学意义(2.8% vs. 2.2%,P=0.117)。见表 2。利用定量FIT检测数值,采用logistic回归进行ROC分析,FIT对结直肠癌和进展期腺瘤的AUC分别为0.908(95%CI:0.842~0.973)和0.657(95%CI:0.621~0.692)。见图 1。
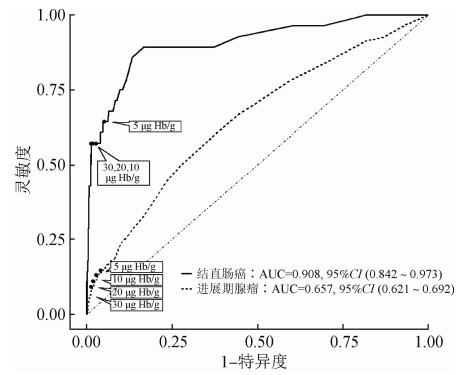
|
| 图 1 定量免疫粪便隐血试验对诊断结直肠癌和进展期腺瘤的受试者工作曲线分析 |
3. FIT对不同特征人群的筛检效能:当阳性截断值为20 μg Hb/g时,FIT对男性结直肠癌的灵敏度高于女性(72.2% vs. 30.0%,P=0.049)。见表 3。单因素分析结果显示在男性人群中,FIT对于结直肠癌的灵敏度更高(OR=6.07,P=0.038),在调整年龄、结肠镜检查指征后,FIT对于男性结直肠癌的灵敏度依然高于女性(OR=8.44,P=0.034)(表 4)。但是FIT对于不同性别人群的特异度差异无统计学意义(男vs.女,99.7% vs. 99.6%,P=1.000),ROC同样显示FIT对不同性别人群结直肠癌AUC差异无统计学意义(男vs.女,0.927 vs. 0.875,P=0.469)。另外,FIT对于不同性别人群的结直肠癌阳性预测值(33.3% vs.10.3%,P=0.055)和阴性预测值(99.7% vs. 99.6%,P=0.774)差异无统计学意义。另外,FIT对于结直肠癌的筛检效能在不同年龄或结肠镜指征人群中差异无统计学意义(表 3,4,图 2)。对于进展期腺瘤来说,FIT对于进展期腺瘤在不同人群中的筛检效能的趋势基本与结直肠癌一致。但也有例外,与接受筛查性结肠镜检查的人群相比,定量FIT在接受诊断性结肠镜人群中对进展期腺瘤的诊断灵敏度更高(诊断目的vs.筛查目的,13.9% vs. 4.0%,P=0.037)。单因素分析结果显示在接受筛查性结肠镜检查的人群中,FIT对于进展期腺瘤的灵敏度高于接受诊断性结肠镜检查的人群(OR=3.87,P=0.031),在调整年龄、结肠镜检查指征后,结果依然稳定(OR=3.86,P=0.033)。
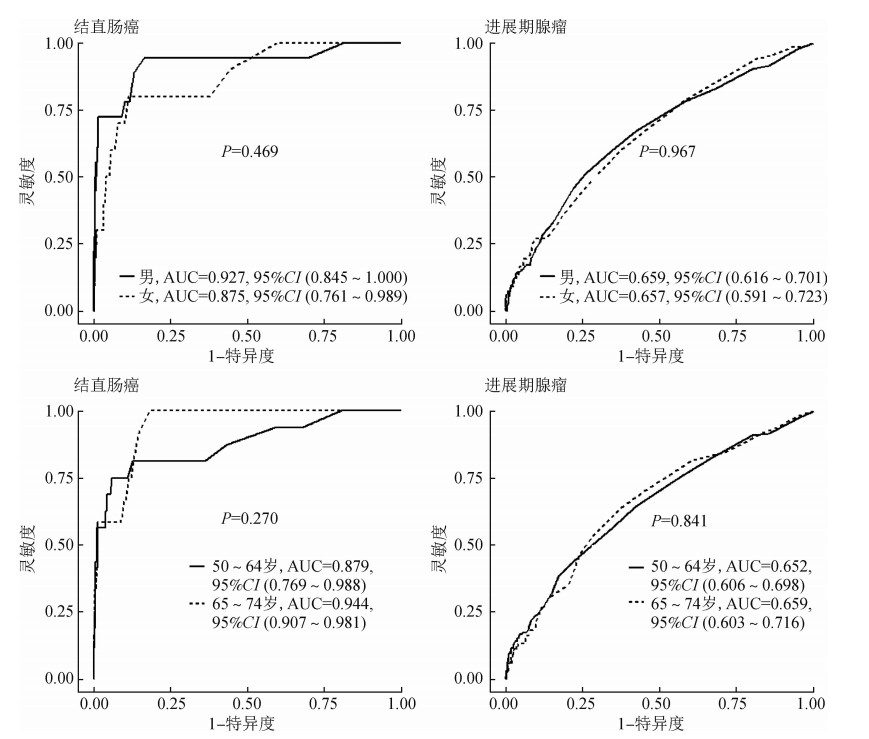
|
| 图 2 不同性别和年龄组人群中定量免疫粪便隐血试验对诊断结直肠癌和进展期腺瘤的受试者工作曲线分析 |
4.不同阳性截断值对FIT筛检效能的影响:当阳性截断值从20 μg Hb/g降低至5 μg Hb/g粪便时,FIT特异度从98.8%降至95.2%;就灵敏度而言,FIT对于结直肠癌的灵敏度从57.1%(95%CI:37.2%~75.5%)增加至64.3%(95%CI:44.1%~81.4%),对进展期腺瘤的灵敏度从11.0%(95%CI:7.4%~15.5%)增加至16.5%(95%CI:12.1%~21.6%);就阳性预测值而言,FIT对结直肠癌和进展期腺瘤的阳性预测值分别从23.5%(95%CI:13.4%~33.6%)降至10.7%(95%CI:6.0%~15.4%),35.0%(95%CI:24.5%~45.5%)降至21.9%(95%CI:16.0%~27.7%),而阴性预测值变化幅度不大。当阳性截断值从20 μg Hb/g增加到30 μg Hb/g时,FIT对结直肠癌灵敏度不变,阳性预测值从23.5%(95%CI:13.4%~33.6%)增加至30.2%(95%CI:17.8%~42.5%),而特异度和阴性预测值保持稳定;同样的,FIT对于进展期腺瘤的灵敏度和阳性预测值均有不同程度的降低或增加,但特异度和阴性预测值保持稳定。见表 5。
粪便隐血试验是目前应用最为广泛且较为有效的结直肠癌筛查手段。本项研究结果提示定量FIT对结直肠癌具有良好的诊断效果。此外,通过调整阳性截断值,定量FIT可以实现整体筛检阳性率以及筛检效能相关指标的改变,从而满足实际人群筛查的需求。亚组分析也提示其对不同性别或年龄段的人群筛检效能并无差异。
阳性截断值是影响FIT筛检效能最重要的指标之一。定性FIT产品在出厂时已被预设阳性截断值。李佩等[18]对17种国产定性FIT产品进行筛检效能的评价,结果显示这些定性FIT假阳性率偏高,其中最高可达82.5%。目前我国结直肠癌筛查以定性FIT为主,较高的假阳性率会降低阳性预测值并增大筛查项目的结肠镜检查负荷,从而可能限制结直肠癌筛查产生的潜在效果和效益。国外研究团队Gies等[19]对9种定量FIT进行效果评价,结果显示当阳性截断值统一设定为15 μg Hb/g时,FIT对结直肠癌和进展期腺瘤的特异度均>94.0%,而对两者的灵敏度分别为56.3%~81.3%和13.0%~30.5%不等。因此,既往研究提示定量FIT对进展期结直肠肿瘤的筛检效能可能高于定性FIT。此外,在人群组织性结直肠癌筛查项目中,不同组织方对预期的筛查目标及拥有的卫生资源有所差异,因此,合理选择FIT阳性截断值是非常有必要的。在这种情况下,相比于定性FIT,定量FIT有着一定的优势。
本研究发现基于厂家推荐的阳性截断值(20 μg Hb/g),定量FIT对于结直肠癌和进展期腺瘤的灵敏度欠佳,但特异度良好。相关结果与国外研究结果较为一致[20-24]。例如多项队列研究结果显示当阳性截断值为20 μg Hb/g时,单次定量FIT对于结直肠癌的灵敏度为56%~77%,对进展期腺瘤的灵敏度较低,为6%~29%[20-24];Imperiale等[23]的研究结果显示FIT对于结直肠癌的ROC曲线下面积为0.89,而对进展期腺瘤为0.67。
本研究发现通过降低阳性截断值或可提高结直肠癌和进展期腺瘤的灵敏度,同时获得理想的特异度。尽管如此,国外1项研究发现在人群筛查中,当FIT的阳性截断值从20 μg Hb/g降低至10 μg Hb/g时,虽然每万人检出进展期结直肠肿瘤例数增加41例,但是相应的结肠镜负荷增加184例[25]。因此,当低阳性截断值定量FIT应用于大规模人群结直肠癌筛查项目时,应综合考虑筛查效果及当地结肠镜负荷。
本研究还发现FIT对男性结直肠癌的灵敏度较高,且在调整年龄、结肠镜指征因素后,结果依然稳定。这与近期发表的1项荟萃分析结论不一致[26]。这篇汇总了3篇前瞻性队列研究、纳入了3 275例结直肠癌病例的荟萃分析结果提示FIT对于不同性别人群结直肠癌的灵敏度无差异(男vs.女,77% vs. 81%,P=0.68)[26]。由于本研究中纳入的结直肠癌例数较少,因此FIT在中国人群中对结直肠癌的灵敏度是否存在性别差异还有待进一步研究。另外,本研究发现FIT对进展期腺瘤的灵敏度性别差异无统计学意义。这一结果与既往德国Brenner[27]团队研究一致。
本研究有以下优势:第一,本研究的粪便样本选自1项大样本多中心结直肠癌筛查队列人群,且粪便样本采集、保存、检测过程严格按照既定规范化的流程执行,保证结果的稳定性、真实性和可靠性,从而能够最大程度地反映FIT在实际筛查人群中的真实筛检效能;第二,所有受试者的病理诊断结果经由病理专家中心复阅,保证诊断结果的准确性。同时本研究也存在一定的局限性:第一,研究对象包括部分接受诊断性结肠镜检查的受试者。因此,FIT阳性率以及预测值等指标可能不能够代表真实筛查人群中的实际情况。第二,本研究FIT检测结果基于冷冻的粪便样本(保存于-80 ℃环境),而非新鲜粪便样本,与实际筛查有所不同。但本研究的主要目的为评价FIT对进展期结直肠肿瘤的筛检效能,且有既往研究提示冷冻粪便样本与新鲜粪便样本对FIT检测的结果影响较小[28]。第三,由于本研究中纳入的结直肠癌样本数量较为有限,因而对于筛检灵敏度的点估计可能存在一定的偏差,定量FIT对结直肠癌的诊断灵敏度有待在人群扩大样本中进行进一步评价和验证。
综上所述,在本研究人群中,定量FIT对结直肠癌诊断灵敏度尚可,但对进展期腺瘤的诊断灵敏度较低。在人群结直肠癌筛查中,定量FIT的阳性截断值可以根据预设检出率及结肠镜检查负荷灵活调整,具有一定优势。本研究结果将为优化中国人群结直肠癌筛查技术和方案提供基础数据和理论参考。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
孙可欣, 郑荣寿, 张思维, 等. 2015年中国分地区恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2019, 28(1): 1-11. Sun KX, Zheng RS, Zhang SW, et al. Report of cancer incidence and mortality in different areas of China, 2015[J]. China Cancer, 2019, 28(1): 1-11. DOI:10.11735/j.issn.1004-0242.2019.01.A001 |
| [2] |
Elmunzer BJ, Hayward RA, Schoenfeld PS, et al. Effect of flexible sigmoidoscopy-based screening on incidence and mortality of colorectal cancer:A systematic review and Meta-analysis of randomized controlled trials[J]. PLoS Med, 2012, 9(12): e1001352. DOI:10.1371/journal.pmed.1001352 |
| [3] |
Shaukat A, Mongin SJ, Geisser MS, et al. Long-term mortality after screening for colorectal cancer[J]. N Engl J Med, 2013, 369(12): 1106-1114. DOI:10.1056/NEJMoa1300720 |
| [4] |
Wolf AMD, Fontham ETH, Church TR, et al. Colorectal cancer screening for average-risk adults:2018 guideline update from the American Cancer Society[J]. CA:A Cancer J Clin, 2018, 68(4): 250-281. DOI:10.3322/caac.21457 |
| [5] |
Schreuders EH, Ruco A, Rabeneck L, et al. Colorectal cancer screening:A global overview of existing programmes[J]. Gut, 2015, 64(10): 1637-1649. DOI:10.1136/gutjnl-2014-309086 |
| [6] |
Tinmouth J, Lansdorp-Vogelaar I, Allison JE. Faecal immunochemical tests versus guaiac faecal occult blood tests:What clinicians and colorectal cancer screening programme organisers need to know[J]. Gut, 2015, 64(8): 1327-1337. DOI:10.1136/gutjnl-2014-308074 |
| [7] |
Day LW, Bhuket T, Allison J. Fit testing:An overview[J]. Curr Gastroenterol Rep, 2013, 15(11): 357. DOI:10.1007/s11894-013-0357-x |
| [8] |
Hundt S, Haug U, Brenner H. Comparative evaluation of immunochemical fecal occult blood tests for colorectal adenoma detection[J]. Ann Intern Med, 2009, 150(3): 162-169. DOI:10.7326/0003-4819-150-3-200902030-00005 |
| [9] |
Tannous B, Lee-Lewandrowski E, Sharples C, et al. Comparison of conventional guaiac to four immunochemical methods for fecal occult blood testing:Implications for clinical practice in hospital and outpatient settings[J]. Clin Chim Acta, 2009, 400(1/2): 120-122. DOI:10.1016/j.cca.2008.10.023 |
| [10] |
Levy BT, Bay C, Xu YH, et al. Test characteristics of faecal immunochemical tests (FIT) compared with optical colonoscopy[J]. J Med Screen, 2014, 21(3): 133-143. DOI:10.1177/0969141314541109 |
| [11] |
Nakama H, Zhang B, Zhang X. Evaluation of the optimum cut-off point in immunochemical occult blood testing in screening for colorectal cancer[J]. Eur J Cancer, 2001, 37(3): 398-401. DOI:10.1016/s0959-8049(00)00387-7 |
| [12] |
Moss S, Mathews C, Day TJ, et al. Increased uptake and improved outcomes of bowel cancer screening with a faecal immunochemical test:Results from a pilot study within the national screening programme in England[J]. Gut, 2017, 66(9): 1631-1644. DOI:10.1136/gutjnl-2015-310691 |
| [13] |
Jensen CD, Corley DA, Quinn VP, et al. Fecal immunochemical test program performance over 4 rounds of annual screening:A retrospective cohort study[J]. Ann Intern Med, 2016, 164(7): 456-463. DOI:10.7326/M15-0983 |
| [14] |
Chen HD, Li N, Shi JF, et al. Comparative evaluation of novel screening strategies for colorectal cancer screening in China (Target-C):A study protocol for a multicentre randomised controlled trial[J]. BMJ Open, 2019, 9(4): e025935. DOI:10.1136/bmjopen-2018-025935 |
| [15] |
Chiu HM, Ching JY, Wu KC, et al. A risk-scoring system combined with a fecal immunochemical test is effective in screening high-risk subjects for early colonoscopy to detect advanced colorectal neoplasms[J]. Gastroenterology, 2016, 150(3): 617-625. DOI:10.1053/j.gastro.2015.11.042 |
| [16] |
Brierley JD, Gospodarowicz MK, Wittekind C. TNM classification of malignant tumours[M]. 8th ed. Oxford: New York John Wiley & Sons, Ltd, 2017.
|
| [17] |
Albert J. An introduction to R[M]//Bayesian Computation with R. New York: Springer, 2009.
|
| [18] |
李佩, 诸佩超, 宋荣维, 等. 17种免疫法粪便潜血试验检测性能评估[J]. 检验医学, 2019, 34(2): 152-158. Li P, Zhu PC, Song RW, et al. Performance evaluation of 17 fecal immunochemical tests[J]. Lab Med, 2019, 34(2): 152-158. DOI:10.3969/j.issn.1673-8640.2019.02.013 |
| [19] |
Gies A, Cuk K, Schrotz-King P, et al. Direct comparison of diagnostic performance of 9 quantitative fecal immunochemical tests for colorectal cancer screening[J]. Gastroenterology, 2018, 154(1): 93-104. DOI:10.1053/j.gastro.2017.09.018 |
| [20] |
Park DI, Ryu S, Kim YH, et al. Comparison of guaiac-based and quantitative immunochemical fecal occult blood testing in a population at average risk undergoing colorectal cancer screening[J]. Am J Gastroenterol, 2010, 105(9): 2017-2025. DOI:10.1038/ajg.2010.179 |
| [21] |
de Wijkerslooth TR, Stoop EM, Bossuyt PM, et al. Immunochemical fecal occult blood testing is equally sensitive for proximal and distal advanced neoplasia[J]. Am J Gastroenterol, 2012, 107(10): 1570-1578. DOI:10.1038/ajg.2012.249 |
| [22] |
Sohn DK, Jeong SY, Choi HS, et al. Single immunochemical fecal occult blood test for detection of colorectal neoplasia[J]. Cancer Res Treat, 2005, 37(1): 20-23. DOI:10.4143/crt.2005.37.1.20 |
| [23] |
Imperiale TF, Ransohoff DF, Itzkowitz SH, et al. Multitarget stool DNA testing for colorectal-cancer screening[J]. N Engl J Med, 2014, 370(14): 1287-1297. DOI:10.1056/NEJMoa1311194 |
| [24] |
Nakama H, Yamamoto M, Kamijo N, et al. Colonoscopic evaluation of immunochemical fecal occult blood test for detection of colorectal neoplasia[J]. Hepatogastroenterology, 1999, 46(25): 228-231. |
| [25] |
Wieten E, Schreuders EH, Nieuwenburg SAV, et al. Effects of increasing screening age and fecal hemoglobin cutoff concentrations in a colorectal cancer screening program[J]. Clin Gastroenterol Hepatol, 2016, 14(12): 1771-1777. DOI:10.1016/j.cgh.2016.08.016 |
| [26] |
Selby K, Levine EH, Doan C, et al. Effect of sex, age, and positivity threshold on fecal immunochemical test accuracy:A systematic review and Meta-analysis[J]. Gastroenterology, 2019, 157(6): 1494-1505. DOI:10.1053/j.gastro.2019.08.023 |
| [27] |
Brenner H, Qian J, Werner S. Variation of diagnostic performance of fecal immunochemical testing for hemoglobin by sex and age:Results from a large screening cohort[J]. Clin Epidemiol, 2018, 10: 381-389. DOI:10.2147/CLEP.S155548 |
| [28] |
Chen HD, Werner S, Brenner H. Fresh vs frozen samples and ambient temperature have little effect on detection of colorectal cancer or adenomas by a fecal immunochemical test in a colorectal cancer screening cohort in Germany[J]. Clin Gastroenterol Hepatol, 2017, 15(10): 1547-1556. DOI:10.1016/j.cgh.2016.10.018 |
 2020, Vol. 41
2020, Vol. 41