文章信息
- 肖培, 程红, 郁兆仓, 王莲革, 王宏健, 高爱钰, 赵小元, 洪伟, 侯冬青, 王文鹏, 米杰.
- Xiao Pei, Cheng Hong, Yu Zhaocang, Wang Liange, Wang Hongjian, Gao Aiyu, Zhao Xiaoyuan, Hong Wei, Hou Dongqing, Wang Wenpeng, Mi Jie
- 基于体脂肪的肥胖评估指标在学龄儿童持续性血脂异常筛查中的应用
- Application of obesity indicators based on body fat in the screening of persistent dyslipidemia among school-aged children
- 中华流行病学杂志, 2020, 41(12): 2066-2071
- Chinese Journal of Epidemiology, 2020, 41(12): 2066-2071
- http://dx.doi.org/10.3760/cma.j.cn112338-20200805-01024
-
文章历史
收稿日期: 2020-08-05
2. 首都儿科研究所流行病学研究室, 北京 100020;
3. 北京市通州区中小学卫生保健所 101100;
4. 北京市密云区中小学卫生保健所 101500;
5. 北京市房山区中小学卫生保健所 102400;
6. 北京市东城区中小学卫生保健所 100009;
7. 北京中同蓝博医学检验实验室 100070
2. Department of Epidemiology, Capital Institute of Pediatrics, Beijing 100020, China;
3. Beijing Tongzhou Primary and Secondary School Health Center, Beijing 101100, China;
4. Beijing Miyun Primary and Secondary School Health Center, Beijing 101500, China;
5. Beijing Fangshan Primary and Secondary School Health Center, Beijing 102400, China;
6. Beijing Dongcheng Primary and Secondary School Health Center, Beijing 100009, China;
7. Beijing Zhongtong Lambo Medical Laboratory, Beijing 100070, China
血脂异常是动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)的重要危险因素,2016年造成了全球约9 000多万人年的健康寿命损失[1]。由于血脂具有轨迹效应,持续性血脂异常的儿童在其成年后更易发生大中动脉壁的粥样硬化性病理改变,成为ASCVD病患的后备军[2-3]。近年来,我国儿童血脂异常患病率明显升高,2013年的7城市调查结果显示,我国6~17岁儿童血脂异常患病率达15.8%[4],预示未来成年人ASCVD及相关疾病负担可能进一步加重[5]。因此,如何尽早识别持续性血脂异常的高危儿童是将ASCVD防治窗口前移至儿童期的关键问题之一。美国儿科学会(American Academy of Pediatrics,AAP)推荐对BMI诊断的肥胖儿童进行血脂异常筛查[6],但美国内分泌协会(American College of Endocrinology,ACE)指出肥胖是以“体脂肪增多为基础的慢性疾病”[7],而BMI不能真实反映发育中的儿童身体脂肪水平及其蓄积的状态,因此,研究不同肥胖评估指标对儿童持续性血脂异常的筛查效果,有助于识别未来更易发生ASCVD的高危儿童。本研究利用儿童青少年心血管与骨健康促进项目(School-based Cardiovascular and Bone Health Promotion Program,SCVBH)队列数据,比较BMI、体脂率(fat mass percentage,FMP)和脂肪质量指数(fat mass index,FMI)3项指标对儿童持续性血脂异常的筛查效果,为ASCVD疾病的儿童期预防提供科学依据。
对象与方法1.研究对象:SCVBH项目采用分层整群抽样的方法于2017年11月至2018年1月在北京市开展了基线调查,排除因外伤和疾病等不能参加体检者,共对30所学校的15 391名6~16岁儿童进行了调查,研究方案及基线调查结果见已发表文献[8]。2年后于2019年11月至2020年1月对该人群进行了随访调查,调查内容同基线,共随访到12 984人(随访率84.4%)。排除2次调查中血脂检测结果(n=2 168人)和相关分析指标缺失者(n=33人),共纳入10 783人进行本次分析。排除人群平均年龄(10.7 vs. 10.9,P=0.004)和女性占比(46.6% vs. 50.4%,P=0.001)略低于纳入分析人群,而吸烟、饮酒、运动和膳食在2组人群间差异无统计学意义(P>0.05)。研究方案通过首都儿科研究所伦理委员会批准(批号:SHERLL2016026),研究对象及其监护人均已阅读并签署知情同意书。
2.研究方法:
(1) 问卷调查:采用统一设计的结构化问卷调查一般人口学资料、生活行为因素和家族疾病史等。
(2) 体格检查:①使用统一校正的仪器经培训过的调查员对调查对象进行身高和体重测量,连续测量2次,取平均值计入结果,计算BMI。②采用八电级生物阻抗法(H-Key350,北京四海华辰科技有限公司)检测体成分,记录脂肪质量,计算FMP(%)=[脂肪质量(kg)/体重(kg)]×100%,及FMI(kg/m2)=脂肪质量(kg)/身高(m)2。
(3) 血脂检测:采集空腹12 h后的静脉血5 ml,静置30 min后分离血清,冷藏运输至中心实验室进行血脂检测。基线和随访调查的血脂四项(TC、LDL-C、HDL-C和TG)均使用日立7080全自动生化检测仪进行检测。非HDL-C由TC减去HDL-C获得。
3.指标定义:根据《中国成人血脂异常防治指南(2016年修订版)》[5],生活行为因素、年龄和家族遗传因素等与血脂水平相关,且这些因素与肥胖有关,故本研究拟控制以下协变量:
(1) 控制变量:①尝试吸烟:近1个月吸过≥1支完整的香烟[9]。②尝试饮酒:近1个月喝过≥1个标准量的酒(白酒1两/啤酒1听/葡萄酒120 ml)。③理想运动:平均每天中等及以上强度运动≥60 min[9]。④饮食习惯:按照最近1个月摄入5类食品的情况(蔬菜/水果≥1次/d;水产品≥1次/周;全谷物食品≥1次/d;豆/奶制品≥1次/d;含糖饮料<1次/周),将其分为3级,即良好(满足4~5项)、中等(满足2~3项)和较差(满足≤1项)。⑤青春期发育状态:按照基线和随访时点是否出现遗精(男生)或初潮(女生)分为3类,即已成熟(基线时已出现)、成熟中(随访期间出现)和未成熟(至随访时点仍未出现)。⑥血脂异常家族史:父母任一方患血脂异常者。
(2) 基线期肥胖状态分别通过BMI、FMI和FMP指标进行定义:①采用“学龄儿童青少年超重与肥胖筛查标准”(WS/T 586-2018),BMI高于相应性别和年龄别肥胖界值者定义为肥胖(BMI定义)[10]。②根据我国儿童体脂肪量的参考水平[11],且考虑到前期研究结果发现以体脂肪量≥P75时预测血脂异常的效果最好[12],故本研究将FMI或FMP高于性别和年龄别P75定义为肥胖(体脂肪定义)。
(3) 持续性血脂异常:高TC、高LDL-C和高TG定义为检测结果高于“中国儿童血脂异常参考切点”性别和年龄别边缘升高切点,低HDL-C为检测结果低于“中国儿童血脂异常参考切点”性别和年龄别降低切点[13]。高非HDL-C定义为其值≥3.75 mmol/L[14]。基线和随访时点2次血脂水平均为异常者定义为持续性血脂异常。
4.统计学分析:定性资料用频数(%)描述,采用χ2检验进行组间比较。TG呈偏态分布,用M(P25,P75)描述,定量资料近似正态分布采用x±s描述,组间比较采用t检验。以持续性血脂异常为因变量,BMI、FMI和FMP定义的基线期肥胖为自变量,通过多因素非条件logistic回归分析校正潜在混杂因素后肥胖与持续性血脂异常的相关性。通过诊断试验四格表法计算在不同指标诊断的基线肥胖人群中进行各项持续性血脂异常筛查的灵敏度、特异度、阳性预测值和阴性预测值。采用受试者工作特征曲线下面积(area under curve,AUC)评估不同肥胖对持续性血脂异常的预测能力,以BMI定义的肥胖为参照组,利用Delong检验比较不同组AUC的差异。考虑到不同性别儿童生长发育各项生理指标的变异性,上述分析均按性别进行分层分析,以双侧检验P<0.05为差异有统计学意义。统计学分析采用R 3.4.2软件。
结果1.基本特征:10 783名研究对象基线年龄为(10.9±3.3)岁,男童5 345名(占49.6%)。经BMI、FMI和FMP定义的肥胖率分别为23.3%、25.0%和25.2%。不同性别的年龄和血脂异常家族史差异无统计学意义,其余指标的差异均有统计学意义(P<0.05)。见表 1。随访发现具有持续性高TC、高LDL-C、低HDL-C、高TG和高非HDL-C血症的儿童分别为139人(占1.3%)、127人(占1.2%)、460人(占4.3%)、136人(占1.3%)和88人(占0.8%)。
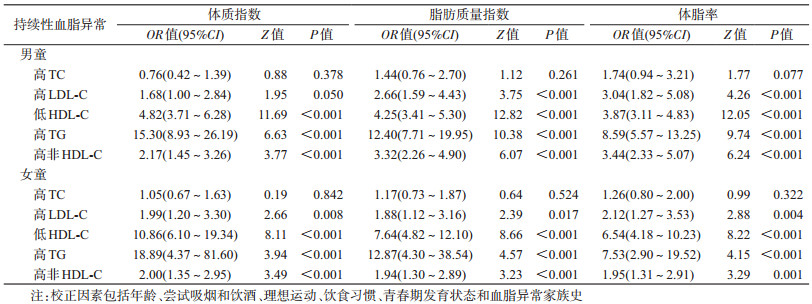
2.不同指标定义的肥胖与持续性血脂异常的关联性:多因素logistic回归分析结果显示,校正相关潜在混杂因素后,BMI、FMI和FMP诊断的肥胖与持续性高TC关联无统计学意义(P>0.05),与持续性低HDL-C、高TG和高非HDL-C的关联性均具有统计学意义(P<0.05),其中与持续性高TG的关联性最强。见表 2。
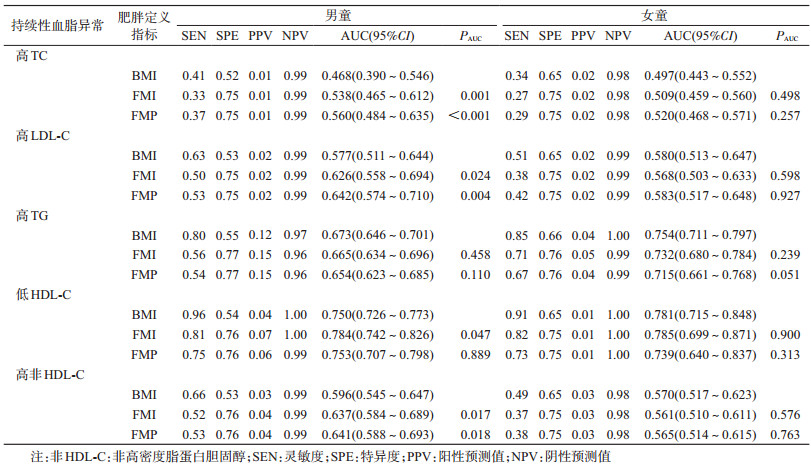
3.肥胖对持续性血脂异常的筛查效果:3种指标定义的肥胖预测持续性低HDL-C血症的效果最好,AUC均>0.7,其中男童中FMI定义的肥胖筛查的灵敏度为81%,特异度为76%,预测的AUC=0.784(95%CI:0.742~0.826),效果优于BMI定义的肥胖(P=0.047)。此外,在男童中FMI和FMP定义的肥胖预测持续性高LDL-C[FMI:AUC=0.626 (95%CI:0.558~0.694),P=0.024;FMP:AUC=0.642(95%CI:0.574~0.710),P=0.004]和高非HDL-C [FMI:AUC=0.637(95%CI:0.584~0.689),P=0.017;FMP:AUC=0.641(95%CI:0.588~0.693),P=0.018]的效果均优于BMI定义的肥胖,差异具有统计学意义。而在女童中,与BMI定义的肥胖相比,FMI和FMP定义的肥胖预测各项持续性血脂异常的效果差异无统计学意义。见表 3。
肥胖是血脂异常的重要危险因素,儿童血脂异常防治指南建议采用选择性筛查策略对BMI诊断的肥胖儿童进行血脂异常筛查[6]。但BMI作为评价身体总体重的指标,尚不能区分构成体重的脂肪和瘦组织,因此它无法精准评估由于体脂肪过度蓄积而带来的血脂异常风险[15]。本研究发现在男童中基于体脂肪的肥胖评估指标FMI和FMP预测持续性高LDL-C和高非HDL-C血症的效果(AUC)要优于BMI,此外男童中FMI诊断的肥胖预测持续性低HDL-C血症的效果要优于BMI诊断。但在女童中3个指标预测各项持续性血脂异常的AUC差异无统计学意义。
迄今,大量研究发现了“肥胖悖论”现象,即部分BMI超重/肥胖者其患心血管疾病的风险并未显著增高甚至有所降低[16]。有学者认为BMI计算中包含的瘦组织是产生该现象的原因之一,因为瘦组织含量的增多可以提高个体的心肺血管功能[17]。在很多临床环境中经常发现BMI正常的儿童也会出现血脂异常,尤其是LDL-C异常[15],这与本研究的结果一致,在基于FMI和FMP诊断的肥胖儿童中进行各项持续性血脂异常筛查的特异度均高于BMI。肥胖主要与TG和HDL-C异常的关系最为密切[15],本研究发现3个指标诊断的肥胖均与持续性高TG和低HDL-C异常关联性最强,且对它们的预测能力AUC高于其余3项持续性血脂异常。因此,在肥胖儿童中主要适宜开展持续性高TG/低HDL-C型血脂异常的筛查。肥胖导致血脂异常的主要机制之一是胰岛素抵抗,研究表明胰岛素抵抗可使脂肪细胞内TG分解增加,释放过多的游离脂肪酸进入血循环,另一方面胰岛素抵抗可能降低了三磷酸腺苷结合转运体-1(ABC-1)的功能,从而使HDL-C水平降低,因为ABC-1参与了游离胆固醇运出细胞外并与初始的高密度脂蛋白颗粒结合形成HDL-C这一过程[18]。此外,本研究结果显示男童中FMI定义的肥胖筛查持续性HDL异常效果优于BMI,而FMP与BMI相比差异无统计学意义。FMP和FMI均为衡量脂肪量的指标,FMP考虑脂肪组织占体重的百分比,易于理解,但未考虑身高因素,因此有学者认为FMI作为衡量的肥胖程度的外围指标效果要优于FMP[19]。
本研究中男童中基于体脂肪的肥胖评估指标(FMI和FMP)对持续性高LDL-C和高非HDL-C预测的效果要优于BMI(PAUC<0.05),但在女童中3个指标预测的效果差异无统计学意义,这可能与脂肪分布及其功能的性别差异有关[20-21]。研究发现[22],肥胖女性倾向于将脂肪存储在臀部和外周等非内脏区域,肥胖男性更易发生腹部脂肪尤其是内脏脂肪堆积,而内脏脂肪是导致脂质代谢紊乱的主要原因。内脏脂肪细胞对儿茶酚胺和糖皮质激素的作用更为敏感,从而更易释放游离脂肪酸进入门静脉系统,使肝脏合成TG的底物增加,因此肥胖女童可能由于脂肪多分布在非内脏区域,由脂肪增多而带来的心血管代谢异常风险要低于男性[23],故在本研究中未发现女童中FMI和FMP定义的肥胖筛查效果优于BMI。
本研究利用国内儿童队列的随访数据首次探讨了BMI、FMI和FMP定义的肥胖对持续性血脂异常的筛查效果,样本量较大。以学校为基础的样本相较于医院来源的样本更具代表性。本研究主要缺点:首先,样本来源于北京市学龄儿童,结论外推至其他地区或种族的儿童时需谨慎;其次,体成分数据由生物电阻抗法测得,而非金标准方法。但生物电阻抗法具有易操作性和经济性,更适合大规模的人群调查,且与金标准测量结果具有良好的相关性[24]。
综上所述,在基于体脂肪评估的肥胖男童中开展持续性高LDL-C、低HDL-C和高非HDL-C的筛查效果要优于BMI肥胖者。因此,在ASCVD的儿童期预防上,应强调肥胖的精准评估技术应用。
利益冲突 所有作者均声明不存在利益冲突
志谢 北京市东城区中小学卫生保健所(陈海华、石晓燕、陈春宇、付鹏翀);北京市密云区中小学卫生保健所(朱忠信、尹钱、崔海洪、聂长琳);北京市通州区中小学卫生保健所(李建辉、韩卫民、王景波);北京市房山区中小学卫生保健所(林宁翔、高素梅);北京市教育委员会(宋玉珍)
| [1] |
GBD 2016 Risk Factors Collaborators. Global, regional, and national comparative risk assessment of 84 behavioural, environmental and occupational, and metabolic risks or clusters of risks, 1990-2016:a systematic analysis for the Global Burden of Disease Study 2016[J]. Lancet, 2017, 390(10100): 1345-1422. DOI:10.1016/S0140-6736(17)32366-8 |
| [2] |
Lee JH, Kim HC, Kang DR, et al. The 23-year tracking of blood lipids from adolescence to adulthood in Korea:the Kangwha study[J]. Lipids Health Dis, 2017, 16: 221. DOI:10.1186/s12944-017-0615-2 |
| [3] |
Magnussen CG, Venn A, Thomson R, et al. The association of pediatric low-and high-density lipoprotein cholesterol dyslipidemia classifications and change in dyslipidemia status with carotid intima-media thickness in adulthood:evidence from the cardiovascular risk in Young Finns study, the Bogalusa Heart study, and the CDAH (Childhood Determinants of Adult Health) study[J]. J Am Coll Cardiol, 2009, 53(10): 860-869. DOI:10.1016/j.jacc.2008.09.061 |
| [4] |
程红, 陈芳芳, 叶佩玉, 等. 2013-2015年中国7城市6~17岁儿童青少年心血管代谢危险因素的流行特征[J]. 中华预防医学杂志, 2018, 52(11): 1130-1135. Cheng H, Chen FF, Ye PY, et al. Characteristics of cardiometabolic risk factors of children and adolescents aged 6-17 years in seven cities in China from 2013 to 2015[J]. Chin J Prev Med, 2018, 52(11): 1130-1135. DOI:10.3760/cma.j.issn.0253-9624.2018.11.007 |
| [5] |
中国成人血脂异常防治指南修订联合委员会. 中国成人血脂异常防治指南(2016年修订版)[J]. 中国循环杂志, 2016, 31(10): 937-953. Joint Committee on Revision of Guidelines for Prevention and Treatment of Dyslipidemia in Chinese Adults. Guidelines for the prevention and treatment of dyslipidemia in Chinese adults (Revised Edition 2016)[J]. Chin Circ J, 2016, 31(10): 937-953. DOI:10.3969/j.issn.1000-3614.2016.10.001 |
| [6] |
Daniels SR, Greer FR. Lipid screening and cardiovascular health in childhood[J]. Pediatrics, 2008, 122(1): 198-208. DOI:10.1542/peds.2008-1349 |
| [7] |
Mechanick JI, Hurley DL, Garvey WT. Adiposity-based chronic disease as a new diagnostic term:the American Association of clinical endocrinologists and American college of endocrinology position statement[J]. Endocr Pract, 2017, 23(3): 372-378. DOI:10.4158/EP161688.PS |
| [8] |
侯冬青, 高爱钰, 朱忠信, 等. 儿童青少年心血管与骨健康促进项目基线特征[J]. 中华预防医学杂志, 2018, 52(11): 1117-1123. Hou DQ, Gao AY, Zhu ZX, et al. The baseline characteristics of school-based cardiovascular and bone health promotion program in Beijing[J]. Chin J Prev Med, 2018, 52(11): 1117-1123. DOI:10.3760/cma.j.issn.0253-9624.2018.11.005 |
| [9] |
Steinberger J, Daniels SR, Hagberg N, et al. Cardiovascular health promotion in children:challenges and opportunities for 2020 and beyond:a scientific statement from the American Heart Association[J]. Circulation, 2016, 134(12): e236-255. DOI:10.1161/CIR.0000000000000441 |
| [10] |
北京大学儿童青少年卫生研究所, 中国疾病预防控制中心营养与健康所, 中国疾病预防控制中心妇幼保健中心. WS/T 586-2018学龄儿童青少年超重与肥胖筛查[S].北京: 中国标准出版社, 2018. Institute of Child and Adolescent Health, Peking University, National Institute of Nutrition and Health, Chinese Center for Disease Control and Prevention, National Maternal and Child Health Center, Chinese Center for Disease Control and Prevention. WS/T 586-2018 Screening for overweight and obesity among school-age children and adolescents[S]. Beijing: China Standards Publishing House, 2018. |
| [11] |
Dong HB, Yan YK, Liu JT, et al. Reference centiles for evaluating total body fat development and fat distribution by dual-energy X-ray absorptiometry among children and adolescents aged 3-18 years[J]. Clin Nutr, 2020. DOI:10.1016/j.clnu.2020.08.012 |
| [12] |
Lamb MM, Ogden CL, Carroll MD, et al. Association of body fat percentage with lipid concentrations in children and adolescents:United States, 1999-2004[J]. Am J Clin Nutr, 2011, 94(3): 877-883. DOI:10.3945/ajcn.111.015776 |
| [13] |
肖培, 程红, 侯冬青, 等. 中国儿童青少年血脂异常诊断切点的比较研究[J]. 中华流行病学杂志, 2020, 41(1): 62-67. Xiao P, Cheng H, Hou DQ, et al. A comparative study on diagnostic cut points of dyslipidemia in children and adolescents in China[J]. Chin J Epidemiol, 2020, 41(1): 62-67. DOI:10.3760/cma.j.issn.0254-6450.2020.01.012 |
| [14] |
Expert Panel on Integrated Guidelines for Cardiovascular Health and Risk Reduction in Children and Adolescents, National Heart, Lu ng, and Blood Institute. Expert panel on integrated guidelines for cardiovascular health and risk reduction in children and adolescents:summary report[J]. Pediatrics, 2011, 128(Suppl 5): S213-256. DOI:10.1542/peds.2009-2107C |
| [15] |
Daniels SR. Lipid concentrations in children and adolescents:it is not all about obesity[J]. Am J Clin Nutr, 2011, 94(3): 699-700. DOI:10.3945/ajcn.111.022483 |
| [16] |
Carbone S, Lavie CJ, Arena R. Obesity and heart failure:focus on the obesity paradox[J]. Mayo Clin Proc, 2017, 92(2): 266-279. DOI:10.1016/j.mayocp.2016.11.001 |
| [17] |
Carbone S, Canada JM, Billingsley HE, et al. Obesity paradox in cardiovascular disease:where do we stand?[J]. Vasc Health Risk Manag, 2019, 15(2): 89-100. DOI:10.2147/VHRM.S168946 |
| [18] |
张敏, 陆国平. 血脂异常与代谢综合征[J]. 中华心血管病杂志, 2003, 31(12): 958-960. Zhang M, Lu GP. Dyslipidemia and metabolic syndrome[J]. Chin J Cardiol, 2003, 31(12): 958-960. DOI:10.3760/j:issn:0253-3758.2003.12.026 |
| [19] |
Weber DR, Moore RH, Leonard MB, et al. Fat and lean BMI reference curves in children and adolescents and their utility in identifying excess adiposity compared with BMI and percentage body fat[J]. Am J Clin Nutr, 2013, 98(1): 49-56. DOI:10.3945/ajcn.112.053611 |
| [20] |
Karpe F, Pinnick KE. Biology of upper-body and lower-body adipose tissue-link to whole-body phenotypes[J]. Nat Rev Endocrinol, 2015, 11(2): 90-100. DOI:10.1038/nrendo.2014.185 |
| [21] |
Hodson L, Banerjee R, Rial B, et al. Menopausal status and abdominal obesity are significant determinants of hepatic lipid metabolism in women[J]. J Am Heart Assoc, 2015, 4(10): e002258. DOI:10.1161/JAHA.115.002258 |
| [22] |
Sun SY, Ji YW, Kersten S, et al. Mechanisms of inflammatory responses in obese adipose tissue[J]. Annu Rev Nutr, 2012, 32: 261-286. DOI:10.1146/annurev-nutr-071811-150623 |
| [23] |
Wells JCK. Sexual dimorphism of body composition[J]. Best Pract Res Clin Endocrinol Metabol, 2007, 21(3): 415-430. DOI:10.1016/j.beem.2007.04.007 |
| [24] |
Ng BK, Liu YE, Wang W, et al. Validation of rapid 4-component body composition assessment with the use of dual-energy X-ray absorptiometry and bioelectrical impedance analysis[J]. Am J Clin Nutr, 2018, 108(4): 708-715. DOI:10.1093/ajcn/nqy158 |
 2020, Vol. 41
2020, Vol. 41