文章信息
- 白宇鸽, 徐玲, 段学宁, 刘荫华, 叶京明, 刘倩, 程元甲, 辛灵, 王临虹, 包鹤龄, 余之刚, 刘丽媛, 王睿, 石志国.
- Bai Yuge, Xu Ling, Duan Xuening, Liu Yinhua, Ye Jingming, Liu Qian, Cheng Yuanjia, Xin Ling, Wang Linhong, Bao Heling, Yu Zhigang, Liu Liyuan, Wang Rui, Shi Zhiguo
- 中国乳腺癌专病队列研究:临床队列的设计与初步结果
- The Breast Cancer Cohort Study in Chinese Women: research design and preliminary results of clinical multi-center cohort
- 中华流行病学杂志, 2020, 41(12): 2046-2052
- Chinese Journal of Epidemiology, 2020, 41(12): 2046-2052
- http://dx.doi.org/10.3760/cma.j.cn112338-20200507-00694
-
文章历史
收稿日期: 2020-05-07
2. 中国疾病预防控制中心慢性非传染性疾病预防控制中心, 北京 100050;
3. 山东大学第二医院, 济南 250033;
4. 北京科技大学 100083
2. National Center for Chronic and Non-communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 100050, China;
3. The Second Hospital of Shandong University, Ji'nan 250033, China;
4. University of Science and Technology Beijing, Beijing 100083, China
乳腺癌是全球女性最常见的恶性肿瘤之一,根据WHO国际癌症研究机构(International Agency for Research on Cancer,IARC)公布的GLOBOCAN 2018全球肿瘤流行病统计资料[1],2018年全球乳腺癌新发病例超过200万,死亡人数超过60万。根据国家癌症中心2019年发布的数据显示,乳腺癌为我国女性肿瘤发病首位,每年发病约30.4万,死亡约7.0万[2]。因此,乳腺癌正在严重威胁中国女性的生命,需要引起足够的重视。
深入了解肿瘤,在早诊早治的基础上进行精准治疗,提升医疗质量,是降低恶性肿瘤病死率的重要方法。然而,由于肿瘤异质性等生物学原因及各种社会因素,肿瘤诊治实践中既存在过度诊断和过度治疗问题,也存在诊断不及时和治疗不足的问题。建立前瞻性队列研究是解决这些问题的关键,能够准确评估哪些预防、治疗措施能够使患者生存获益,纠正传统的临床经验导向,准确判断临床治疗对改善患者预后的客观作用。
在乳腺癌诊疗的发展历史中,前瞻性队列研究为手术治疗、化疗、内分泌治疗、靶向治疗等提供了大量的循证医学证据,逐步提高了早期乳腺癌的治愈率。例如,1975年Fisher等[3]的一项前瞻性队列研究显示辅助化疗提高早期乳腺癌效果。1986年,他莫昔芬批准用于绝经后乳腺癌患者术后治疗[4],后续研究数据显示术后内分泌治疗5年可以减少肿瘤复发、延长患者生存时间[5],HEAR研究奠定了辅助一年曲妥珠单抗靶向治疗在治疗HER2阳性乳腺癌中不可或缺的作用[6]。已有研究对比验证了这些治疗手段在降低乳腺癌复发转移、提高生存方面的作用[7]。但目前国内外的临床队列建设如前所述,多为验证某一治疗手段的有效性而建立,队列规模较小,如近期规模较大的HERA研究中每个治疗组的患者<2 000例[6],收集资料的项目、标准也因临床试验设计而不同,随访也会随研究需要而终止。对于依赖于国家层面建立的大型随访数据库(包含预后等信息),往往缺少具体的治疗措施、治疗合并症等细节指标的记录。例如美国国立癌症研究所于1973年建立的SEER数据库,是北美最具代表性的大型肿瘤数据库之一,虽然收集了美国部分州(县)肿瘤患者的发病率、患病率、死亡率及其他相关数据,但有些重要指标例如肿瘤患者家族史、遗传病史、手术切缘、并发症及辅助化疗等指标未被收录[8]。
近年来,我国也认识到了建立大型队列研究对开展复杂疾病流行规律、病因学研究和实现精准医学的重要意义,但我国大型医疗中心分布在全国各地,形成了分散式队列[9-10],尚无大规模的基于临床的中国乳腺癌专病队列,2015年初,科技部提出了中国精准医疗计划,其中中国乳腺癌专病队列研究(Breast Cancer Cohort Study in Chinese Women,BCCS-CW)项目中的课题二“乳腺癌多中心临床队列研究”由北京大学第一医院承担,整合7省(市)共9家三级甲等医院的优秀医疗资源和学术资源,以期为中国乳腺癌专病队列建设提供有力的证据。
对象与方法1.基线调查:
(1) 研究目的:①联合全国多所三级甲等医院临床协作系统为基础,确定统一的病例纳入、排除标准,建立1万人乳腺癌多中心临床队列;②收集乳腺癌患者的基线信息、生物学信息、环境及社会信息、既往乳腺癌相关及非相关医疗史、遗传相关信息、体格检查信息、理化信息、影像学信息、病理学信息等;③采集患者的血液/组织样本等生物标本;④收集患者在诊治期间的诊断、治疗相关信息(手术、化疗、靶向治疗、内分泌治疗、放疗等),构建临床诊疗信息库;⑤在诊疗过程结束后长期随访其疾病复发、转移和生存状态,形成乳腺癌预后研究的标准化随访体系;⑥与项目中的社区人群队列建设、泛共享生物样本库建设及高效追踪系统研发相互依托,形成标准统一、可整合度高、开放共享的大型乳腺癌临床队列。
(2) 调查对象:在全国选取9所三级甲等医疗机构包括北京大学第一医院、山东大学第二医院、北京大学人民医院、河北医科大学第四医院、吉林大学第一医院、河南省肿瘤医院、中国人民解放军第四军医大学第一附属医院、西安交通大学第一附属医院和广东省妇幼保健医院,收取2015年1月1日至2017年12月31日在课题参与单位首诊的、经病理诊断为乳腺浸润性癌(Ⅰ~Ⅲ期及初诊Ⅳ期)及乳腺原位癌患者,排除标准为复发转移性乳腺癌(初诊Ⅳ期者除外)或伴有各类严重疾病而不能参加队列后续研究的对象以及研究者认为不适合入组的患者。所有队列研究对象均遵循知情同意原则并签署知情同意书,本研究通过中国CDC慢病中心伦理委员会审查(批准文号:NCNCD201610)。
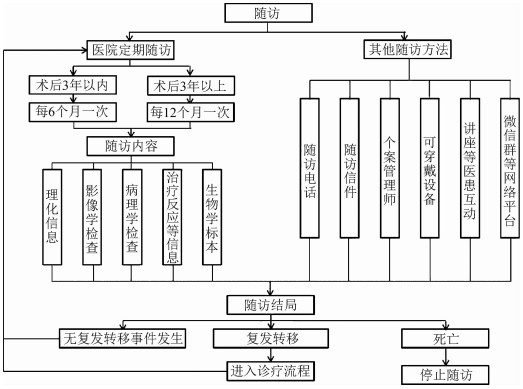
(3) 调查内容:对入组患者,从医院电子资料系统及调查问卷收集基线信息,并采集生物标本。诊治过程中将入组对象在各单位诊治期间的诊断、治疗相关信息以标准化的形式储存在电子病历、医院管理信息系统及影像归档和通信系统中。对于乳腺癌患者的长期随访监测,以医院定期随访为基础,在传统随访手段的基础上,采用互联网技术,针对乳腺癌的疾病特点,定制APP及配套的可穿戴设备、电子问卷等数据采集终端,远程、动态监测相关指标数据,对部分患者连续收集动态监测数据。最终各单位收集的信息及标本通过课题四构建的泛共享生物样本库实现整合,形成标准临床队列。
2.随访调查:随访目标人群为队列研究中纳入的参加基线调查的所有人。随访最早可于术后(无法做手术或拒绝手术者可于病理明确诊断后)6个月开始,随访间隔为6个月,经手术治疗3年以上无复发转移的患者可以将随访间隔延长为1年。随访信息主要包括死亡事件和复发转移事件,收集队列人群中发生的各类疾病所致的全因死亡相关信息,收集随访时间内发生的与乳腺癌相关的复发转移事件相关诊疗信息(包括发生事件时间、部位、诊断相关的体格检查、实验室检查、影像学检查、病理学检查信息及手术、化疗、放疗、靶向治疗等信息),收集随访时间内发生的其他疾病的诊疗信息。死亡事件为终点事件。经过多次联系,仍未能获取研究对象终点事件信息,确认为失访。多次联系定义为:在12个月内,至少选择不同月份的3个不同日期,通过电话联系、亲友问询、工作单位或居委会人员多途径确认。
在课题的队列随访体系中,除患者定期来医院进行随访,还由科室固定随访人员进行传统的电话、信件随访,及时进行患者生存信息及联系信息的更新。同时选取部分患者,利用可穿戴设备手环,记录患者日常活动中的运动、睡眠等实时数据,并将这些数据上传到服务器的电子信息数据库中。
为提高随访率,研究单位还采用多种方式增加患者的依从性,如定期举行患者教育宣教讲座、建立以课题组成员为主的患教平台。另外,多个合作单位还设立了个案管理师岗位,从患者门诊就诊预约乳腺空心针穿刺活检开始就进行管理和追踪,将乳腺癌患者诊治过程中的确诊期、围手术期、术后作为不同的关键点,通过面对面宣教、集体授课、随访电话、微信群、APP等方式完成个案管理的全程评估、计划、实施、反馈和评价,尽可能全方位掌握每一位患者的疾病及预后情况。并且本课题组与北京大学第一医院药剂科有良好的合作基础,药剂科临床药师在病房常规开展药学服务工作,为课题中临床病例的收集、随访、不良反应的评估提供了保障(图 1)。
|
| 图 1 随访流程图 |
3.质量控制:数据采集方法的标准化涵盖诊疗信息如影像学检查和病理学检查报告的标准化,因此根据研究形成的标准数据集搭建的数据库录入系统保证了数据形式的规范化:①建立并采用统一的操作流程;②充分借助计算机、互联网实现信息收集、储存、传输、加工的自动化,减少人工处理时的错误;③对测量仪器的误差进行评估和校准实现标准化;④组织专家组对项目实施过程进行质量督导及考核;新上岗的人员进行相关医学信息和随访技术培训,培训内容包括标准指标集中医学术语解释、随访时间、内容、方法及质控要求与评价指标;定期随机抽取研究对象进行填写内容的检查与核对,定期召开工作例会、课题讨论会,交流工作经验,反馈问题及提出改进措施;对承担课题的分中心医院进行完整性、准确性的量化考核。
4.统计学分析:数据分析使用SPSS 25.0软件,本研究基线数据进行的描述性统计学分析中,计量资料采用x±s进行描述,计数资料采用例数和百分比(%)表示。
结果1.标准化指标集的制订:以循证医学证据为基础的前瞻性临床队列才具有标准化、研究等级高、后期推广应用广泛的价值,因此课题组于2016年10月启动标准化指标集论证工作,经过文献复习论证,相关课题组成员、国内乳腺癌领域知名专家、乳腺癌相关诊疗技术领域专家(影像、病理、放疗等多学科领域)进行意见收集。对乳腺癌诊疗过程涉及的理化信息、影像学检查、病理学检查、诊疗方法、随访监测流程等,借鉴指南、大型Meta分析及随机对照研究结果等高证据等级的循证医学证据。针对研究中所需确立的有争议内容的标准,则通过专家论证的形式、借鉴专家共识来制定标准化指标集,专家论证采用德尔菲法。并于2017年2月举行“乳腺癌多中心临床队列研究”标准化指标集专家共识投票大会,通过循证医学方法及专家论证制定队列入组标准、信息收集及随访相关内容的标准化指标集。最终形成经循证医学和专家论证的“乳腺癌临床队列标准化指标集”。临床队列中重要的参考资料见表 1。
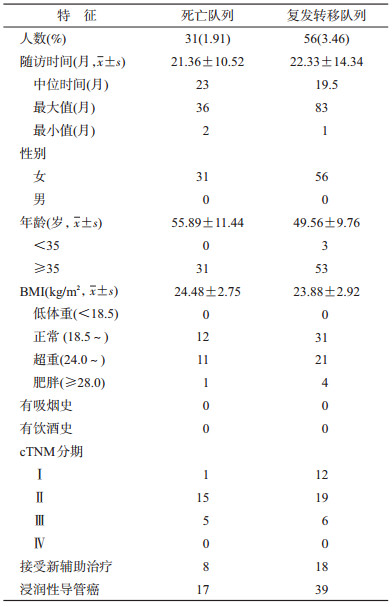
2.临床诊疗信息库建设:基于标准化的数据集,与课题三合作完成临床队列建设中的数据库建设,并编制乳腺癌临床队列数据库说明手册。数据库开发完成后由各合作单位完成入组病例的信息录入,目前1万例中国乳腺癌专病队列已建立。截至2020年2月临床队列数据库中纳入患者12 147例,入组患者的基线特征见表 2。数据库中已填写随访信息的患者1 812例,随访时间为43.1(1~79)个月,中位随访时间36个月,其中发生复发转移56人,死亡31人,发生复发转移及死亡事件患者的临床特征见表 3。
精准医学由美国全国科学研究委员会在2011年首次提出,美国国立卫生研究院于2012年将其中新定义为“建立在了解个体基因、环境及其生活方式基础上的新型疾病预防和治疗方法”。在乳腺癌治疗领域,对癌症基因组的全面理解、为开发新的疗法、临床环境中癌症治疗的预后和预测指标的发展提供了重要的见解。从2006年就启动,由美国国立癌症研究院、东部肿瘤协作组等多个大型机构、组织支持的TAILOx研究,纳入了约1万名患者的数据,随访10年的结果显示,在早期乳腺癌中,现在可以使用多基因测定来决策具有阴性淋巴结转移的激素受体阳性、HER2阴性患者的术后减免化疗的需求[45-46]。还有“篮子研究(Basket Trial)”和“伞式研究(Umbrella Trial)”,也是精准医学中的创新性临床研究的两大思路。具体的说,某种靶点明确的药物就是一个篮子,将带有相同靶基因的不同癌症放进一个篮子里进行研究就是篮子研究,本质就是一种药物应对不同的肿瘤。而伞式研究将具有不同驱动基因的某一种肿瘤,如肺癌的KRAS、EGFR、ALK,拢聚在同一把雨伞之下,撑起这把大伞,就是将不同的靶点检测在同一时间里完成,然后根据不同的靶基因分配不同的精准靶药物。这无论对加速少见疾病的临床试验还是对于某一个个体获得精准治疗的机会,都具有特别的意义。
大型队列研究是实现精准医学的基础,是研究“乳腺癌病因及疾病特征”的有效方法,也是研究“乳腺癌转化医学”和相关课题的黄金手段。Pfeiffer等[47]将国际上NIH-AARP(National Institutes of Health- AARP Diet and Health Study)队列中的191 604名女性和PLCO(the Prostate,Lung,Colorectal,and Ovarian Cancer Screening Trial)队列中的64 440名女性用于乳腺癌分析,开发了针对乳腺癌的绝对风险预测模型,但以上两个临床队列设计并非为乳腺癌专病队列。Terry等[48]通过乳腺癌前瞻性家庭研究队列ProF-SC(Prospective Family Study Cohort)对4种乳腺癌风险预测模型进行了验证和比较,但该队列仅入组了有乳腺癌家族史的15 732例女性,不能代表全部乳腺癌患者的特征。1995-2008年法国建立的纳入了3 006名原发性浸润性乳腺癌的E3N前瞻性队列研究[49],同样也只探讨了诊断前肥胖与乳腺癌生存之间的关系,具有一定的局限性,而目前国内尚无大型标准化、前瞻性乳腺癌病因及预后研究的相关队列建设。而本研究中所建立的中国乳腺癌专病队列,基于中国人群的患病情况,符合我国的乳腺癌发病模式及特征,可用于中国人群乳腺癌相关研究及预测模型的建立。
前瞻性队列的建设要求队列具有一定的规模,足够的随访年限,以满足研究目的的科学性要求,既满足“大而强”又要“小而精”,因此实施起来比较复杂,也有一定的难度。另外,临床及科研工作中建立的每一个队列均应该遵循可持续发展和科学发展的理念,随着新的治疗方法、新的生物标志物的出现,标准化指标集也需要根据新的循证医学证据及时更新,才能更加准确地对乳腺癌患者进行治疗方案的选择。因此,在建立乳腺癌队列的同时,也要定期对项目进行更新,同时随着数据资料的增大,也需要更高的技术支持对信息进行维护。在课题实施过程中借助课题组成员在乳腺癌研究领域的学术地位,应用国内学术团体活动,有利于课题成果的推广。
BCCS-CW通过各参与单位合作,共同建立精准医疗联合研究平台,形成高效、安全和一体化的专业流程,减少队列重复建设,降低队列建设成本支出,减少资源浪费,为乳腺癌复发转移信息预警系统提供基础,加强疾病的监测及干预,最终惠及广大女性的健康。构建中国乳腺癌专病队列,建立多层次精准医学知识库体系,及可操作的符合我国国情的生物医学大数据平台,这将对我国乳腺癌精准预防与治疗有着重大的科研价值和战略意义。
利益冲突 所有作者均声明不存在利益冲突
志谢 感谢国家科技部和国家卫生健康委员会医药卫生科技发展研究中心对项目的资助、支持和鼓励;感谢北京科技大学、中国疾病预防控制中心慢性非传染性疾病预防控制中心在数据库建设、质量控制等方面的支持;感谢山东大学第二医院、北京大学人民医院、吉林大学第一医院、西安交通大学第一附属医院、中国人民解放军第四军医大学、河北医科大学第四医院、河南省肿瘤医院、广东省妇幼保健院在患者入组、数据标本收集、随访、质量控制等方面所做的大量工作
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 41(1): 19-28. Zheng RS, Sun KX, Zhang SW, et al. Report of cancer epidemiology in China, 2015[J]. Chin J Oncol, 2019, 41(1): 19-28. DOI:10.3760/cma.j.issn.0253-3766.2019.01.005 |
| [3] |
Fisher B, Slack N, Katrych D, et al. Ten year follow-up results of patients with carcinoma of the breast in a co-operative clinical trial evaluating surgical adjuvant chemotherapy[J]. Surg Gynecol Obstet, 1975, 140(4): 528-534. |
| [4] |
Cole MP, Jones CT, Todd ID. A new anti-oestrogenic agent in late breast cancer[J]. Br J Cancer, 1971, 25(2): 270-275. DOI:10.1038/bjc.1971.33 |
| [5] |
Early Breast Cancer Trialists' Collaborative Group (EBCTCG). Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival:an overview of the randomised trials[J]. Lancet, 2005, 365(9472): 1687-1717. DOI:10.1016/s0140-6736(05)66544-0 |
| [6] |
Cameron D, Piccart-Gebhart MJ, Gelber RD, et al. 11 years' follow-up of trastuzumab after adjuvant chemotherapy in HER2-positive early breast cancer:final analysis of the HERceptin Adjuvant (HERA) trial[J]. Lancet, 2017, 389(10075): 1195-1205. DOI:10.1016/s0140-6736(16)32616-2 |
| [7] |
Cossetti RJ, Tyldesley SK, Speers CH, et al. Comparison of breast cancer recurrence and outcome patterns between patients treated from 1986 to 1992 and from 2004 to 2008[J]. J Clin Oncol, 2015, 33(1): 65-73. DOI:10.1200/jco.2014.57.2461 |
| [8] |
杨乔, 张俊萍. 肿瘤登记数据库的临床应用[J]. 循证医学, 2013, 13(4): 250-251, 256. Yang Q, Zhang JP. Clinical applications of the tumor registry database[J]. J Evid Based Med, 2013, 13(4): 250-251, 256. DOI:10.3969/j.issn.1671-5144.2013.04.016 |
| [9] |
Xu L, Li JH, Ye JM, et al. A retrospective survival analysis of anatomic and prognostic stage group based on the American joint committee on cancer 8th edition cancer staging manual in luminal B human epidermal growth factor receptor 2-negative breast cancer[J]. Chin Med J (Engl), 2017, 130(16): 1945-1952. DOI:10.4103/0366-6999.211896 |
| [10] |
Jiang YZ, Ma D, Suo C, et al. Genomic and transcriptomic landscape of triple-negative breast cancers:subtypes and treatment strategies[J]. Cancer Cell, 2019, 35(3): 428-440. DOI:10.1016/j.ccell.2019.02.001 |
| [11] |
中华人民共和国卫生部. 中华人民共和国卫生行业标准医院感染监测规范[J]. 中华医院感染学杂志, 2009(11): 1313-1314. Ministry of Health, the People's Republic of China. People's Republic of China health industry standard hospital infection surveillance standard[J]. Chin J Nosocomiol, 2009(11): 1313-1314. |
| [12] |
Mercado CL. BI-RADS update[J]. Radiol Clin North Am, 2014, 52(3): 481-487. DOI:10.1016/j.rcl.2014.02.008 |
| [13] |
Sickles EA, D'Orsi CJ, Bassett LW, et al. ACR BI-RADS? mammography[M]//ACR BI-RADSI? atlas, breast imaging reporting and data system. 5th ed. Reston, VA:American College of Radiology, 2013.
|
| [14] |
Hammond MEH, Hayes DF, Dowsett M, et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer (unabridged version)[J]. Arch Pathol Lab Med, 2010, 134(7). DOI:10.1043/1543-2165-134.7.e48 |
| [15] |
Hammond MEH, Hayes DF, Wolff AC, et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer[J]. J Oncol Pract, 2010, 6(4): 195-197. DOI:10.1200/jop.777003 |
| [16] |
中华人民共和国卫生部医政司. 乳腺癌诊疗规范(2011年版)[J]. 中国实用外科杂志, 2011, 31(10): 902-907. Department of Medical Administration, Ministry of Health of the People's Republic of China. Standards for diagnosis and treatment of breast cancer (2011 edition)[J]. Chin J Pract Surgery, 2011, 31(10): 902-907. |
| [17] |
中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2015版)[J]. 中国癌症杂志, 2015, 25(9): 692-754. Committee of Breast Cancer, China Anti-Cancer Association. Guidelines and standards for breast cancer diagnosis and treatment of the China anti-cancer association (2015 Edition)[J]. China Oncol, 2015, 25(9): 692-754. DOI:10.3969/j.issn.1007-3969.2015.09.010 |
| [18] |
Gradishar WJ, Anderson BO, Balassanian R, et al. Invasive breast cancer version 1[J]. J Natl Compr Canc Netw, 2016, 14(3): 324-354. DOI:10.6004/jnccn.2016.0037 |
| [19] |
Coates AS, Winer EP, Goldhirsch A, et al. Tailoring therapies-improving the management of early breast cancer:St gallen international expert consensus on the primary therapy of early breast cancer 2015[J]. Ann Oncol, 2015, 26(8): 1533-1546. DOI:10.1093/annonc/mdv221 |
| [20] |
Ogston KN, Miller ID, Payne S, et al. A new histological grading system to assess response of breast cancers to primary chemotherapy:prognostic significance and survival[J]. Breast, 2003, 12(5): 320-327. DOI:10.1016/s0960-9776(03)00106-1 |
| [21] |
U.S. Department of Health and Human Services, National Institutes of Health, National Cancer Institute. Common Terminology Criteria for Adverse Events (CTCAE) version 4.0[R]. U.S. Department of Health and Human Services, National Institutes of Health, National Cancer Institute, 2009.
|
| [22] |
Cox JD, Stetz J, Pajak TF. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC)[J]. Int J Radiat Oncol Biol Phys, 1995, 31(5): 1341-1346. DOI:10.1016/0360-3016(95)00060-c |
| [23] |
Berger AM, Mooney K, Alvarez-Perez A, et al. Cancer-related fatigue, version 2[J]. J Natl Compr Canc Netw, 2015, 13(8): 1012-1039. DOI:10.6004/jnccn.2015.0122 |
| [24] |
Berger MJ, Ettinger DS, Aston J, et al. NCCN guidelines insights:antiemesis, version 2[J]. J Natl Compr Canc Netw, 2017, 15(7): 883-893. DOI:10.6004/jnccn.2017.0117 |
| [25] |
Crawford J, Becker PS, Armitage JO, et al. Myeloid growth factors, version 2[J]. J Natl Compr Canc Netw, 2017, 15(12): 1520-1541. DOI:10.6004/jnccn.2017.0175 |
| [26] |
Roila F, Molassiotis A, Herrstedt J, et al. 2016 MASCC and ESMO guideline update for the prevention of chemotherapy-and radiotherapy-induced nausea and vomiting and of nausea and vomiting in advanced cancer patients[J]. Ann Oncol, 2016, 27. DOI:10.1093/annonc/mdw270 |
| [27] |
Khatcheressian JL, Hurley P, Bantug E, et al. Breast cancer follow-up and management after primary treatment:American Society of Clinical Oncology clinical practice guideline update[J]. J Clin Oncol, 2013, 31(7): 961-965. DOI:10.1200/jco.2012.45.9859 |
| [28] |
Denlinger CS, Ligibel JA, Are M, et al. NCCN guidelines insights:survivorship, version 1[J]. J Natl Compr Canc Netw, 2016, 14(6): 715-724s. DOI:10.6004/jnccn.2016.0073 |
| [29] |
Aaronson NK, Ahmedzai S, Bergman B, et al. The European organization for research and treatment of cancer QLQ-C30:a quality-of-life instrument for use in international clinical trials in oncology[J]. J Natl Cancer Inst, 1993, 85(5): 365-376. DOI:10.1093/jnci/85.5.365 |
| [30] |
Pusic AL, Klassen AF, Scott AM, et al. Development of a new patient-reported outcome measure for breast surgery:the BREAST-Q[J]. Plast Reconstr Surg, 2009, 124(2): 345-353. DOI:10.1097/PRS.0b013e3181aee807 |
| [31] |
Harris JR, Levene MB, Svensson G, et al. Analysis of cosmetic results following primary radiation therapy for stagesⅠand Ⅱ carcinoma of the breast[J]. Int J Radiat Oncol Biol Phys, 1979, 5(2): 257-261. DOI:10.1016/0360-3016(79)90729-6 |
| [32] |
Lee C, Sunu C, Pignone M. Patient-reported outcomes of breast reconstruction after mastectomy:a systematic review[J]. J Am Coll Surg, 2009, 209(1): 123-133. DOI:10.1016/j.jamcollsurg.2009.02.061 |
| [33] |
Rock CL, Doyle C, Demark-Wahnefried W, et al. Nutrition and physical activity guidelines for cancer survivors[J]. CA Cancer J Clin, 2012, 62(4): 243-274. DOI:10.3322/caac.21142 |
| [34] |
Saquib J, Rock CL, Natarajan L, et al. Dietary intake, supplement use, and survival among women diagnosed with early-stage breast cancer[J]. Nutr Cancer, 2011, 63(3): 327-333. DOI:10.1080/01635581.2011.535957 |
| [35] |
Jacobs ET, Thomson CA, Flatt SW, et al. Vitamin D and breast cancer recurrence in the Women's Healthy Eating and Living (WHEL) Study[J]. Am J Clin Nutr, 2011, 93(1): 108-117. DOI:10.3945/ajcn.2010.30009 |
| [36] |
Kwan ML, Greenlee H, Lee VS, et al. Multivitamin use and breast cancer outcomes in women with early-stage breast cancer:the Life After Cancer Epidemiology study[J]. Breast Cancer Res Treat, 2011, 130(1): 195-205. DOI:10.1007/s10549-011-1557-4 |
| [37] |
Greenlee H, Kwan ML, Kushi LH, et al. Antioxidant supplement use after breast cancer diagnosis and mortality in the Life After Cancer Epidemiology (LACE) cohort[J]. Cancer, 2012, 118(8): 2048-2058. DOI:10.1002/cncr.26526 |
| [38] |
Chlebowski RT, McTiernan A, Wactawski-Wende J, et al. Diabetes, metformin, and breast cancer in postmenopausal women[J]. J Clin Oncol, 2012, 30(23): 2844-2852. DOI:10.1200/jco.2011.39.7505 |
| [39] |
Gong ZH, Aragaki AK, Chlebowski RT, et al. Diabetes, metformin and incidence of and death from invasive cancer in postmenopausal women:Results from the women's health initiative[J]. Int J Cancer, 2016, 138(8): 1915-1927. DOI:10.1002/ijc.29944 |
| [40] |
Nielsen SF, Nordestgaard BG, Bojesen SE. Statin use and reduced cancer-related mortality[J]. N Engl J Med, 2012, 367(19): 1792-1802. DOI:10.1056/NEJMoa1201735 |
| [41] |
Sakellakis M, Akinosoglou K, Kostaki A, et al. Statins and risk of breast cancer recurrence[J]. Breast Cancer (Dove Med Press), 2016, 8: 199-205. DOI:10.2147/bctt.S116694 |
| [42] |
Hadji P, Coleman RE, Wilson C, et al. Adjuvant bisphosphonates in early breast cancer:consensus guidance for clinical practice from a European Panel[J]. Ann Oncol, 2016, 27(3): 379-390. DOI:10.1093/annonc/mdv617 |
| [43] |
Brady MJ, Cella DF, Mo F, et al. Reliability and validity of the Functional Assessment of Cancer Therapy-Breast quality-of-life instrument[J]. J Clin Oncol, 1997, 15(3): 974-986. DOI:10.1200/jco.1997.15.3.974 |
| [44] |
万崇华, 张冬梅, 汤学良, 等. 乳腺癌患者生命质量测定量表(FACT-B)中文版的修订[J]. 中国心理卫生杂志, 2003, 17(5): 298-300. Wan CH, Zhang DM, Tang XL, et al. Revision of the Chinese version of the FACT-B for patients with breast cancer[J]. Chin Ment Health J, 2003, 17(5): 298-300. DOI:10.3321/j.issn:1000-6729.2003.05.003 |
| [45] |
Sparano JA, Paik S. Development of the 21-gene assay and its application in clinical practice and clinical trials[J]. J Clin Oncol, 2008, 26(5): 721-728. DOI:10.1200/jco.2007.15.1068 |
| [46] |
Sparano JA, Gray RJ, Makower DF, et al. Adjuvant chemotherapy guided by a 21-gene expression assay in breast cancer[J]. N Engl J Med, 2018, 379(2): 111-121. DOI:10.1056/NEJMoa1804710 |
| [47] |
Pfeiffer RM, Park Y, Kreimer AR, et al. Risk prediction for breast, endometrial, and ovarian cancer in white women aged 50 y or older:derivation and validation from population-based cohort studies[J]. PLoS Med, 2013, 10(7): e1001492. DOI:10.1371/journal.pmed.1001492 |
| [48] |
Terry MB, Liao YY, Whittemore AS, et al. 10-year performance of four models of breast cancer risk:a validation study[J]. Lancet Oncol, 2019, 20(4): 504-517. DOI:10.1016/s1470-2045(18)30902-1 |
| [49] |
His M, Fagherazzi G, Mesrine S, et al. Prediagnostic body size and breast cancer survival in the E3N cohort study[J]. Int J Cancer, 2016, 139(5): 1053-1064. DOI:10.1002/ijc.30158 |
 2020, Vol. 41
2020, Vol. 41