文章信息
- 石婧, 石冰, 陶永康, 孟丽, 周子一, 陈术强, 段春波, 于普林.
- Shi Jing, Shi Bing, Tao Yongkang, Meng Li, Zhou Ziyi, Chen Shuqiang, Duan Chunbo, Yu Pulin
- 基于衰弱指数评估的老年人衰弱状况与死亡风险的相关性分析
- Relationship between frailty status and risk of death in the elderly based on frailty index analysis
- 中华流行病学杂志, 2020, 41(11): 1824-1830
- Chinese Journal of Epidemiology, 2020, 41(11): 1824-1830
- http://dx.doi.org/10.3760/cma.j.cn112338-20200506-00691
-
文章历史
收稿日期: 2020-05-06
2. 吉林大学白求恩第一医院胃肠内科内镜中心, 长春 130021;
3. 北京中日友好医院消化科 100029
2. Gastrointestinal Medicine and Endoscopy Department, The First Bethune Hospital of Jilin University, Changchun 130021, China;
3. Department of Gastroenterology, China-Japan Friendship Hospital, Beijing 100029, China
目前,广泛应用的老年人衰弱评估方法主要有2种,即由Fried等[1]提出的衰弱表型评估以及由加拿大Kenneth Rockwood教授团队创立的衰弱指数(frailty index,FI)模型[2]。FI的评估方法首次成功地实现了对老年人的衰弱状况进行定量描述,且对衰弱状况的评估更为宽泛;国外已有研究证实,以FI为基础评价的老年人衰弱状况能够较好地预测包括死亡在内的不良生存预后[3]。本研究应用北京市城市社区老年人健康状况及跌倒情况调查基线数据库,前瞻性分析基于FI评估的老年人衰弱对10年死亡风险的影响,为进一步了解和干预社区老年人衰弱及其对不良健康预后的影响提供依据。
对象与方法1.研究对象:数据来源于北京市城市社区老年人健康状况及跌倒情况随访调查数据库,调查现场为北京市东城区(原北京市崇文区)某街道办事处所管辖的社区,该社区基线调查时总人口51 710人,≥60岁老年人8 652人,占总人口的16.7%,老龄化程度与当时北京市平均水平15.4%相近[4]。采用整群随机抽样方法对随机抽取街道办事处下辖的4个社区居委会覆盖的≥60岁的老年人进行调查,符合要求的老年人共1 613人;纳入标准:调查社区≥60岁常住老年人;排除标准:存在躯体残疾或极度衰弱无法或不愿按照要求完成问卷测试者。该研究于2005年开展基线调查,拒访25人、失访(调查期间入户2次均未找到调查对象)52人,实际调查1 536人,应答率95.2%;共获得有效调查问卷1 512份,总有效率98.4%,并于2015年进行随访。根据研究目的,本研究以2005年基线数据作为分析样本,以2015年随访调查中对该队列人群的死亡情况作为结局变量进行分析。至2015年,排除211例10年期间失访者,失访率14.0%,均为离开或搬离调查地点的老年人,年龄(68.73±4.37)岁,男性102例(48.3%)、女性109例(51.7%);最终有1 301例研究对象纳入本研究,年龄(71.02±5.51)岁,男性556例(42.7%)、女性745例(57.3%);失访老年人年龄低于纳入研究老年人(t=5.750,P<0.001),但两者性别差异无统计学意义(χ2=2.320,P=0.128)。所有调查对象均签署知情同意书。
2.研究内容及评价标准:构建FI值所涉及的基线调查内容包括①一般情况(姓名、性别、出生年月、民族、文化程度、婚姻状况、过敏史、吸烟饮酒史);②一般健康状况(跌倒、尿失禁、疼痛、慢性便秘、体重下降、睡眠障碍);③视力听力评估;④行走平衡功能(是否使用行走辅助设备、能否独立行走400 m、以及进行平衡试验、5次起坐试验、起立-行走试验评估);⑤疾病用药情况(慢性疾病史、用药种类数);⑥日常生活活动能力评估包括躯体生活活动能力(ADL)评估和工具性日常生活活动能力(IADL)评估;⑦认知及情感[记忆力是否下降、情绪是否稳定以及采用简易精神状态量表(MMSE)进行评估];⑧老年人抑郁评估:采用流调中心抑郁量表(CES-D)(简化版)。同时以研究对象随访调查中的死亡情况作为结局变量,包括是否死亡以及死亡时间;死亡信息由工作人员通过研究对象的亲属、当地居委会(无亲属者)或当地公安机关(无亲属、无居委会者)收集或获取其死亡证明信息。
3. FI指标构建及计算:首先根据构建FI的健康缺陷变量需满足的条件从上述基线调查内容中共挑选出37个变量构建FI,再依据变量类型对健康变量进行赋值(如二分类变量则分别赋值为0、1,三分类变量则分别赋值为0、0.5、1,以此类推),各个变量的赋值范围为0~1,健康缺陷越严重其数值越大[5]。FI值的计算方法为存在健康缺陷的数目评分除以视为健康缺陷项目的总数目(本研究为37),反映的是个体所有健康测量指标中潜在的不健康指标所占的比例,其范围也为0~1,且数值越大表明个体存在的健康缺陷越多,也就越衰弱。
4.质量控制:所有研究内容的收集均采用经过专家论证的标准问卷,一对一现场问答和测量,调查员填写获得数据;参与调查的工作人员均经过严格培训并考核合格后参加调查,调查现场设质控员和协调员,发现问题及时纠正;数据采用专人双录入,并进行一致性检验和数据清理以保证收集数据的真实性和准确性。
5.统计学分析:采用SPSS 24.0和Matlab软件进行数据分析和制图,数据中变量的缺失值采用多重填补法中的MCMC法进行填补处理[6]。计量资料以x±s表示,多组间比较采用方差分析;计数资料以例数(百分比)表示,组间比较采用χ2检验;采用Cox回归模型评估FI对不同年龄组老年人死亡风险的影响,因考虑FI值数值较小,为0~1之间变化,所得出的风险比(HR)值不好解释,因此在多因素分析中,参照Kulminski等[7]的研究,将FI值进行1%单位的转换,即将每名老年人的FI值乘以100后四舍五入取整数,所得结果表示FI值每增加1%所带来的风险;采用Kaplan-Meier法绘制不同衰弱程度老年人的生存曲线,并进行log-rank检验。以P<0.05为差异有统计学意义。
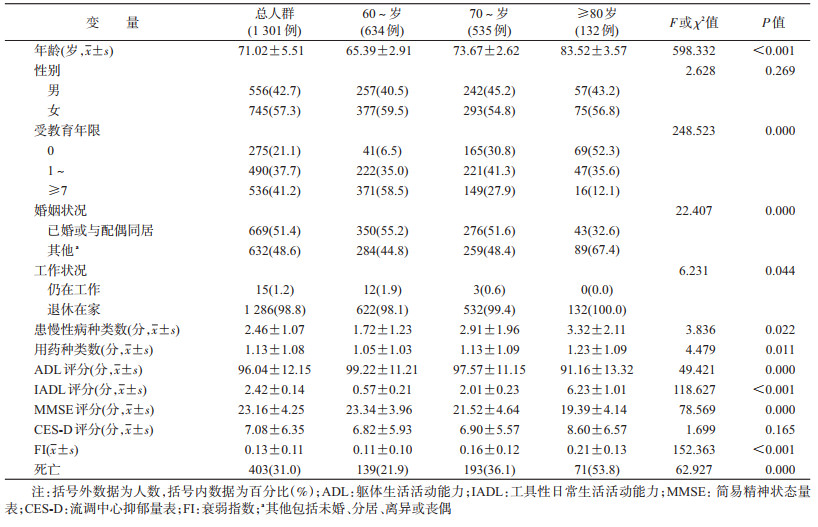
结果1.基线特征及死亡情况:纳入分析的1 301例老年人年龄(71.02±5.51)岁范围60~95岁。至2015年共死亡403例,10年期间死亡率为31.0%(403/1 301),其中死亡时间<5年者137例(34.0%)、≥5年者266例(66.0%);死亡老年人性别比较中,其中男性196例(48.6%)、10年期间死亡率为35.3%(196/556),女性207例(51.4%)、10年期间死亡率为27.8%(207/745),男性死亡率高于女性(χ2=8.302,P=0.004)。将老年人按照年龄分为60~、70~、≥80岁组,对老年人的基线特征及死亡情况进行比较,结果显示,60~岁老年人的文化程度、目前仍在工作者的比例要高于70~岁及≥80岁老年人,年龄越大的老年人(≥80岁组)丧偶的比例要高于60~岁和70~岁老年人;健康相关指标方面,随年龄的增加,老年人患慢性病种类数、用药种类数均增加;且ADL、MMSE评分降低、IADL评分增加;随年龄的增加老年人衰弱水平和死亡率增高,且高龄老年人(≥80岁)的FI值及死亡率明显高于非高龄老年人。见表 1。
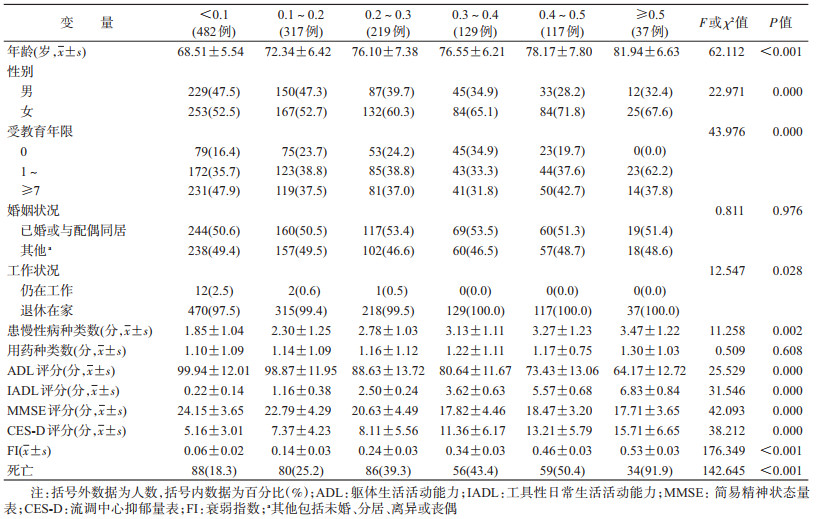
2.不同衰弱程度老年人基线一般情况比较:将老年人按照0≤FI<0.1、0.1≤FI<0.2、0.2≤FI<0.3、0.3≤FI<0.4、0.4≤FI<0.5、FI≥0.5进行分组,分析不同衰弱程度老年人的一般情况差异,结果显示,年龄越大者衰弱水平越高;随衰弱水平的增高,相比于男性,女性所占比例越来越高,即老年女性较老年男性更衰弱;衰弱水平低的老年人文化程度明显高于衰弱水平高者;调查期间仍在工作的老年人中大部分衰弱水平很低,FI<0.1;健康相关指标方面,不同衰弱水平的老年人患慢性病种类数、ADL、IADL、MMSE以及CES-D评分比较差异均有统计学意义,即老年人慢性病种类数的增多、ADL和IADL功能下降、认知能力降低以及抑郁症状的加重与衰弱水平的增加密切相关(均P<0.05);随着老年人衰弱水平的增加,其10年期间的死亡率从18.3%逐渐上升至91.9%。见表 2。
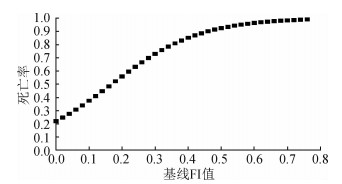
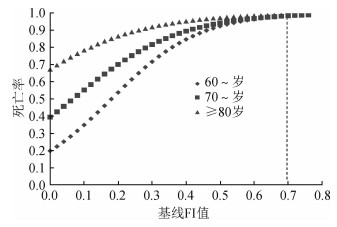
3.老年人衰弱水平与死亡率的关系:对老年人FI值与死亡率的关系依据文献[8]绘制logistic回归曲线进行分析,结果显示,老年人死亡率随着FI值的增加而增加,且随着FI值的增加死亡率增加的速度减缓,见图 1。进一步按照年龄分为60~、70~、≥80岁组进行分析,结果显示,不同年龄组老年人的死亡率均随FI值的增加呈指数增长;且在各个衰弱水平,老年人死亡率均随年龄的增加而增加,60~、70~、≥80岁组衰弱水平最低(FI=0)的老年人,其10年期间的死亡率分别为0.20、0.39和0.68;同时,计算60~、70~、≥80岁组老年人死亡率为100%时FI值分别为0.70、0.67、0.69,即老年人FI值所致死亡的极限值为0.70左右,在此基础上任何新增加的健康缺陷均可能导致老年人死亡。见图 2。
|
| 图 1 老年人衰弱水平与死亡率的关系 |
|
| 注:虚线为老年人死亡率达100%时FI的最大极限值 图 2 不同年龄组老年人衰弱水平与死亡率的关系 |
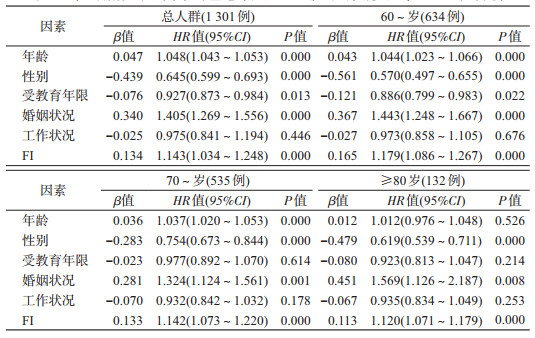
4. FI对不同年龄组老年人死亡风险影响的多因素Cox回归分析:以是否死亡和死亡时间为因变量、FI为自变量进行多因素Cox回归分析,调整变量年龄、性别(男=0、女=1)、受教育年限(0年=1、1~6年=2、≥7年=3)、婚姻状况(已婚或与配偶同居=1、其他=2)、工作状况(仍在工作=1、退休在家=2),结果显示,女性、文化程度高以及在婚的老年人死亡风险较对照组降低,而年龄和FI值增加会增加老年人死亡的风险,且FI值相比于年龄对死亡风险的预测价值更高(HR=1.143比HR=1.048,t=5.827,P=0.000)。进一步分析不同年龄组老年人群中FI对死亡风险的影响,结果显示,在年龄越大的老年人中,年龄对死亡风险的影响越来越不明显,在高龄老年人(≥80岁)中年龄对死亡的影响已无统计学意义(P>0.05);且随年龄增加,FI值即老年人衰弱对死亡风险影响的HR值从1.179降至1.120,即衰弱对死亡的影响也逐渐降低。见表 3。
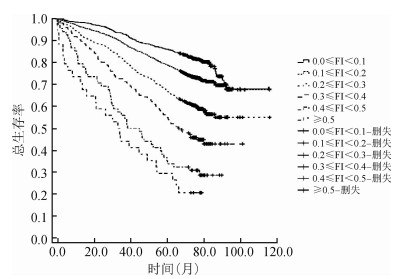
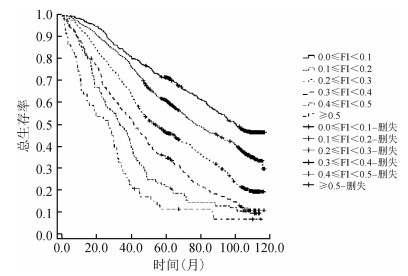
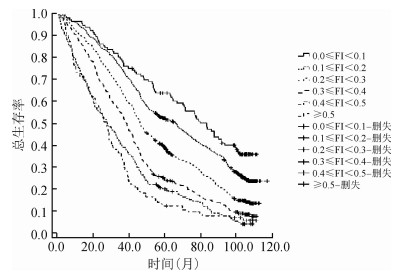
5.不同年龄组老年人不同衰弱程度生存曲线比较:对不同年龄组老年人进行生存时间分析结果显示,60~、70~、≥80岁组老年人随访10年的平均生存时间(92.48±3.08)个月、(80.52±3.55)个月、(59.54±2.15)个月;70~、≥80岁组老年人随访10年的中位生存时间分别为70.97、59.33个月,随年龄增长中位生存时间减少(log-rank=945.649,P=0.000);不同衰弱程度0.1≤FI<0.2、0.2≤FI<0.3、0.3≤FI<0.4、0.4≤FI<0.5、FI≥0.5老年人随访10年的中位生存时间分别为99.87、71.54、48.67、39.03、28.49个月(Log-rank=950.048,P=0.000)。进一步分年龄组比较不同衰弱程度的生存曲线,结果显示,各年龄组老年人的生存率均随衰弱程度的增加而降低(Log-rank=317.812、354.203、247.258,均P=0.000);对不同衰弱程度进行两两比较结果显示,仅≥80岁组高龄老年人衰弱程度较高组(0.4≤FI<0.5、FI≥0.5)生存率比较差异无统计学意义(P=0.368)。见图 3~5。
|
| 图 3 60~岁组老年人不同衰弱程度的生存曲线 |
|
| 图 4 70~岁组老年人不同衰弱程度的生存曲线 |
|
| 图 5 ≥80岁组老年人不同衰弱程度的生存曲线 |
FI模型是由加拿大的老年医学专家Kenneth Rockwood教授领导的团队创立,并以健康缺陷的累积为基础[1]。随着年龄的增长,人们常积累了多种健康问题,临床上常通过症状、体征、实验室指标异常、疾病和残疾来识别这些健康问题,这些健康问题则被称为健康缺陷。FI模型已在国外广泛应用于对老年人的衰弱状况进行评价,并已有多项研究证实FI具有较好的信度和效度[3, 9];除此之外,FI还具有较好的可重复性,不同的国家应用不同的数据采用FI评估方法评价老年人的衰弱特征,均得到了相同或相近的研究结果。国内全面系统地应用FI对内地老年人的健康状况进行评价并验证FI评估方法对中国老年人群的适用性则开始于2009年中国-加拿大关于老龄化和长寿合作研究(China-Canada Collaboration on Aging and Longevity,CCCAL)的开展,研究结果也均证明FI模型对中国老年人的适用性[10];对于构建FI的健康相关变量并无统一的标准,在实际应用中,不同的研究存在较大的差别,通常变量数量达到30~70个能使FI评估衰弱具有较高的稳定性,基于此,本研究采用FI模型对北京市城市社区老年人的衰弱状况进行评估,并按照标准从调查内容中共挑选出37个变量构建FI。本研究按照不同的衰弱水平对老年人的一般情况进行分析的结果显示,衰弱水平随年龄的增加而增高,且老年女性较男性衰弱水平更高,与Shi等[10]的研究结果一致;有研究者认为老年人体内性激素水平的变化参与了老年人衰弱的发生,性激素水平的下降与衰弱老年人肌无力、疲乏和功能降低直接相关,因此一般情况下,老年女性通常较老年男性更易表现出衰弱的各种症状[11]。研究显示,FI与其他反映衰弱的指标、健康不良预后如认知功能下降、残障以及多种疾病间的相关系数为0.4~0.8,存在中/高度相关[12];一项持续3年的随访研究结果显示,当个体的FI值增加0.1时,其日常生活活动量表(ADL)评分、简易精神状态评分和入院天数分别增加0.499分、0.613分和4.57 d[13];本研究结果显示,在健康相关指标方面,老年人慢性病种类数的增多、ADL和IADL功能下降、认知能力降低以及抑郁症状的加重与衰弱水平的增加密切相关,与上述研究结果一致。
老年人的衰弱状况能够预测其不良预后如功能下降、认知障碍、再入院甚至死亡的风险,本研究通过对社区老年人进行随访,在FI模型的基础上着重分析FI值对老年人10年死亡率的影响,结果显示,老年人死亡率随着衰弱指数的增加而增加,且随着FI值的增加死亡率增加的速度减缓;Zheng和Cheng[14]在分析人口异质性理论的研究中指出,在相对年轻衰弱变异程度较小的人群中,健康缺陷的积累会加速死亡风险的增加,与本研究死亡率随FI值变化的趋势一致。本研究结果还显示,不同年龄组的老年人FI所致死亡的数值均存在极限值(FI约0.70左右),即老年人的FI值达到极限时,任何新增加的健康缺陷均会导致老年人死亡,与以往的研究结果一致[8, 10],这一结果也支持研究者提出的人体生理性冗余衰竭的原则,即任何已累积大量健康缺陷的个体只能承受有限的额外损伤[15]。本研究Cox回归分析结果显示,不论总人群还是不同年龄组老年人,FI值相比于年龄对死亡风险的预测价值更高;研究显示,个体的生物年龄较生理年龄更能有效预测健康不良结局如死亡等[16],而FI与个体生物年龄的关系更为密切,其相关性还被应用于通过拟合年龄与FI之间的函数关系来计算确定个体的生物年龄,因此FI相比较于个体的实际年龄能更好地反映不同生理水平上与年龄相关的变化[17];同时研究结果还显示,随年龄增加衰弱对老年人死亡风险的影响逐渐减弱,与Cawthon等[18]的研究结果一致,提示随年龄增加,可能很多健康问题的致死风险就越来越小;从另一方面也表明高龄老年人可能较低龄老年人能更好地应对不良健康刺激。同理本研究在分年龄组比较不同衰弱程度老年人的生存率结果也显示,衰弱程度较高的高龄老年人生存率的差异无统计学意义,进一步支持上述对于年龄越大的高龄老年人,衰弱对于其死亡风险的影响越来越小。
本研究存在局限性。基线数据获取基于问卷调查,存在信息偏倚;此外,本研究为前瞻性研究,失访老年人均为离开或搬离调查地点相对年轻的老年人,所造成的失访偏倚对研究结果造成一定的影响,同时本研究未对老年人的死亡原因进行收集,不能排除他因死亡对研究结果的影响,未来有待于进一步完善调查问卷,补充相关信息进行更深入的分析。
综上所述,衰弱是机体多维结构包含生理、认知及社会等综合性的缺陷状态,而FI模型属于累计指数类综合性评估工具,采用FI模型对北京市城市社区老年人进行衰弱评估能够较好地反映老年人的衰弱特征,在预测不良健康预后如死亡率方面具有较高的敏感性;同时本研究提示在对老年人进行衰弱的干预时,着重于衰弱程度较轻或相对年轻的老年人可能更有效地减少衰弱所导致的不良结局。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Fried LP, Tangen CM, Walston J, et al. Frailty in older adults:evidence for a phenotype[J]. J Gerontol A, 2001, 56(3): M146-157. DOI:10.1093/gerona/56.3.m146 |
| [2] |
Mitnitski AB, Mogilner AJ, Rockwood K. Accumulation of deficits as a proxy measure of aging[J]. Sci World J, 2001, 1: 321027. DOI:10.1100/tsw.2001.58 |
| [3] |
Kojima G, Iliffe S, Walters K. Frailty index as a predictor of mortality:a systematic review and Meta-analysis[J]. Age Age, 2018, 47(2): 193-200. DOI:10.1093/ageing/afx162 |
| [4] |
姜向群. 北京市人口老龄化问题前瞻[J]. 人口学刊, 2001(2): 25-30. Jiang XQ. Prospect on the aging in Beijing[J]. Popul J, 2001(2): 25-30. DOI:10.3969/j.issn.1004-129X.2001.02.005 |
| [5] |
Searle SD, Mitnitski A, Gahbauer EA, et al. A standard procedure for creating a frailty index[J]. BMC Geriatr, 2008, 8: 24. DOI:10.1186/1471-2318-8-24 |
| [6] |
刘小莉, 王晓晓, 李楠, 等. 多重填补法在公共卫生调查研究中的应用[J]. 中华医学杂志, 2019, 99(46): 3675-3677. Liu XL, Wang XX, Li N, et al. Application of multiple filling method in public health investigation[J]. Natl Med J China, 2019, 99(46): 3675-3677. DOI:10.3760/cma.j.issn.0376-2491.2019.46.018 |
| [7] |
Kulminski AM, Ukraintseva SV, Kulminskaya IV, et al. Cumulative deficits better characterize susceptibility to death in elderly people than phenotypic frailty:lessons from the Cardiovascular Health Study[J]. J Am Geriatr Soc, 2008, 56(5): 898-903. DOI:10.1111/j.1532-5415.2008.01656.x |
| [8] |
Bennett S, Song XW, Mitnitski A, et al. A limit to frailty in very old, community-dwelling people:a secondary analysis of the Chinese longitudinal health and longevity study[J]. Age Age, 2013, 42(3): 372-377. DOI:10.1093/ageing/afs180 |
| [9] |
Apóstolo J, Cooke R, Bobrowicz-Campos E, et al. Predicting risk and outcomes for frail older adults:an umbrella review of frailty screening tools[J]. JBI Database System Rev Implement Rep, 2017, 15(4): 1154-1208. DOI:10.11124/JBISRIR-2016-003018 |
| [10] |
Shi J, Song XW, Yu PL, et al. Analysis of frailty and survival from late middle age in the Beijing longitudinal study of aging[J]. BMC Geriatr, 2011, 11: 17. DOI:10.1186/1471-2318-11-17 |
| [11] |
Al Saedi A, Feehan J, Phu S, et al. Current and emerging biomarkers of frailty in the elderly[J]. Clin Interv Aging, 2019, 14: 389-398. DOI:10.2147/CIA.S168687 |
| [12] |
Jones D, Song XW, Mitnitski A, et al. Evaluation of a frailty index based on a comprehensive geriatric assessment in a population based study of elderly Canadians[J]. Aging Clin Exp Res, 2005, 17(6): 465-471. DOI:10.1007/bf03327413 |
| [13] |
Woo J, Goggins W, Sham A, et al. Public health significance of the frailty index[J]. Disabil Rehabil, 2006, 28(8): 515-521. DOI:10.1080/09638280500215867 |
| [14] |
Zheng H, Cheng SW. A simulation study of the role of cohort forces in mortality patterns[J]. Biodemography Soc Biol, 2018, 64(3/4): 216-236. DOI:10.1080/19485565.2019.1568673 |
| [15] |
Legge A, Kirkland S, Rockwood K, et al. Evaluating the properties of a frailty index and its association with mortality risk among patients with systemic lupus erythematosus[J]. Arthritis Rheumatol, 2019, 71(8): 1297-1307. DOI:10.1002/art.40859 |
| [16] |
Yoo J, Kim Y, Cho ER, et al. Biological age as a useful index to predict seventeen-year survival and mortality in Koreans[J]. BMC Geriatr, 2017, 17: 7. DOI:10.1186/s12877-016-0407-y |
| [17] |
Kim S, Myers L, Wyckoff J, et al. The frailty index outperforms DNA methylation age and its derivatives as an indicator of biological age[J]. Gero Science, 2017, 39(1): 83-92. DOI:10.1007/s11357-017-9960-3 |
| [18] |
Cawthon PM, Marshall LM, Michael Y, et al. Frailty in older men:prevalence, progression, and relationship with mortality[J]. J Am Geriatr Soc, 2007, 55(8): 1216-1223. DOI:10.1111/j.1532-5415.2007.01259.x |
 2020, Vol. 41
2020, Vol. 41