文章信息
- 徐增豪, 杨金华, 李其龙, 章晓聪, 李佳昱, 王建炳, 唐梦龄, 金明娟, 陈坤.
- Xu Zenghao, Yang Jinhua, Li Qilong, Zhang Xiaocong, Li Jiayu, Wang Jianbing, Tang Mengling, Jin Mingjuan, Chen Kun
- 肠镜检查对结直肠癌发病风险影响的前瞻性评价研究
- Prospective evaluation on the impact of colonoscopy regarding the incidence of colorectal cancer
- 中华流行病学杂志, 2020, 41(10): 1662-1667
- Chinese Journal of Epidemiology, 2020, 41(10): 1662-1667
- http://dx.doi.org/10.3760/cma.j.cn112338-20200414-00573
-
文章历史
收稿日期: 2020-04-14
2. 浙江省嘉善县肿瘤防治所, 嘉兴 314100
2. Jiashan Institute of Cancer Prevention and Treatment of Zhejiang Province, Jiaxing 314100, China
结直肠癌(colorectal cancer,CRC)是最常见的消化系统恶性肿瘤。据估计,2018年,全球约有180万新发病例和90万死亡病例[1]。我国的结直肠癌发病在过去的几十年呈明显的上升趋势[2],居我国所有恶性肿瘤发病第3位[3],已成为重大的公共卫生问题。以往研究表明,肠镜下早期发现和摘除结直肠癌前病变能降低>70%的结直肠癌发生[4],其中,结直肠腺瘤和息肉是最常见的结直肠癌前病变[5-6]。国际上已有多项研究报道支持对目标人群实施肠镜检查,能有效降低结直肠癌的发病风险[7-9],这一保护作用可能与及早发现、摘除结直肠良性病变有关[10]。然而,我国尚缺乏此类前瞻性筛查干预效果评价研究。本研究基于浙江省嘉善县结直肠癌早诊早治筛查项目,结合当地恶性肿瘤发病和全死因死亡登记信息系统的监测数据,评价我国现行结直肠癌筛查策略下的肠镜检查对人群结直肠癌发病风险的影响,为我国结直肠癌人群防治策略的制定与完善提供流行病学证据。
对象与方法1.研究对象:嘉善县结直肠癌早诊早治筛查项目详细介绍参见文献[11-12]。项目针对当地40~74岁无高血压、心脏病、其他严重疾病、出血性倾向、精神类疾病和妊娠的人群开展结直肠癌筛查。整个筛查包括粪便隐血试验(iFOBT)和危险因素数量化评估问卷(HRFQ)联合初筛,以及初筛阳性人群进一步接受肠镜检查精确诊断两个步骤。其中,在初筛阶段,由当地卫生院负责进行iFOBT检查和初筛问卷调查。参与对象若符合以下①和②标准中的任何一项或以上即为初筛阳性(结直肠癌高危人群):①间隔1周进行2次iFOBT,任何一次阳性即为阳性;②采用HRFQ标准,符合以下任何一项或以上者即为阳性:一级亲属有结直肠癌史;本人有癌症史(任何恶性肿瘤病史);本人有肠道息肉史;同时具有慢性便秘、慢性腹泻、黏液血便、不良生活事件史、慢性阑尾炎或阑尾切除史、慢性胆道疾病史或胆囊切除史≥2项[13]。高危人群随后受邀进行结肠镜检查复筛。本研究通过浙江大学医学院伦理委员会审查(批准文号:第2016-002、2019-052号),所有研究对象均签署知情同意书。
2007年1月至2015年12月,共有160 813人完成初筛,其中,初筛阳性人群28 710人。研究剔除年龄、性别信息缺失者126人、基线iFOBT和问卷信息不完整2 201人、在参加筛查前已患有结直肠癌者165人、肠镜检查发现的结直肠癌病例200人、溃疡或肠炎病例124人后,最终纳入研究对象25 894人。
2.研究内容:年龄、性别等社会人口学特征、既往肠镜检查史、既往息肉史、家族结直肠癌史等变量信息收集由初筛阶段统一培训的乡镇卫生院医师完成。肠镜检查则统一至当地肿瘤防治所由经验丰富的胃肠科医师根据标准的临床程序进行。要求肠镜进入深度达回盲部,对过程中所有可见病变进行活检,进一步明确病理学诊断。同时,对首次检查肠道准备不足者,予1个月内充分准备后再行检查。本研究依据是否接受肠镜检查以及肠镜检查和病变组织病理学诊断结果,将对象区分为未接受肠镜检查(未接受检查)组、接受肠镜检查未发现病变(未发现病变)组和接受肠镜检查发现结直肠良性病变(发现病变)组,进行后续前瞻性研究。其中,发现病变组约有80%的研究对象接受了后续的病变去除治疗,其他对象则因病变过小等原因未接受治疗。
随访从研究对象完成基线调查开始,到出现结直肠癌发病、任意原因死亡或2018年12月31日为止。研究利用当地恶性肿瘤发病和全死因死亡登记信息系统获取研究对象的发病和死亡信息,既往对系统报告数据开展的质量评价结果表明该数据质量可靠[14]。疾病编码采用《国际疾病分类》第9版(ICD-9,2009年及以前使用)和《国际疾病分类》第10版(ICD-10,2010年及以后使用),以结肠癌(ICD-9 153和ICD-10 C18)和直肠癌(ICD-9 154和ICD-10 C19~C21)作为发病结局。
3.统计学分析:采用频数(%)描述3组人群的基线特征分布。采用Poisson分布检验比较各组发病密度的差异。使用Cox比例风险回归模型分析肠镜检查与结直肠癌、结肠癌、直肠癌发病的风险比(HR)值及其95%CI。分步调整以下可能的混杂因素:模型1调整年龄和性别;模型2在模型1的基础上进一步调整iFOBT结果、HRFQ结果和既往肠镜检查史。同时,研究在模型2的基础上进行了年龄(<60岁和≥60岁)、性别(男、女)的分层分析,以探究肠镜检查对不同亚组人群结直肠癌发病风险的影响是否保持一致。数据分析采用R 3.5.2软件进行,均为双侧检验,以P<0.05为差异有统计学意义。
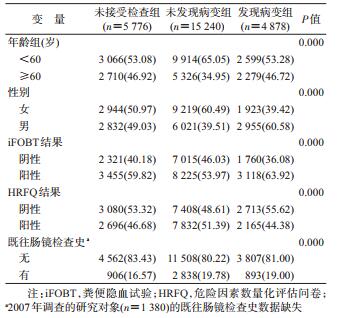
结果1.基线特征:共纳入25 894名研究对象,其中,≥60岁老年人10 315人(39.84%);男性11 808人(45.60%)。进一步分组后,未接受检查组、未发现病变组和发现病变组各有5 776、15 240和4 878人。3组对象在年龄、性别、iFOBT结果、HRFQ结果和既往肠镜检查史的基线变量分布见表 1,各基线特征在3组人群间分布差异均有统计学意义(P<0.05)。其中,发现病变组中男性(60.58%)和iFOBT阳性者(63.92%)所占比例较高;未发现病变组中<60岁者(65.05%)、HRFQ阳性者(51.39%)和具有既往肠镜检查史者(19.78%)所占比例较高。
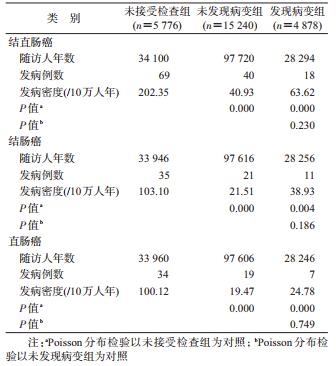
2.肠镜检查对结直肠癌发病的影响:研究对象累计随访160 113人年,中位随访期为5.67年。随访期间,共有结直肠癌新发病例127例,其中,结肠癌67例,直肠癌60例。分组分析后发现,未接受检查组的结直肠癌发病密度最高,发现病变组次之,未发现病变组最低,依次为202.35/10万人年、63.62/10万人年和40.93/10万人年。经Poisson分布检验,未发现病变组和发现病变组的结直肠癌发病密度与未接受检查组的差异均有统计学意义(P<0.05);而未发现病变组与发现病变组差异无统计学意义。进一步按病理部位分组,结肠癌和直肠癌在各组间发病密度差异与前述结直肠癌结果一致(表 2)。
多因素Cox比例风险回归模型分析发现,肠镜检查与结直肠癌发病的关联在两个模型中均较为稳定。模型2结果显示,在调整所有潜在的混杂因素后,以未接受检查组为对照,未发现病变和发现病变组结直肠癌发病HR值(95%CI)分别为0.24(0.16~0.36)和0.29(0.17~0.49),结肠癌发病HR值(95%CI)分别为0.25(0.14~0.42)和0.35(0.18~0.70),直肠癌发病HR值(95%CI)分别为0.23(0.13~0.41)和0.22(0.10~0.51),均呈有统计学意义的负关联效应(P<0.05)。然而,在接受肠镜检查者中,与未发现病变组相比,发现病变组的结直肠癌发病风险差异无统计学意义(表 3)。
3.肠镜检查与结直肠癌发病风险关联的分层分析:按年龄、性别因素进行的分层分析发现,与未接受检查组相比,未发现病变组和发现病变组的所有亚组人群中肠镜检查与结直肠癌发病的负关联效应均具有统计学意义(P<0.05)。对于接受肠镜检查者,未发现病变组与发现病变组的结直肠癌发病风险在所有亚组人群中差异均无统计学意义(P>0.05)。进一步按病理位置进行亚组分析发现,以未接受检查组为对照,发现病变组<60岁和女性亚组人群中结肠癌和直肠癌的发病风险改变无统计学意义(P>0.05)(图 1)。
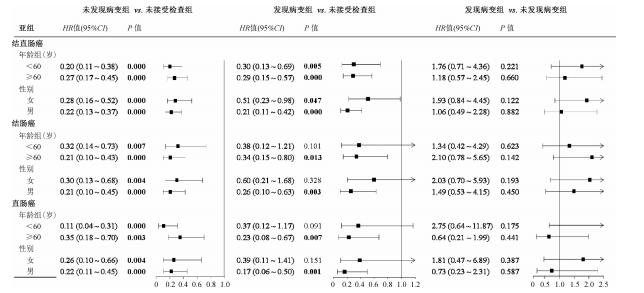
|
| 注:以年龄为分居因素的模型中调整性别(女vs.男)、粪便隐业试验结果(圆性vs.阳性)、危险因素数量化问整评估结果(阴性vs.阳性)和既往肠镜检查史(无vs.有); 以性别为分基因素的模型中调整年龄(<60岁vs.>60岁)、粪便隐血试验结果(阴性vs.阳性)、危险因素数量化问卷评估结果阴性社阳性)和既往肠镜检查史(无vs.有) 图 1 肠镜检查与结直肠癌发病风险关联的年龄、性别分层分析 |
基于浙江省嘉善县结直肠癌早诊早治筛查项目建立的人群队列,研究评价了肠镜检查对结直肠癌发病风险的影响。结果表明,接受肠镜检查人群无论检查结果如何,结直肠癌发病风险均比未接受肠镜检查组低,肠镜检查与结直肠癌发病风险呈现负关联效应;而接受肠镜检查的未发现病变与发现病变者结直肠癌发病风险没有显著改变。
国际上,已有多项研究证实肠镜检查可降低目标人群的结直肠癌发病风险。基于11项观察性研究的Meta分析结果显示,非肿瘤病例在接受结肠镜检查后结直肠癌发病率下降61%,结肠镜检查对结直肠癌发病风险的保护效应主要是通过切除肠镜下发现的息肉实现[15]。另外,来自英国[7]和意大利[16]的两项随机对照试验纳入55~64岁人群进行单次乙状结肠镜筛查,肠镜应答率分别为71.1%和58.3%,均发现肠镜干预组的结直肠癌发病风险显著低于未干预组,RR值分别为0.77(95%CI:0.70~0.84)和0.82(95%CI:0.69~0.96),这一保护作用同样可能是由于肠镜检查过程中摘除了探查到的病变。然而,一项在挪威开展的随机对照试验,经过7年的随访发现,乙状结肠镜筛查组的结直肠癌累计发病率相较未筛查组无显著差异。作者认为,筛查效果有限的原因可能是普遍高发的结直肠癌降低了息肉切除术的效应,可能需要更长的随访期才可观察到明显的差异[17]。本研究采用序贯筛查策略,目标对象年龄范围为40~74岁,对象首先经iFOBT和HRFQ初筛,初筛阳性的高危人群再受邀进行结肠镜检查,各筛查年份对象在肠镜检查环节的应答率普遍高于75%,研究结果发现接受肠镜检查的未发现病变组和发现病变组结直肠癌发病风险均低于未接受检查组,可能是由于未发现病变的对象是结直肠癌发病低风险对象,而发现病变组则由于约80%的研究对象后续接受了病变去除治疗,也使得结直肠癌的发病风险显著下降。目前,针对嘉善县高危人群的第二轮结直肠癌筛查仍在进行中,该结果可待后续筛查结果予以进一步验证。因此,在我国人群中广泛开展目标人群筛查性肠镜检查,对筛查发现病变对象进行进一步的治疗干预,可在一定程度上遏制我国结直肠癌发病的上升趋势。
既往有研究报道,与接受肠镜筛查没有发现结直肠病变者相比,发现病变者结直肠病变的再发风险高,而这一再发的病变可能因没有及时被发现而导致结直肠癌的发生,因此发现病变者的结直肠癌发病风险仍高于未发现病变者[18-19]。现行的结直肠癌筛查指南建议:对于肠镜检查未发现病变者,可间隔10年进行肠镜随访;而对于肠镜下发现高危病变者,需间隔3年进行肠镜随访[20]。本研究经过中位随访时间为5.67年的随访分析发现,接受肠镜检查未发现病变与发现病变组的发病密度差异无统计学意义,经潜在的混杂因素调整后,两组人群的结直肠癌发病风险亦无明显差异。该结果发现可随本研究样本量和随访时间的增加,予以进一步的验证,进而为我国目标人群肠镜随访间隔年限的制定提供客观证据。
本研究的主要优势是采用基于自然人群的前瞻性筛查干预设计,可对因果关联进行论证;中位随访时间>5年,观察期相对充足;采用多因素分析对潜在的混杂因素进行了调整。本研究存在局限性。首先,样本量相对较小,观察到的结直肠癌新发病例数较少;其次,研究根据对象基于本筛查项目在基线时是否接受肠镜检查和肠镜检查结果作为分组因素,没有考虑随访过程中对象因其他原因接受肠镜检查情况;再次,在发现病变组中约有20%的研究对象因为病变较小等原因并未摘除病变,因此,肠镜检查对结直肠癌发病的保护效应可能被低估;最后,本研究仅对经iFOBT和HRFQ初筛阳性的高危人群的结肠镜检查对结直肠癌发病风险的影响进行了分析,结果的外推相对有限,未来可进一步评价肠镜检查对我国不同目标人群结直肠癌发病风险的影响。
综上所述,本研究利用中位随访时间>5年的结直肠癌高危人群队列随访数据,分析发现肠镜检查能够有效降低高危人群结直肠癌的发病风险。因此,在结直肠癌防治工作中,应广泛开展人群结直肠癌早筛早治,并通过宣传教育提高高危人群肠镜检查的应答率,从而实现通过有力的公共卫生措施降低结直肠癌发病风险的目的。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
代珍, 郑荣寿, 邹小农, 等. 中国结直肠癌发病趋势分析和预测[J]. 中华预防医学杂志, 2012, 46(7): 598-603. Dai Z, Zheng RS, Zou XN, et al. Analysis and prediction of colorectal cancer incidence trend in China[J]. Chin J Prev Med, 2012, 46(7): 598-603. DOI:10.3760/cma.j.issn.0253-9624.2012.07.005 |
| [3] |
郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 41(1): 19-28. Zheng RS, Sun KX, Zhang SW, et al. Report of cancer epidemiology in China, 2015[J]. Chin J Oncol, 2019, 41(1): 19-28. DOI:10.3760/cma.j.issn.0253-3766.2019.01.008 |
| [4] |
Winawer SJ, Zauber AG, Ho MN, et al. Prevention of colorectal cancer by colonoscopic polypectomy[J]. N Engl J Med, 1993, 329(27): 1977-1981. DOI:10.1056/NEJM199312303292701 |
| [5] |
Strum WB. Colorectal adenomas[J]. N Engl J Med, 2016, 374(11): 1065-1075. DOI:10.1056/NEJMra1513581 |
| [6] |
Snover DC. Update on the serrated pathway to colorectal carcinoma[J]. Hum Pathol, 2011, 42(1): 1-10. DOI:10.1016/j.humpath.2010.06.002 |
| [7] |
Atkin WS, Edwards R, Kralj-Hans I, et al. Once-only flexible sigmoidoscopy screening in prevention of colorectal cancer:a multicentre randomised controlled trial[J]. Lancet, 2010, 375(9726): 1624-1633. DOI:10.1016/S0140-6736(10)60551-X |
| [8] |
Brenner H, Schrotz-King P, Holleczek B, et al. Declining bowel cancer incidence and mortality in Germany[J]. Dtsch Arztebl Int, 2016, 113(7): 101-106. DOI:10.3238/arztebl.2016.0101 |
| [9] |
Schoen RE, Pinsky PF, Weissfeld JL, et al. Colorectal-cancer incidence and mortality with screening flexible sigmoidoscopy[J]. N Engl J Med, 2012, 366(25): 2345-2357. DOI:10.1056/NEJMoa1114635 |
| [10] |
Brenner H, Kloor M, Pox CP. Colorectal cancer[J]. Lancet, 2014, 383(9927): 1490-1502. DOI:10.1016/S0140-6736(13)61649-9 |
| [11] |
黄秋驰, 叶丁, 蒋曦依, 等. 人群结直肠癌筛检项目成本效果分析与评价[J]. 中华流行病学杂志, 2017, 38(1): 65-68. Huang QC, Ye D, Jiang XY, et al. Cost-effectiveness analysis on colorectal cancer screening program[J]. Chin J Epidemiol, 2017, 38(1): 65-68. DOI:10.3760/cma.j.issn.0254-6450.2017.01.012 |
| [12] |
Ye D, Huang QC, Li QL, et al. Comparative evaluation of preliminary screening methods for colorectal cancer in a mass program[J]. Dig Dis Sci, 2017, 62(9): 2532-2541. DOI:10.1007/s10620-017-4648-1 |
| [13] |
Meng W, Cai SR, Zhou L, et al. Performance value of high risk factors in colorectal cancer screening in China[J]. World J Gastroenterol, 2009, 15(48): 6111-6116. DOI:10.3748/wjg.15.6111 |
| [14] |
蒋曦依.浙江省嘉善县居民恶性肿瘤发病和死亡的性别差异分析[D].杭州: 浙江大学, 2017. Jiang XY. Sex disparities in cancer incidence and mortality by period and age in Jiashan County, China[D]. Hangzhou: Zhejiang University, 2017. |
| [15] |
Pan J, Xin L, Ma YF, et al. Colonoscopy reduces colorectal cancer incidence and mortality in patients with non-malignant findings:a Meta-analysis[J]. Am J Gastroenterol, 2016, 111(3): 355-365. DOI:10.1038/ajg.2015.418 |
| [16] |
Segnan N, Armaroli P, Bonelli L, et al. Once-only sigmoidoscopy in colorectal cancer screening:follow-up findings of the Italian Randomized Controlled Trial-SCORE[J]. J Natl Cancer Inst, 2011, 103(17): 1310-1322. DOI:10.1093/jnci/djr284 |
| [17] |
Hoff G, Grotmol T, Skovlund E, et al. Risk of colorectal cancer seven years after flexible sigmoidoscopy screening:randomised controlled trial[J]. BMJ, 2009, 338: b1846. DOI:10.1136/bmj.b1846 |
| [18] |
Winawer SJ, Zauber AG, O'Brien MJ. Randomized comparison of surveillance intervals after colonoscopic removal of newly diagnosed adenomatous polyps. The National Polyp Study Workgroup[J]. N Engl J Med, 1993, 328(13): 901-906. DOI:10.1056/NEJM199304013281301 |
| [19] |
Singh H, Turner D, Xue L, et al. Risk of developing colorectal cancer following a negative colonoscopy examination:evidence for a 10-year interval between colonoscopies[J]. JAMA, 2006, 295(20): 2366-2373. DOI:10.1001/jama.295.20.2366 |
| [20] |
Gupta S, Lieberman D, Anderson JC, et al. Recommendations for follow-up after colonoscopy and polypectomy:a consensus update by the US multi-society task force on colorectal cancer[J]. Am J Gastroenterol, 2020, 115(3): 415-434. DOI:10.14309/ajg.0000000000000544 |
 2020, Vol. 41
2020, Vol. 41