文章信息
- 沈洁, 莫淼, 戴卫星, 周昌明, 王泽洲, 蔡国响, 翟连芳, 徐烨, 郑莹.
- Shen Jie, Mo Miao, Dai Weixing, Zhou Changming, Wang Zezhou, Cai Guoxiang, Zhai Lianfang, Xu Ye, Zheng Ying
- 肥胖与大肠高风险腺瘤发病风险研究
- Association between obesity and risk for colorectal advanced adenoma
- 中华流行病学杂志, 2020, 41(10): 1643-1648
- Chinese Journal of Epidemiology, 2020, 41(10): 1643-1648
- http://dx.doi.org/10.3760/cma.j.cn112338-20200410-00553
-
文章历史
收稿日期: 2020-04-10
2. 复旦大学上海医学院肿瘤学系, 上海 200032;
3. 复旦大学附属肿瘤医院大肠外科, 上海 200032;
4. 上海市闵行区七宝社区卫生服务中心 201101
2. Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China;
3. Department of Colorectal Surgery, Fudan University Affiliated Cancer Center, Shanghai 200032, China;
4. Shanghai Qibao Community Health Service Center, Minhang District, Shanghai 201101, China
大肠癌是目前全球五大最常见的恶性肿瘤之一,发病位居男性第3位、女性第2位[1-2]。在我国,大肠癌发病率和死亡率也是逐年上升,26.89/10万的发病率居全国恶性肿瘤的第4位[3],大肠癌的疾病负担日趋严重。已有大量的研究表明,肥胖与成年期结直肠癌风险增加相关,目前的研究认为炎症细胞因子、MS、肿瘤微环境和饮食等都是结直肠癌发病的潜在原因[4-9]。然而,鉴于多数大肠癌的发生都是由于腺瘤癌变,这一癌变的发生要经历漫长的一段时间,一般需要10年甚至10年以上,越来越多的学者认为肥胖可能增加大肠腺瘤的发生风险,继而增加大肠癌的发生风险。大肠腺瘤临床症状不显著、需要进行有创伤性的肠镜活检才能确诊,因此在人群中的早期发现存在困难,也给证实上述肥胖与腺瘤和大肠癌的关系造成困难。
随着我国社区大肠癌人群筛查项目的推广,越来越多机会可早期发现腺瘤,这为在人群中研究肥胖与腺瘤、大肠癌的关系提供了有利条件。上海市从2008年开始在闵行区七宝社区开展了社区人群大肠癌筛查项目。2008-2011年3年的试点研究,为大肠癌筛查的政策制定和实施提供依据[10],同时也检出了大量腺瘤。本研究在该项目的基础上,研究肥胖与大肠高风险腺瘤的关系,探索肥胖在大肠癌发生发展过程中的作用。
对象与方法1.研究对象:以2008-2011年上海市闵行区七宝社区大肠癌筛查试点中参加大肠癌筛查的45~74岁的社区居民为研究对象。纳入标准:①年龄45~74岁;②参与大肠癌筛查,并有完整筛查记录;③签署知情同意书。排除标准:①曾经罹患大肠癌;②本次基线筛查中确诊大肠癌及原位癌者。
2008-2011年该项目共筛查27 803人,初筛阳性率为13.7%,按照筛查方案,初筛阳性者进一步推荐去定点医院进行肠镜检查,41.7%完成了肠镜检查。完成筛查的27 803人中,6 739人缺乏完整筛查记录,57人曾经罹患大肠癌,基线筛查中确诊大肠癌75人、原位癌121人,最终纳入分析20 811人。
2.研究方法:研究对象的身高(身高仪)、体重(TANITA TBF-300GS体脂构成分析仪)由统一培训的专门调查员在进行基线风险评估的时候测量获得。测量时,要求调查对象穿着薄衣,脱去鞋帽,去除影响测量的头饰、口袋内容物如硬币、钥匙等,具体数值精确到0.1。BMI用体重(kg)除以身高(m)的平方计算得到。
按照WHO推荐的适合中国人的参考标准和2013年中华人民共和国卫生行业标准《成人体重判定》(WS/T 428-2013)[11],将BMI分成4组:正常:18.5 kg/m2≤BMI<24.0 kg/m2;偏瘦:BMI<18.5 kg/m2;超重:24.0 kg/m2≤BMI<28.0 kg/m2,肥胖:BMI≥28.0 kg/m2。
本研究中基线人口社会学信息、生活方式特征、肛肠疾病信息及家族史等由统一培训的调查员面对面询问获得。
本研究主要结局终点为大肠高风险腺瘤(advanced adenoma)发生,指1次肠镜检查发现≥3个腺瘤,或其中有1个腺瘤直径≥10 mm或有1/3绒毛结构以上或高级别上皮内瘤变。
随访结局评价:结局通过收集筛查对象的肠镜结果和人工主动随访获得。主要有3种随访方式:①所有筛查对象中初筛阳性对象,按照筛查方案到定点医院进行肠镜检查。有41.7%初筛阳性者做过肠镜,研究者直接通过定点医院的大肠癌筛查信息系统收集其肠镜报告,根据肠镜诊断判断是否发生结局;②所有初筛阳性而未进行肠镜检查者,通过电话随访及社区工作人员上门访视,询问是否进行过肠镜检查,以及肠镜检查结果;③所有初筛阳性经电话随访和上门方式未获得肠镜检查结果者,以及初筛阴性对象,最后通过与闵行区居民电子健康档案信息系统进行数据链接[12],搜寻是否在随访期间做过肠镜检查,及其检查结果。
3.统计学分析:采用SPSS 22.0软件对数据进行整理和分析,双侧检验α=0.05。采用精确法计算每位研究对象的观察人年数。第一次筛查进行问卷调查的时间为起始时间,截止时间为首次诊断大肠高风险腺瘤日期、失访或本次随访截止日期(2015年12月31日)。本研究随访的失访率为11.6%,失访者数据按照最后一次随访时间点作为删失数据处理。肥胖与大肠高风险腺瘤的关联分析使用Cox比例风险模型,以观察人年数为时间尺度,计算粗风险比(HR)值,并计算调整各种混杂因素(包括年龄、性别、大肠癌家族史、文化程度、婚姻状况、生活方式特征如吸烟、饮酒、脂肪类食物摄入、油炸或腌制类食物摄入及蔬菜水果摄入情况等)的HR值及其95%CI。以P<0.05为差异有统计学意义。
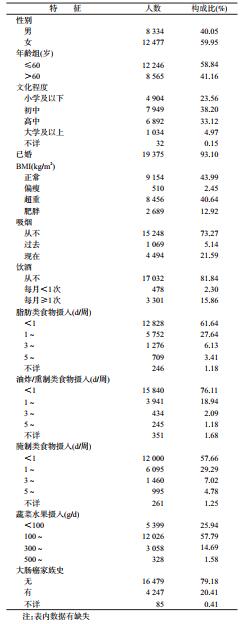
结果1.基本特征:截至2015年12月31日,20 811名研究对象共计随访122 739.36人年,平均随访时间为5.87年,到随访截止时间,共发生大肠高风险腺瘤657例,累计发生率为5.35‰。
研究对象年龄为(58.76±7.61)岁,BMI为(24.41±3.25)kg/m2,61.76%的对象为初中以下文化程度,53.56%的对象超重及肥胖,2/3以上的对象从不吸烟(73.27%)、从不喝酒(81.84%),>90%的对象脂肪类食物摄入、油炸/熏制类食物摄入及腌制类食物摄入每周<3次,83.73%的对象蔬菜水果摄入<300 g/d。20.41%的人有大肠癌家族史。见表 1。
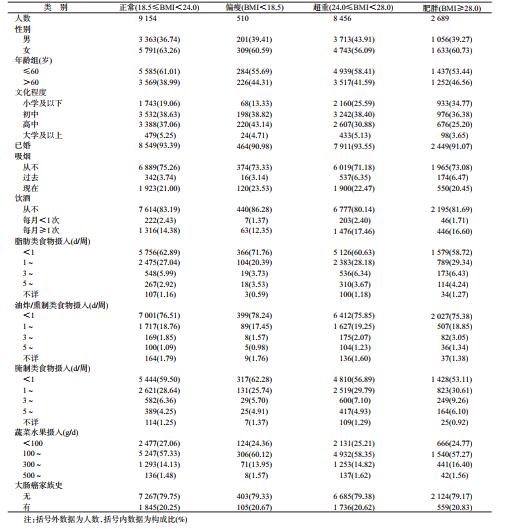
2.研究对象BMI分布特征:不同特征的对象BMI分布也不同。≤60岁、女性、超重及肥胖的比例较高。见表 2。
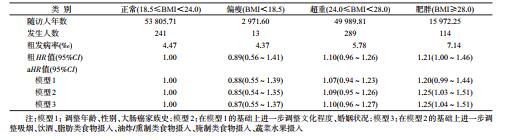
3.不同BMI与大肠高风险腺瘤发病风险分析:与体重正常者相比,肥胖者(BMI≥28.0 kg/m2)大肠高风险腺瘤发病风险增加21%(粗HR=1.21,95%CI:1.00~1.46)。调整年龄、性别、大肠癌家族史、文化程度、婚姻状况、生活方式特征如吸烟、饮酒、脂肪类食物摄入、油炸或腌制类食物摄入及蔬菜水果摄入情况等因素后(模型3),风险值有所提高,与体重正常者相比,肥胖者发生大肠高风险腺瘤的HR值为1.25(95%CI:1.04~1.51)。见表 3。
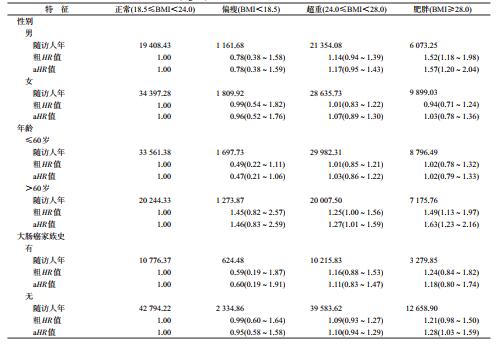
进一步分别按年龄、性别及大肠癌家族史进行分层分析后发现,在男性、>60岁人群中,肥胖者与体重正常者相比,大肠高风险腺瘤的发生风险更大(男性:aHR=1.57,95%CI:1.20~2.04;>60岁:aHR=1.63,95%CI:1.23~2.16)。见表 4。
本研究基于上海市闵行区大肠癌社区筛查项目人群的筛查和随访,分析肥胖与大肠高风险腺瘤之间的风险关联,探讨肥胖在大肠癌发生发展中所起的作用。结果显示,与体重正常者相比,肥胖者大肠高风险腺瘤发病风险提高,在男性、>60岁人群中,发生风险更大。
肥胖是全球性的重大公共卫生问题。1975年以来,全世界肥胖人数已增长近3倍,根据WHO估计,2016年全球约有6.5亿(13%)的成年人(男性11%,女性15%)肥胖[13]。肥胖对现在社会构成严重的危害,已成为全球导致人类死亡的第五大因素,每年至少280万的成年人由于肥胖相关疾病死亡[14],而越来越多的流行病学数据表明肥胖和许多癌症的发生发展息息相关,包括子宫内膜、乳腺、卵巢、前列腺、肝脏、胆囊、肾脏和结肠[15-16]。欧洲地区的统计资料显示11%的结直肠癌归因于超重和肥胖[17]。本研究利用2008年上海市社区大肠癌筛查试点资料,将主要终点结局设为大肠高风险腺瘤,大肠癌社区筛查被证明是最有效的发现早期肠癌、降低肠癌死亡率的社区干预方式,社区筛查中会发现大量尚未出现任何临床症状、看似健康的早期肠癌以及高风险腺瘤等癌前病变,且本研究平均随访时间长达5.87年,有助于我们从流行病学角度更全面地了解肥胖和大肠高风险腺瘤的关系和长期大肠癌发病风险。本研究结果提示:与正常人相比,肥胖者发生大肠高风险腺瘤的风险增加,与国内外其他研究及Meta分析结果一致,日本学者综合分析了2个病例队列、19个前瞻性队列和4个回顾性研究的Meta分析结果显示BMI>30.0 kg/m2者大肠高风险腺瘤的HR值(95%CI)为1.24(1.16~1.33)[18];另有中国学者对16个病例对照研究、13个横断面研究和7个队列/病例队列进行综合分析结果表明肥胖者大肠高风险腺瘤的发病风险增加19%(RR=1.19,95%CI:1.13~1.26)[19]。
本研究结果显示,男性肥胖者大肠高风险腺瘤发病的风险更高。有研究提示男性肥胖者结肠癌的风险增加30%~70%,而女性未出现相关风险的增加,可能与男、女性大肠癌发病的差异及男性更容易受MS影响有关[14]。有研究表明体内激素和MS存在一定的交互作用,并且MS发生大肠癌的风险只在男性中体现[20],或在男性中表现更强[21]。
本研究依托上海市社区大肠癌筛查试点项目,样本量大,随访时间较长,队列质量控制高,累积新发病例较多,尤其是在筛查中通过肠镜检查等确诊的癌前病变,结局变量和终点的判定比较全面,并依托居民电子健康档案较完善的区域开展随访,随访资料的收集比较完整、可靠,统计学效力高。研究中所有调查表信息全部由统一培训的调查员通过面对面询问获得,对于研究中的体格测量指标也是通过有经验的调查员通过统一的测量器具获得,相比研究对象自报的信息更为准确,一定程度上避免了信息偏倚和回忆偏倚。
本研究存在局限性。首先,体格测量指标是在2008年时进入筛查进行基线调查时测量所得,这些指标可能会随着时间及筛查的逐步推进和人们健康意识、防癌控癌等健康科普的逐步深入而发生变化,目前的研究中无法进行长期变化的考量,无法剔除由于测量指标长期变化对结果发生的影响;第二,本地调查中生活方式,包括饮酒、吸烟、脂肪类食物摄入、油炸/熏制类食物、腌制类食物摄入及蔬菜水果摄入等信息,都是由研究对象自报获得,因此可能存在信息偏倚;第三,本研究依托大肠癌筛查,筛查过程中容易受筛查意愿而产生一定的偏倚。但本研究主要目的是研究肥胖对于大肠高风险腺瘤发生风险的影响,有文献报道肥胖人群对于筛查存在一定的低顺应性,因此本结果相对来讲可能过于保守,在一般的人群中肥胖人群发生大肠肿瘤的风险可能更大。第四,本研究中并非所有的对象都进行了肠镜筛查,在阴性对象中可能会存在一定的高风险腺瘤对象,因此可能产生一定偏倚,但阳性对象错分为阴性,这在一定程度上是对结果起到了稀释作用,使得本结果相对保守,肥胖对于大肠高风险腺瘤的作用更大。
综上所述,本研究利用上海市大肠癌社区筛查2万人群的近6年随访数据发现,肥胖是大肠高风险腺瘤发生独立的危险因素,在大肠癌的发生发展中起了重要作用。本研究结果提示,保持健康体重,避免肥胖仍是癌症一级预防的重要防控措施。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7-30. DOI:10.3322/caac.21442 |
| [2] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [3] |
赫捷, 陈万青. 2012中国肿瘤登记年报[M]. 北京: 军事医学科学出版社, 2012. He J, Chen WQ. 2012 Chinese cancer registry annual report[M]. Beijing: Military Medical Science Press, 2012. |
| [4] |
Renehan AG, Tyson M, Egger M, et al. Body-mass index and incidence of cancer:a systematic review and Meta-analysis of prospective observational studies[J]. Lancet, 2008, 371(9612): 569-578. DOI:10.1016/S0140-6736(08)60269-X |
| [5] |
Hopkins BD, Goncalves MD, Cantley LC. Obesity and cancer mechanisms:cancer metabolism[J]. J Clin Oncol, 2016, 34(35): 4277-4283. DOI:10.1200/JCO.2016.67.9712 |
| [6] |
Jarvis D, Mitchell JS, Law PJ, et al. Mendelian randomisation analysis strongly implicates adiposity with risk of developing colorectal cancer[J]. Br J Cancer, 2016, 115(2): 266-272. DOI:10.1038/bjc.2016.188 |
| [7] |
Park SM, Yun YH, Kim YA, et al. Prediagnosis body mass index and risk of secondary primary cancer in male cancer survivors:a large cohort study[J]. J Clin Oncol, 2016, 34(34): 4116-4124. DOI:10.1200/JCO.2016.66.4920 |
| [8] |
Thrift AP, Gong J, Peters U, et al. Mendelian randomization study of body mass index and colorectal cancer risk[J]. Cancer Epidemiol Biomarkers Prev, 2015, 24(7): 1024-1031. DOI:10.1158/1055-9965.EPI-14-1309 |
| [9] |
Iyengar NM, Gucalp A, Dannenberg AJ, et al. Obesity and cancer mechanisms:tumor microenvironment and inflammation[J]. J Clin Oncol, 2016, 34(35): 4270-4276. DOI:10.1200/JCO.2016.67.4283 |
| [10] |
郑莹, 龚杨明. 上海地区人群大肠癌筛查的研究和实践[J]. 中国肿瘤, 2013, 22(2): 86-89. Zheng Y, Gong YM. Research and practice of screening for colorectal cancer in population of Shanghai[J]. China Cancer, 2013, 22(2): 86-89. |
| [11] |
中华人民共和国国家卫生和计划生育委员会. WS/T 428-2013成人体重判定[S].北京: 中国标准出版社, 2013. National Health and Family Planning Commission of the People's Republic of China. WS/T 428-213 Criteria of weight for adults[S]. Beijing: Standards Press of China, 2013. |
| [12] |
翟连芳, 龚杨明, 叶爱军, 等. 居民电子健康档案在社区大肠癌筛查中的应用[J]. 中国肿瘤, 2013, 22(1): 32-34. Zhai LF, Gong YM, Ye AJ, et al. Application of residential health records in screening for colorectal cancer in community[J]. China Cancer, 2013, 22(1): 32-34. |
| [13] |
World Health Organization. Obesity and overweight[EB/OL]. (2020-04-01).https://www.who.int/news-room/fact-sheets/detail/obesity-and-overweight.
|
| [14] |
Bardou M, Barkun AN, Martel M. Obesity and colorectal cancer[J]. Gut, 2013, 62(6): 933-947. DOI:10.1136/gutjnl-2013-304701 |
| [15] |
Hursting SD, DiGiovanni J, Dannenberg AJ, et al. Obesity, energy balance, and cancer:New opportunities for prevention[J]. Cancer Prev Res (Phila), 2012, 5(11): 1260-1272. DOI:10.1158/1940-6207.CAPR-12-0140 |
| [16] |
Bhaskaran K, Douglas I, Forbes H. Body-mass index and risk of 22 specific cancers:A population-based cohort study of 5·24 million UK adults[[J]. Lancet, 384(9945): 755-765. DOI:10.1016/S0140-6736(14)60892-8 |
| [17] |
Renehan AG, Soerjomataram I, Tyson M, et al. Incident cancer burden attributable to excess body mass index in 30 European countries[J]. Int J Cancer, 2010, 126(3): 692-702. DOI:10.1002/ijc.24803 |
| [18] |
Okabayashi K, Ashrafian H, Hasegawa H, et al. Body mass index category as a risk factor for colorectal adenomas:a systematic review and Meta-analysis[J]. Am J Gastroenterol, 2012, 107(8): 1175-1185. DOI:10.1038/ajg.2012.180 |
| [19] |
Ben QW, An W, Jiang Y, et al. Body mass index increases risk for colorectal adenomas based on Meta-analysis[J]. Gastroenterology, 2012, 142(4): 762-772. DOI:10.1053/j.gastro.2011.12.050 |
| [20] |
Pelucchi C, Negri E, Talamini R, et al. Metabolic syndrome is associated with colorectal cancer in men[J]. Eur J Cancer, 2010, 46(10): 1866-1872. DOI:10.1016/j.ejca.2010.03.010 |
| [21] |
Ahmed RL, Schmitz KH, Anderson KE, et al. The metabolic syndrome and risk of incident colorectal cancer[J]. Cancer, 2006, 107(1): 28-36. DOI:10.1002/cncr.21950 |
 2020, Vol. 41
2020, Vol. 41