文章信息
- 景钦隆, 李泳光, 马蒙蒙, 古羽舟, 李科, 马钰, 吴迪, 吴燕, 罗雷, 张周斌.
- Jing Qinlong, Li Yongguang, Ma Mengmeng, Gu Yuzhou, Li Ke, Ma Yu, Wu Di, Wu Yan, Luo Lei, Zhang Zhoubin
- 基于广州市聚集性疫情的新型冠状病毒传染力及续发率研究
- Contagiousness and secondary attack rate of 2019 novel coronavirus based on cluster epidemics of COVID-19 in Guangzhou
- 中华流行病学杂志, 2020, 41(10): 1623-1626
- Chinese Journal of Epidemiology, 2020, 41(10): 1623-1626
- http://dx.doi.org/10.3760/cma.j.cn112338-20200310-00305
-
文章历史
收稿日期: 2020-03-10
新型冠状病毒肺炎(COVID-19)是由新型冠状病毒感染导致的新发急性呼吸道传染病[1],主要通过空气飞沫和密切接触传播。COVID-19与2003年暴发的SARS相似[2],但传播速度更快,给全球公共卫生及社会经济造成了严重影响[3]。
传染力和续发率是COVID-19研究的重要内容,是政府制定防控策略和措施、调度防疫资源的重要依据[4]。在COVID-19疫情暴发初期,病例识别和诊断标准尚未明确,且无足够数据量支持,早期传染力和续发率研究偏倚较大。本研究以未发生社区传播的广州市为研究现场,分析聚集性疫情特征,计算新型冠状病毒的传染力和续发率,为COVID-19科学防控提供参考依据。
对象与方法1.调查对象:数据来源于中国疾病预防控制信息系统传染病网络直报系统,截至2020年2月18日广州市COVID-19病例,报告后24 h内完成个案流行病学调查,收集发病及就诊经过、临床特征、暴露史、接触史等信息。
2.调查方法:根据个案流行病学调查报告收集临床特征、流行病学接触史、聚集性情况等信息,采集鼻/咽拭子等呼吸道标本,采用实时荧光定量RT-PCR方法进行新型冠状病毒核酸检测[5]。本研究经过广州市CDC医学研究伦理委员会审议批准。
3.相关定义[5]:
(1)①聚集性疫情:14 d内在小范围(如一个家庭、一个工地、一个单位等)发现≥2例确诊病例或无症状感染者,且存在因密切接触导致的人际传播的可能性,或因共同暴露而感染的可能性;非聚集性疫情则是单个病例未发现与其有流行病学关联的病例;②确诊病例:疑似病例符合咽拭子、鼻咽拭子等呼吸道标本新型冠状病毒核酸阳性,并有临床表现;③疑似病例:有流行病学史任何1条,且符合临床表现中任意2条,或者无明确流行病学史,符合临床表现中的3条;④新型冠状病毒感染者:咽拭子、鼻咽拭子等呼吸道标本核酸阳性者;⑤无症状感染者:即无临床症状,或者临床表现达不到疑似病例标准,呼吸道标本核酸阳性者,主要通过聚集性疫情调查和传染源追踪调查等途径发现;⑥临床表现:发热和/或呼吸道症状;具有COVID-19影像学特征;发病早期白细胞总数正常或降低,淋巴细胞计数减少;⑦流行病学史有3种情况:发病前14 d内有武汉市及周边地区,或其他有病例报告社区的旅行史或居住史;发病前14 d内与新型冠状病毒感染者有接触史;发病前14 d内曾接触过来自武汉市及周边地区,或来自有病例报告社区的发热或有呼吸道症状的患者;⑧发病日期:病例在流行病学调查时自我报告发热或咳嗽开始的日期。
(2)①输入病例:在广州市外居住或旅游,感染新型冠状病毒并待在广州市的病例;②本地病例:按最长潜伏期(发病前14 d)未离开广州,在广州市内感染新型冠状病毒,无外出旅游史或者居住史,或者无法追踪到明显输入来源的病例。
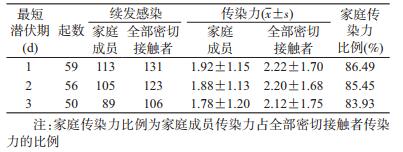
(3)①传染力:指1个病例可传染的人数,是衡量疾病传染性的重要参数。按传染力=续发感染数计算,与聚集性疫情的首发病例接触后,在最短潜伏期(分别按1、2和3 d)至14 d的聚集性感染人数,作为续发感染数;②续发率[4]:指在1个特定群体(如家庭、密切接触者)中,所有易感者被首发病例传染而发病的概率,续发率(%)=续发感染数/密切接触者总数×100。涉及家庭的传染力比例,指家庭成员传染力占全部密切接触者传染力的比例。COVID-19潜伏期范围1~14 d,多数为3~7 d,传染力和续发率计算排除<1 d的潜伏期。
4.统计学分析:连续型变量,符合正态分布计算x±s,不符合正态分布则计算中位数及P25~P75。分类变量计算合计数、百分比(%),两组差异比较采用χ2检验。按照输入病例或本地病例分类描述聚集性疫情或非聚集性疫情的情况,聚集性疫情分为输入引发聚集性疫情(输入聚集、输入引发本地病例)、本地病例引发聚集性疫情(本地聚集)。依据单起聚集性疫情,按2、3~5和≥6例分别计算起数、感染例数、确诊病例数和无症状感染者数,计算传染力和续发率及其95%CI值。采用Excel 2017软件整理数据,采用R3.4.4(stats、dplyr、ggplot2程序包)软件进行统计分析。检验水准α=0.05。
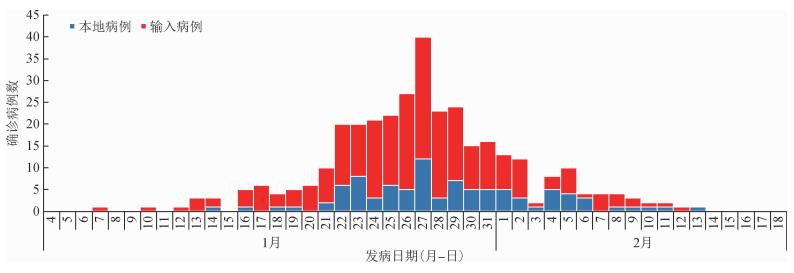
结果1.基本情况:截至2020年2月18日,广州市共报告新型冠状病毒感染例数349例,其中,确诊病例339例(97.13%),无症状感染者10例(2.87%)。339例中,输入病例247例(72.86%)、本地病例92例(27.14%)。见图 1。
|
| 图 1 2020年1--2月广州市339例新型冠状病毒肺炎确诊病例发病日期 |
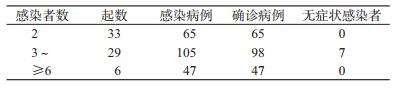
2.聚集性疫情:共报告聚集性疫情68起,涉及新型冠状病毒感染例数217例(确诊病例210例,无症状感染者7例)。见表 1。每起聚集性疫情的新型冠状病毒感染例数中位数为3(P25~P75:2~4)例,范围1~11例,其中,确诊病例数中位数为2(P25~P75:2~4)例,范围1~11例;无症状感染者数中位数为1(P25~P75:1~2)例,范围1~2例。
3.引发聚集性疫情病例来源:68起聚集性疫情中,由输入病例引发聚集性疫情61起,涉及感染例数200例,包括193例确诊病例和7例无症状感染者。其中,引发输入聚集38起、引发本地聚集23起。此外,由未追踪到感染来源的本地病例引发的聚集性疫情有7起,涉及17例确诊病例。见表 2。
68起聚集性疫情中,62起(91.2%)为家庭聚集,其余6起发生在公共场所。此外,家庭聚集性疫情感染例数主要为2~5人(96.8%,60/62),而公共场所聚集性疫情感染人数则有较多≥6人(66.7%,4/6),差异有统计学意义(χ2=20.05,P<0.05)。
4.传染力:最短潜伏期1~3 d的传染力平均值为2.18(即每起聚集性疫情中每个病例平均传染2.18人)。3种情形下,单起聚集性疫情传染力范围均为1~9。其中,家庭成员传染力平均值为1.86,单起聚集性疫情在家庭成员中的传染力范围均为0~5。家庭成员传染力比例为85.32%(1.86/2.18)。见表 3。
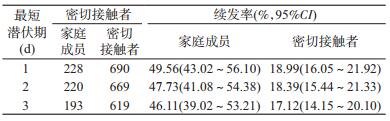
5.续发率:最短潜伏期为1~3 d的全部密切接触者续发率为17.12%~18.99%,其中,家庭成员续发率为46.11%~49.56%。见表 4。
广州市COVID-19疫情以输入疫情和聚集性疫情为主要特征,未发生社区传播,因而采用聚集性疫情评估新型冠状病毒传染力和续发率是可行的。广州市在1月21日报告首例病例(湖北省输入病例)后,本地疫情随着输入病例数变化而变化,因武汉市及湖北省相继采取关闭离汉通道、严格管控湖北省人员等防控措施,输入病例数迅速下降,新增本地病例数亦快速下降至0。
新型冠状病毒传播能力强,聚集性疫情较为多发,特别是以家庭聚集性疫情为主[6]。广州市家庭聚集性疫情起数占91.2%,北京市、上海市、江苏省等地家庭聚集性病例数占各类聚集性病例数超过80.0%[7]。广州市聚集性疫情属于小范围暴露传播模式,未出现传染超过10例的超级传播者[8],与甘虹等[9]针对安徽、海南、山东、河南、广东等省份聚集性疫情规模≤6例的研究结果相近。提示新型冠状病毒主要以近距离飞沫和接触传播为主要途径[10]。由于疫情发生正值春节假期,加上疫情预警及时,有效限制了人群聚集活动,人群活动主要集中于家庭内,或就餐等其他短距离场所。
传染力是新发传染病的重要特征参数[11]。目前,多数关于传染力的研究聚焦于基本再生数(R0)计算[3, 12]。R0指在未加干预的情况下,一个病例在易感人群中所产生续发病例的平均数[13],该指标是在疾病暴发早期通过总体疫情数据的微分方程数学模型估算而来,并非基于完全观察数据的描述分析。R0仅表征平均流行模式而忽略了人群内部由于家庭、社区等的结构差异而存在的传染力异质性[4, 13]。本研究以聚集性疫情为基础的完全观察数据,且在无社区传播的条件下计算传染力,最短潜伏期为1~3 d的传染力平均值为2.18。该数值与目前多数的数学模型传染力研究结果基本一致[1],相比于天津市基于完全观察的家庭续发病例数中位数2(P25~P75:1~7)例略高[6]。此外,本研究以核酸检测为基础,对于严格隔离的密切接触者实施核酸检测,一定程度上,排除了密切接触者再接触其他感染者的可能,因此,在计算传染力和发现无症状感染者方面具有优势。
续发率是衡量聚集性疫情传染力的一个指标,反映了社会互动与传播风险的关系。按最短潜伏期为1 d计算,本研究分析聚集性疫情的家庭续发率为49.56%,高于全部密切接触者续发率(18.99%),也高于近期报道的其他聚集性疫情的续发率(35.00%)[4]。这也提示我国多个地区在疫情防控前期,针对密切接触者采取非单人/单间的居家隔离措施,并不能有效切断家庭内传播途径,应集中隔离与医学观察。
该研究存在不足。一是未充分考虑传代时间,最短潜伏期限于3 d内计算的传染力或高于真实水平;二是部分聚集性病例在隔离前可能有近距离接触史;三是现场调查时密切接触者的甄别数量不够,都有可能导致续发率的结果偏倚;四是疫情早期阶段,检测技术仅限于核酸检测,核酸检测次数的限制,影响了无症状感染者的发现能力。
综上所述,广州市COVID-19聚集性疫情以家庭聚集性为主,传染力强,加强防控措施可有效控制社区传播。
利益冲突 所有作者均声明不存在利益冲突
志谢 感谢战斗在COVID-19疫情防控战线的广州市CDC与各区CDC、医疗机构与社区卫生服务中心、街道办事处及社区居委会、公安干警等所有工作人员
| [1] |
Li Q, Guan X, Wu P, et al. Early transmission dynamics in Wuhan, China, of novel coronavirus-infected pneumonia[J]. N Engl J Med, 2020, 382(13): 1199-1207. DOI:10.1056/NEJMoa2001316 |
| [2] |
Guan WJ, Ni ZY, Hu Y, et al. Clinical Characteristics of Coronavirus Disease 2019 in China[J]. N Engl J Med, 2020, Feb 28[Online ahead of print].DOI:10.1056/NEJMoa2002032.
|
| [3] |
Wu JT, Leung , Leung GM, et al. Nowcasting and Forecasting the Potential Domestic and International Spread of the 2019-nCoV Outbreak Originating in Wuhan, China:A Modelling Study[J]. Lancet, 395(10225): 689-697. DOI:10.1016/S0140-6736(20)30260-9 |
| [4] |
Liu Y, Eggo RM, Kucharski AJ. Secondary Attack Rate and Superspreading Events for SARS-CoV-2[J]. Lancet, 2020, 395(10227): e47. DOI:10.1016/S0140-6736(20)30462-1 |
| [5] |
国家卫生健康委办公厅.新型冠状病毒肺炎防控方案(第五版)[EB/OL].(2020-02-21)[2020-02-28]. http://www.nhc.gov.cn/xcs/zhengcwj/202002/a5d6f7b8c48c451c87dba14889b30147.shtml. General Office of National Health Commission. Prevention and control protocol for COVID-19(version 5)[EB/OL]. (2020-02-21)[2020-02-28]. http://www.nhc.gov.cn/xcs/zhengcwj/202002/a5d6f7b8c48c451c87dba14889b30147.shtml. |
| [6] |
Chan JF, Yuan S, Kok KH, et al. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission:a study of a family cluster[J]. Lancet, 2020, 395(10223): 514-523. DOI:10.1016/s0140-6736(20)30154-9 |
| [7] |
刘怡芳, 李佳萌, 周朋辉, 等. 天津市新型冠状病毒肺炎聚集性疫情病例分析[J]. 中华流行病学杂志, 2020, 41(5): 654-657. Liu YF, Li JM, Zhou PH, et al. Analysis on cluster cases of COVID-19 in Tianjin[J]. Chin J Epidemiol, 2020, 41(5): 654-657. DOI:10.3760/cma.j.cn112338-20200225-00165 |
| [8] |
Paules CI, Marston HD, Fauci AS. Coronavirus infections-more than just the common cold[J]. JAMA, 2020, Jan 23[Online ahead of print] DOI:10.1001/jama.2020.0757
|
| [9] |
甘虹, 张一, 袁敏, 等. 1052例新型冠状病毒肺炎聚集性病例流行病学特征分析[J]. 中华流行病学杂志, 2020. Gan H, Zhang Y, Yuan M, et al. Epidemiological analysis on 1052 cases of COVID-19 in epidemic clusters[J]. Chin J Epidemiol, 2020. DOI:10.3760/cma.j.cn112338-20200301-00223 |
| [10] |
中华预防医学会新型冠状病毒肺炎防控专家组. 新型冠状病毒肺炎流行病学特征的最新认识[J]. 中华流行病学杂志, 2020, 41(2): 139-144. Special Expert Group for Control of the Epidemic of Novel Coronavirus Pneumonia of the Chinese Preventive Medicine Association. An update on the epidemiological characteristics of novel coronavirus pneumonia (COVID-19)[J]. Chin J Epidemiol, 2020, 41(2): 139-144. DOI:10.3760/cma.j.issn.0254-6450.2020.02.002 |
| [11] |
中国疾病预防控制中心新型冠状病毒肺炎疫情防控技术组. 新型冠状病毒肺炎疫情紧急研究议程: 传播和非药物缓疫策略[J]. 中华流行病学杂志, 2020, 41(2): 135-138. Strategy and Policy Working Group for NCIP Epidemic Response. Urgent research agenda for the novel coronavirus epidemic: transmission and non-pharmaceutical mitigation strategies[J]. Chin J Epidemiol, 2020, 41(2): 135-138. DOI:10.3760/cma.j.issn.0254-6450.2020.02.001 |
| [12] |
Riou J, Althaus CL. Pattern of early human-to-human transmission of Wuhan 2019 novel coronavirus (2019-nCoV), December 2019 to January 2020[J]. Euro Surveill, 2020, 25(4):Posted January 24, 2020. DOI:10.2807/1560-7917.ES.2020.25.4.2000058.
|
| [13] |
Liu QH, Ajelli M, Aleta A, et al. Measurability of the epidemic reproduction number in data-driven contact networks[J]. Proc Natl Acad Sci U S A, 2018, 115(50): 12680-12685. DOI:10.1073/pnas.1811115115 |
 2020, Vol. 41
2020, Vol. 41