文章信息
- 邵丹彤, 李敏娟, 陈茹, 魏文强.
- Shao Dantong, Li Minjuan, Chen Ru, Wei Wenqiang
- 口腔菌群影响因素及其与上消化道肿瘤关联研究进展
- Progress in research of influencing factors of oral microbiome and association between oral microbiome and upper gastrointestinal cancer
- 中华流行病学杂志, 2020, 41(7): 1160-1164
- Chinese Journal of Epidemiology, 2020, 41(7): 1160-1164
- http://dx.doi.org/10.3760/cma.j.cn112338-20190725-00549
-
文章历史
收稿日期: 2019-07-25
人体微生物细胞的数量是人体内细胞数量的10倍,其所含基因数目的总和是人类基因组所含基因数目总和的150倍,在人体健康和疾病中起着至关重要的作用。在健康状态下,微生物与宿主共同维持机体稳态和动态平衡,一旦发生菌群失调,将导致疾病的发生和发展。口腔是人体微生物富集的重要器官,基于传统培养法及近年来新兴的不依赖纯培养法的分子生物学技术,已经有700多种口腔微生物被准确识别。值得关注的是,每个个体仅拥有这700多种口腔微生物中的100~200种[1],可见,不同个体、人群之间的口腔菌群存在巨大差异。
人类口腔微生物通过黏膜附着和固体表面定植两种定植形式,存在于口腔黏膜、舌部黏膜、牙菌斑以及唾液中。附着于黏膜表面的口腔微生物不断脱落进入唾液,使得唾液中的微生物群成为居住在口腔黏膜表面微生物的“指纹”。在健康状态下,唾液菌群与舌部菌群构成相似,主要由链球菌、韦荣球菌、普氏菌、奈瑟菌、梭杆菌属、放线菌属和纤毛菌属构成。牙菌斑是牙齿表面形成的生物膜,由大量细菌、细胞间物质、少量白细胞、脱落上皮细胞和食物残屑等组成,牙菌斑主要分为龈上菌斑和龈下菌斑,二者菌群构成较为相似,其菌群构成相比于唾液和舌部更为丰富,优势菌属除上述7个菌属之外,还有棒状杆菌、二氧化碳噬纤维球菌、罗氏菌和卟啉单胞菌[2]。口腔位于人体消化道起始部位且与外界相通,其各部位菌群构成容易受到多种因素的影响。近年来,越来越多的研究表明口腔菌群失调不仅与龋病、牙髓根尖周病、牙周病等口腔感染性疾病相关,而且也与口腔癌、食管癌、胃癌等上消化道肿瘤存在关联[3-4]。上消化道肿瘤是我国主要的癌症负担,其中胃癌和食管癌发病率居我国癌症发病的第二位和第六位,死亡率分别位于第三位和第四位[5]。明确口腔菌群在上消化道肿瘤发生发展中发挥的作用对于上消化道肿瘤的病因探索及早诊早治具有重要意义。本研究通过检索PubMed、Embase、中国知网、万方数据知识服务平台等数据库,以“口腔菌群”“影响因素”“微生物组学”“口腔癌”“食管癌”“胃癌”等为关键词,检索建库以来至2019年5月口腔菌群影响因素及其与上消化道肿瘤关联的相关研究,并进行综述。
一、口腔菌群的影响因素口腔菌群的构成、丰度及多样性可能受到多种因素的影响。性别、年龄、种族和地域分布等因素与口腔菌群构成及多样性相关。男性比女性易患牙周炎,而女性相比于男性更易发生龋齿,提示不同性别人群的口腔菌群构成可能存在差异,雌激素在青春期、月经、口服避孕药和怀孕阶段的累积效应可能会导致女性口腔微生物群的长期变化。关于性别与口腔菌群关联的证据较少,二者关联程度还需在不同疾病和健康状态下进一步研究[6]。研究发现口腔颊黏膜微生物的多样性在儿童至青少年阶段呈下降趋势,在青年至老年阶段呈上升趋势[7]。不同种族及地理环境人群的口腔菌群构成显著不同,非裔美国人口腔菌群多样性低于高加索人、中国人和拉丁美洲人[8],不同气候区如美国阿拉斯加州、德国和非洲地区人群唾液菌群存在显著差异[9]。
烟草使用与口腔菌群分布密切相关。欧洲地区的大型观察性研究表明,吸烟者血浆中针对牙周炎致病菌的IgG抗体水平显著低于不吸烟者,从而抑制体液免疫应答[10]。吸烟有利于牙周炎致病菌在口腔中的持续定植,且吸烟者口腔中的促炎细胞因子水平与共生细菌之间呈正相关,但在非吸烟者中未观察到这种关联[11]。吸烟者口腔中变形菌门、二氧化碳噬纤维菌属、消化链球菌属和纤毛菌属丰度相比于正常人降低,而链球菌丰度升高,且这些减少的菌群与二氧化碳和能量代谢、异生物质代谢有关。同时吸烟和饮酒者口腔菌群丰度降低,尤其是奈瑟菌[12]。虽然乙醇本身并不具有强烈的致癌性,但口腔细菌具有将乙醇转化为乙醛的能力,乙醛是一种体外和体内毒素,并被公认为人类致癌物质,可直接对口腔和胃肠道产生致癌作用。
关于肥胖和饮食习惯对口腔菌群的影响尚无统一定论。一项欧洲地区人群的队列研究表明,BMI、糖尿病、身体活动以及饮食习惯包括蔬菜、水果的摄入等因素与口腔菌群抗体水平无关[10]。但Haffajee和Socransky[13]开展的病例对照研究表明,肥胖者口腔福塞斯坦纳菌丰度显著高于正常人,不同饮食习惯人群口腔菌群存在差异。此外,美国大样本的横断面研究显示,饮茶可增加口腔菌群丰度和多样性,且可增加梭杆菌目等特定菌群的丰度;但未发现咖啡摄入量与口腔菌群构成相关[14]。我国研究表明,咀嚼槟榔可影响口腔链球菌和韦荣球菌的相对丰度[15]。
鉴于口腔菌群环境可能会受到诸多因素的影响,故在探索不同人群在疾病或健康状态下口腔菌群构成及多样性变化时,也应充分考虑以上潜在影响因素的作用。
二、口腔菌群与上消化道肿瘤口腔菌群不仅与口腔疾病相关,也参与机体其他系统性疾病如糖尿病[16]、心血管疾病[17]及胰腺癌[18]、结直肠癌[19]、肺癌[20]等的发生和发展。口腔微生物环境提供了慢性病的病理生理机制的核心——炎症反应。慢性炎症通过促进细胞增殖、突变、癌基因活化和血管生成,引起并促进肿瘤的发生和发展。上消化道作为与口腔邻近的下游器官,其菌群环境易于受到口腔微生物的影响。口腔机会性病原菌可随饮水和饮食进入上消化道,进而定植和繁殖,在一定条件下参与上消化道肿瘤的发生和发展。
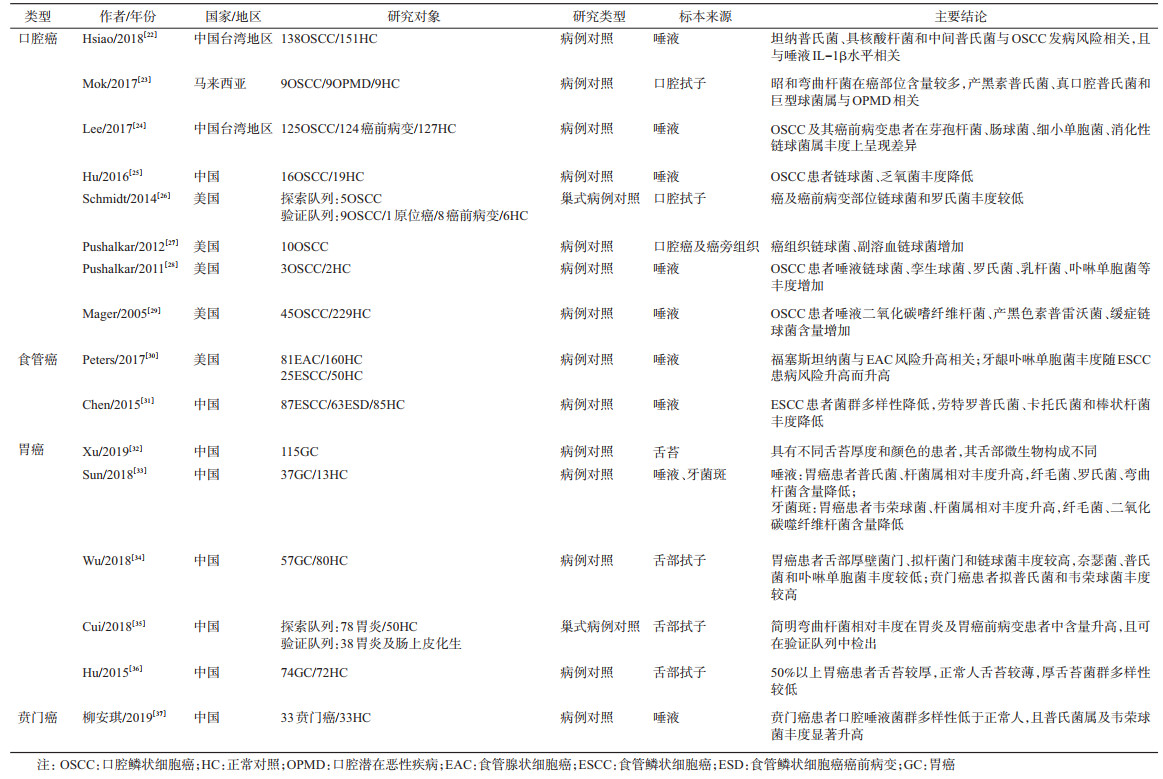
1.口腔菌群与口腔鳞状细胞癌:牙龈卟啉单胞菌和具核酸杆菌感染与牙周炎相关,小鼠模型研究证实这两种菌也可通过刺激IL-6-STAT3炎症级联反应引起口腔鳞状细胞癌(oral squamous cell cancer,OSCC)[21]。人群研究表明,OSCC患者口腔菌群与正常人不同,但对于与OSCC相关的唾液特定菌群丰度变化结论不一[22-29](表 1);美国病例对照研究表明OSCC患者口腔唾液中链球菌丰度升高[28],而我国病例对照研究发现OSCC患者口腔唾液中链球菌丰度降低[25],这可能源于种族间口腔菌群构成的差异。Schmidt等[26]发现OSCC患者口腔拭子中特定菌群的丰度变化趋势同时也存在于癌前病变患者中,提示口腔癌相关菌群的改变可能预示着癌变的发生。OSCC患者唾液中的牙龈二氧化碳嗜纤维菌、产黑色素普雷沃菌、缓症链球菌含量明显增加,将这3种细菌联合作为诊断标志物,敏感度和特异度可分别达到80%和83%[29]。除了唾液和脱落细胞,Pushalkar等[27]也发现肿瘤和非肿瘤组织微生物组成的差异明显,且肿瘤组织中主要为一些糖化菌和耐酸菌,如变形菌、梭杆菌、链球菌、普氏菌和韦荣球菌等,表明癌组织内一些特定菌群存在选择性生长现象。可见,研究证实多种口腔菌群与OSCC及其癌前病变相关,其具有作为诊断标志物的潜在作用,但还需进一步的机制研究及大规模人群研究证实。
2.口腔菌群与食管癌:食管癌病因复杂。既往高发现场以人群为基础的研究表明,牙齿脱落、口腔卫生不良可增加食管癌及其癌前病变的发病风险[38],口腔微生物菌群的改变可能破坏菌群与宿主免疫系统之间的动态平衡,导致机会致病菌促进食管癌的发生和发展。食管癌主要有鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)和腺状细胞癌(esophageal adenocarcinoma,EAC)两种病理类型。西方国家以EAC为主,而我国90%以上的食管癌是ESCC。目前关于口腔菌群与食管癌发病风险的关联性研究尚处于起步阶段[30-31](表 1),特定的口腔菌群与食管癌相关,其中值得关注的是牙龈卟啉单胞菌。口腔牙龈卟啉单胞菌感染者具有较高的ESCC患病风险,且其在ESCC组织中的存在也得到了证实[39-40],ESCC组织的抗体水平显著高于正常人[41]。此外,牙龈卟啉单胞菌感染与ESCC的分化程度、转移和生存率相关,提示牙龈卟啉单胞菌可作为ESCC诊断和治疗的生物标志物。对于EAC,研究表明牙周炎病原菌与EAC发病风险相关[30],宏基因组功能预测分析显示奈瑟菌与类胡萝卜素的菌群生物合成呈正相关。类胡萝卜素广泛存在于新鲜蔬菜和水果中,具有抗氧化的作用,可能与EAC风险降低相关。
3.口腔菌群与胃癌及贲门癌:幽门螺旋杆菌(Helicobacter pylori,HP)是胃癌(gastric cancer,GC)的主要致病因子,已被WHO国际癌症研究署列为Ⅰ类致癌因素。HP主要定植在胃部,但其在胃炎患者口腔牙菌斑、漱口液和舌黏膜中均可被检出,表明口腔可能是胃部HP的重要来源[42]。此外,一项纳入7项随机对照试验的研究表明,常规HP根除三联疗法联合牙周治疗可增加HP的根除率[43],降低复发率。由此推测,控制口腔HP的感染,对胃癌的早期预防和治疗可能具有一定效果。
研究表明,口腔卫生差,牙齿脱落[44]可能增加胃癌的发病风险。近年来,多项研究表明特定菌群丰度变化与胃癌发病风险升高相关(表 1)[32-36]。口腔舌苔菌群构成与舌苔外观相关,不同厚度舌苔的菌群多样性不同。唾液与舌部菌群的构成不同,胃癌患者唾液普氏菌相对丰度高于正常人,而弯曲杆菌含量较低;但在舌部菌群中,结论相反(表 1)。孙静华等[45]的研究表明,胃癌患者唾液和牙菌斑中某些菌群呈现异常聚集,包括红环菌目、梭菌目、肠杆菌目、假单胞菌目等,并基于胃癌患者口腔菌群特征,构建了用于胃癌筛查的评分系统,敏感度和特异度分别为97%和92.3%[33],这为通过口腔菌群检测而实现胃癌的早期筛查提供了一定的科学依据,但其推广和应用尚需大样本人群队列研究的验证。同时,该团队也对胃癌癌前病变患者的口腔菌群分布进行了探索,发现胃癌前病变患者口腔中龈下菌斑的细菌多样性高于对照组[46]。关于贲门癌患者的口腔菌群研究尚处于起步阶段,目前仅有研究表明贲门癌患者口腔唾液菌群多样性低于正常人,且普氏菌属及韦荣球菌丰度显著升高[37]。
三、总结上消化道肿瘤是我国主要的癌症疾病负担,目前我国食管癌和胃癌的早期筛查方法为内镜下碘染色辅以组织活检,该方法可显著降低上消化道肿瘤的发病率和死亡率。但鉴于其有创性、成本高且技术难度大,难以大范围推广实施。口腔标本便于采集和处理,且其在同一个体不同时间点出现的差异性显著低于肠道、皮肤等部位,具有个体相对稳定性。若能发掘口腔菌群与上消化道肿瘤之间的关联,可将口腔菌群作为上消化道肿瘤初筛的高可行性、非侵入性分子标志物,通过浓缩高危人群实现内镜筛查前的有效分流,有助于提高内镜筛查的成本-效益,有利于上消化道癌症早诊早治的大范围推广实施和普及。此外,针对特定口腔菌群的补充或根除治疗,调节机体免疫系统平衡,也可成为未来微生物治疗手段的突破点。
目前口腔菌群与上消化道肿瘤关联性研究处于起步阶段,尚缺乏大样本、前瞻性的队列研究,致使口腔菌群尚不足以作为标志物应用于早期筛查和临床诊断当中。应用包括流行病学、微生物学、基因组学、免疫学和分子生物学等多学科交叉手段探索口腔菌群在肿瘤发生发展中的作用及机制,同时开展多中心、大样本的前瞻性人群队列研究进一步探讨口腔菌群与肿瘤的关联,充分发挥口腔菌群在疾病预测、分型和治疗预后中的作用,是上消化道肿瘤预防控制领域的研究方向。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Paster BJ, Olsen I, Aas JA, et al. The breadth of bacterial diversity in the human periodontal pocket and other oral sites[J]. Periodontol 2000, 2006, 42(1): 80-87. DOI:10.1111/j.1600-0757.2006.00174.x |
| [2] |
Segata N, Haake SK, Mannon P, et al. Composition of the adult digestive tract bacterial microbiome based on seven mouth surfaces, tonsils, throat and stool samples[J]. Genome Biol, 2012, 13(6): R42. DOI:10.1186/gb-2012-13-6-r42 |
| [3] |
徐欣, 何金枝, 周学东. 口腔微生物群落在口腔与全身疾病预警中的作用[J]. 华西口腔医学杂志, 2015, 33(6): 555-560. Xu X, He JZ, Zhou XD. Oral microbiota:a promising predictor of human oral and systemic diseases[J]. West China J Stomatol, 2015, 33(6): 555-560. DOI:10.7518/hxkq.2015.06.001 |
| [4] |
李博磊, 程磊, 周学东, 等. 口腔微生物与消化系统疾病关系的研究进展[J]. 华西口腔医学杂志, 2018, 36(3): 331-335. Li BL, Cheng L, Zhou XD, et al. Research progress on the relationship between oral microbes and digestive system diseases[J]. West China J Stomatol, 2018, 36(3): 331-335. DOI:10.7518/hxkq.2018.03.019 |
| [5] |
孙可欣, 郑荣寿, 张思维, 等. 2015年中国分地区恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2019, 28(1): 1-11. Sun KX, Zheng RS, Zhang SW, et al. Report of cancer incidence and mortality in different areas of China, 2015[J]. China Cancer, 2019, 28(1): 1-11. DOI:10.11735/j.issn.1004-0242.2019.01.A001 |
| [6] |
Kumar PS. Sex and the subgingival microbiome:do female sex steroids affect periodontal bacteria?[J]. Periodontol 2000, 2013, 61(1): 103-124. DOI:10.1111/j.1600-0757.2011.00398.x |
| [7] |
张洋洋, 何金枝, 周学东, 等. 人颊黏膜微生物群落年龄相关性演替研究[J]. 华西口腔医学杂志, 2014, 32(2): 177-181. Zhang YY, He JZ, Zhou XD, et al. Human buccal mucosa microbiota succession across age[J]. West China J Stomatol, 2014, 32(2): 177-181. DOI:10.7518/hxkq.2014.02.016 |
| [8] |
Mason MR, Nagaraja HN, Camerlengo T, et al. Deep sequencing identifies ethnicity-specific bacterial signatures in the oral microbiome[J]. PLoS One, 2013, 8(10): e77287. DOI:10.1371/journal.pone.0077287 |
| [9] |
Li J, Quinque D, Horz HP, et al. Comparative analysis of the human saliva microbiome from different climate zones:Alaska, Germany, and Africa[J]. BMC Microbiol, 2014, 14: 316. DOI:10.1186/s12866-014-0316-1 |
| [10] |
Michaud DS, Izard J, Rubin Z, et al. Lifestyle, dietary factors, and antibody levels to oral bacteria in cancer-free participants of a European cohort study[J]. Cancer Causes Control, 2013, 24(11): 1901-1909. DOI:10.1007/s10552-013-0265-2 |
| [11] |
Kumar PS, Matthews CR, Joshi V, et al. Tobacco smoking affects bacterial acquisition and colonization in oral biofilms[J]. Infect Immun, 2011, 79(11): 4730-4738. DOI:10.1128/IAI.05371-11 |
| [12] |
Thomas AM, Gleber-Netto FO, Fernandes GR, et al. Alcohol and tobacco consumption affects bacterial richness in oral cavity mucosa biofilms[J]. BMC Microbiol, 2014, 14: 250. DOI:10.1186/s12866-014-0250-2 |
| [13] |
Haffajee AD, Socransky SS. Relation of body mass index, periodontitis and Tannerella forsythia[J]. J Clin Periodontol, 2009, 36(2): 89-99. DOI:10.1111/j.1600-051X.2008.01356.x |
| [14] |
Peters BA, McCullough ML, Purdue MP, et al. Association of coffee and tea intake with the oral microbiome:results from a large cross-sectional study[J]. Cancer Epidemiol Biomarkers Prev, 2018, 27(7): 814-821. DOI:10.1158/1055-9965.EPI-18-0184 |
| [15] |
熊雄, 易书瀚, 赵紫薇, 等. 基于高通量测序分析健康人咀嚼槟榔前后口腔菌群多样性[J]. 中国微生态学杂志, 2018, 30(4): 419-423. Xiong X, Yi SH, Zhao ZW, et al. Oral microbial diversity in healthy people before and after mastication of areca-nuts by high-throughput sequencing technique[J]. Chin J Microecol, 2018, 30(4): 419-423. DOI:10.13381/j.cnki.cjm.201804011 |
| [16] |
Casarin RC, Barbagallo A, Meulman T, et al. Subgingival biodiversity in subjects with uncontrolled type-2 diabetes and chronic periodontitis[J]. J Periodontal Res, 2013, 48(1): 30-36. DOI:10.1111/j.1600-0765.2012.01498.x |
| [17] |
Ohki T, Itabashi Y, Kohno T, et al. Detection of periodontal bacteria in thrombi of patients with acute myocardial infarction by polymerase chain reaction[J]. Am Heart J, 2012, 163(2): 164-167. DOI:10.1016/j.ahj.2011.10.012 |
| [18] |
Michaud DS, Izard J, Wilhelm-Benartzi CS, et al. Plasma antibodies to oral bacteria and risk of pancreatic cancer in a large European prospective cohort study[J]. Gut, 2013, 62(12): 1764-1770. DOI:10.1136/gutjnl-2012-303006 |
| [19] |
Flemer B, Warren RD, Barrett MP, et al. The oral microbiota in colorectal cancer is distinctive and predictive[J]. Gut, 2018, 67(8): 1454-1463. DOI:10.1136/gutjnl-2017-314814 |
| [20] |
Yan XM, Yang MX, Liu J, et al. Discovery and validation of potential bacterial biomarkers for lung cancer[J]. Am J Cancer Res, 2015, 5(10): 3111-3122. |
| [21] |
Gallimidi AB, Fischman S, Revach B, et al. Periodontal pathogens Porphyromonas gingivalis and Fusobacterium nucleatum promote tumor progression in an oral-specific chemical carcinogenesis model[J]. Oncotarget, 2015, 6(26): 22613-22623. DOI:10.18632/oncotarget.4209 |
| [22] |
Hsiao JR, Chang CC, Lee WT, et al. The interplay between oral microbiome, lifestyle factors and genetic polymorphisms in the risk of oral squamous cell carcinoma[J]. Carcinogenesis, 2018, 39(6): 778-787. DOI:10.1093/carcin/bgy053 |
| [23] |
Mok SF, Karuthan C, Cheah YK, et al. The oral microbiome community variations associated with normal, potentially malignant disorders and malignant lesions of the oral cavity[J]. Malays J Pathol, 2017, 39(1): 1-15. |
| [24] |
Lee WH, Chen HM, Yang SF, et al. Bacterial alterations in salivary microbiota and their association in oral cancer[J]. Sci Rep, 2017, 7: 16540. DOI:10.1038/s41598-017-16418-x |
| [25] |
Hu XS, Zhang Q, Hua H, et al. Changes in the salivary microbiota of oral leukoplakia and oral cancer[J]. Oral Oncol, 2016, 56: e6-8. DOI:10.1016/j.oraloncology.2016.03.007 |
| [26] |
Schmidt BL, Kuczynski J, Bhattacharya A, et al. Changes in abundance of oral microbiota associated with oral cancer[J]. PLoS One, 2014, 9(6): e98741. DOI:10.1371/journal.pone.0098741 |
| [27] |
Pushalkar S, Ji XJ, Li YH, et al. Comparison of oral microbiota in tumor and non-tumor tissues of patients with oral squamous cell carcinoma[J]. BMC Microbiol, 2012, 12: 144. DOI:10.1186/1471-2180-12-144 |
| [28] |
Pushalkar S, Mane SP, Ji XJ, et al. Microbial diversity in saliva of oral squamous cell carcinoma[J]. FEMS Immunol Med Microbiol, 2011, 61(3): 269-277. DOI:10.1111/j.1574-695X.2010.00773.x |
| [29] |
Mager DL, Haffajee AD, Devlin PM, et al. The salivary microbiota as a diagnostic indicator of oral cancer:a descriptive, non-randomized study of cancer-free and oral squamous cell carcinoma subjects[J]. J Trans Med, 2005, 3: 27. DOI:10.1186/1479-5876-3-27 |
| [30] |
Peters BA, Wu J, Pei ZH, et al. Oral microbiome composition reflects prospective risk for esophageal cancers[J]. Cancer Res, 2017, 77(23): 6777-6787. DOI:10.1158/0008-5472.CAN-17-1296 |
| [31] |
Chen XD, Winckler B, Lu M, et al. Oral microbiota and risk for esophageal squamous cell carcinoma in a high-risk area of China[J]. PLoS One, 2015, 10(12): e0143603. DOI:10.1371/journal.pone.0143603 |
| [32] |
Xu J, Xiang CJ, Zhang C, et al. Microbial biomarkers of common tongue coatings in patients with gastric cancer[J]. Microb Pathogen, 2019, 127: 97-105. DOI:10.1016/j.micpath.2018.11.051 |
| [33] |
Sun JH, Li XL, Yin J, et al. A screening method for gastric cancer by oral microbiome detection[J]. Oncol Rep, 2018, 39(5): 2217-2224. DOI:10.3892/or.2018.6286 |
| [34] |
Wu J, Xu S, Xiang CJ, et al. Tongue coating microbiota community and risk effect on gastric cancer[J]. J Cancer, 2018, 9(21): 4039-4048. DOI:10.7150/jca.25280 |
| [35] |
Cui JX, Cui HF, Yang MR, et al. Tongue coating microbiome as a potential biomarker for gastritis including precancerous cascade[J]. Protein Cell, 2019, 10(7): 496-509. DOI:10.1007/s13238-018-0596-6 |
| [36] |
Hu J, Han SW, Chen Y, et al. Variations of tongue coating microbiota in patients with gastric cancer[J]. BioMed Res Int, 2015, 2015: 173729. DOI:10.1155/2015/173729 |
| [37] |
柳安琪, 邵丹彤, 苏征, 等. 贲门癌患者口腔菌群的分布特征[J]. 基础医学与临床, 2019, 39(5): 710-713. Liu AQ, Shao DT, Su Z, et al. Distribution of oral microbiota in patients with gastric cardia cancer[J]. Basic Clin Med, 2019, 39(5): 710-713. DOI:10.3969/j.issn.1001-6325.2019.05.019 |
| [38] |
Wei WQ, Abnet CC, Lu N, et al. Risk factors for oesophageal squamous dysplasia in adult inhabitants of a high risk region of China[J]. Gut, 2005, 54(6): 759-763. DOI:10.1136/gut.2004.062331 |
| [39] |
Gao SG, Li SG, Ma ZK, et al. Presence of Porphyromonas gingivalis in esophagus and its association with the clinicopathological characteristics and survival in patients with esophageal cancer[J]. Infect Agents Cancer, 2016, 11: 3. DOI:10.1186/s13027-016-0049-x |
| [40] |
Yuan X, Liu YW, Kong JY, et al. Different frequencies of Porphyromonas gingivalis infection in cancers of the upper digestive tract[J]. Cancer Lett, 2017, 404: 1-7. DOI:10.1016/j.canlet.2017.07.003 |
| [41] |
Gao SG, Yang JQ, Ma ZK, et al. Preoperative serum immunoglobulin G and A antibodies to Porphyromonas gingivalis are potential serum biomarkers for the diagnosis and prognosis of esophageal squamous cell carcinoma[J]. BMC Cancer, 2018, 18: 17. DOI:10.1186/s12885-017-3905-1 |
| [42] |
Gao J, Li Y, Wang QC, et al. Correlation between distribution of Helicobacter pylori in oral cavity and chronic stomach conditions[J]. J Huazhong Univ Sci Technol:Med Sci, 2011, 31(3): 409-412. DOI:10.1007/s11596-011-0391-6 |
| [43] |
Ren Q, Yan X, Zhou YN, et al. Periodontal therapy as adjunctive treatment for gastric Helicobacter pylori infection[J]. Cochrane Database Syst Rev, 2016, 2: CD009477. DOI:10.1002/14651858.CD009477.pub2 |
| [44] |
Abnet CC, Kamangar F, Dawsey SM, et al. Tooth loss is associated with increased risk of gastric non-cardia adenocarcinoma in a cohort of Finnish smokers[J]. Scand J Gastroenterol, 2005, 40(6): 681-687. DOI:10.1080/00365520510015430 |
| [45] |
孙静华, 尹杰, 李小林, 等. 胃癌患者口腔菌群的分布特征[J]. 北京口腔医学, 2018, 26(1): 5-10. Sun JH, Yin J, Li XL, et al. Characteristics of oral microbiome in gastric cancer patients[J]. Beijing J Stomatol, 2018, 26(1): 5-10. |
| [46] |
孙静华, 陈玉, 李仪红, 等. 胃癌前病变患者口腔细菌多样性分析[J]. 北京口腔医学, 2014, 22(2): 70-74. Sun JH, Chen Y, Li YH, et al. Oral microbial diversity in individuals with gastric precancerous lesions[J]. Beijing J Stomatol, 2014, 22(2): 70-74. |
 2020, Vol. 41
2020, Vol. 41