文章信息
- 张朱佳子, 索罗丹, 赵丹, 潘静彬, 卢莉.
- Zhang Zhujiazi, Suo Luodan, Zhao Dan, Pan Jingbin, Lu Li
- 中国1~12岁健康儿童接种1剂水痘减毒活疫苗保护效果的系统评价与证据质量分析
- Systematic reviews and evidence quality assessment on effectiveness of 1 dose varicella attenuated live vaccine for healthy children aged 1-12 years in China
- 中华流行病学杂志, 2020, 41(7): 1138-1144
- Chinese Journal of Epidemiology, 2020, 41(7): 1138-1144
- http://dx.doi.org/10.3760/cma.j.cn112338-20191025-00762
-
文章历史
收稿日期: 2019-10-25
水痘是由水痘带状疱疹病毒引起的儿童常见急性呼吸道传染病,以全身性、瘙痒性水泡疹为特征[1]。1997年进口水痘疫苗引入中国,2000年国产疫苗研制成功并上市[2]。目前,市面上水痘疫苗品牌和生产厂家较多,但毒株均为OKa株且病毒滴度接近,国内大部分省市将其作为非免疫规划疫苗提供适龄儿童自主选择接种,没有统一的接种程序和免疫策略,接种医生多按照疫苗说明书为1~2岁幼儿接种1剂次。虽然水痘疫情在一定程度上得到了控制,但暴发疫情仍频繁发生,甚至是发生在疫苗接种率接近100%的学校和托幼机构[3-6]。为了解水痘流行特征及疫苗保护效果(vaccine effectiveness,VE)大量研究相继开展,这些研究多基于小规模人群及局部地区的观察性研究,研究设计和方法质量、研究结果也不尽相同。因此,有必要汇总相关研究,进行系统评价,得到更准确、客观的1剂水痘减毒活疫苗的VE,从而为制定水痘疫苗免疫策略提供科学依据。
GRADE(Grades of Recommendation,Assessment,Development,and Evaluation)证据质量评级方法是GRADE工作组在2004年推出的国际统一的证据分级和推荐意见标准[7],目前已被WHO和Cochrane协作网等28个国际组织和协会采纳。但在实际研究中该方法多用于随机对照临床试验研究的证据分级,较少用于观察性研究。本研究将GRADE证据质量评级方法运用于疫苗效果评价的观察性研究,旨在为该方法的应用提供新的思路和借鉴。
资料与方法1.文献检索:通过专家讨论,构建研究问题(PICO),确定文献纳入标准:①研究设计:水痘减毒活疫苗VE的观察性研究;②研究对象(population):1~12岁中国儿童;③干预措施(intervention):接种1剂水痘减毒活疫苗;④对照措施(comparator):未接种水痘减毒活疫苗;⑤研究结果(outcome):水痘发病。文献排除标准:①研究对象非中国大陆人群;②研究对象年龄>12岁或为中学生、大中专技校生等;③研究结果中无疫苗效果分析且不能提取相关数据;④综述、指南、意见、评述类文献;⑤无法获得全文的文献;⑥重复收录文献保留最新或信息最全的一篇。
2.检索策略:计算机检索中国全文期刊数据库(CNKI)、万方数据库、中国生物医学文献服务系统(Sinomed)、PubMed、Embase、Cochrane。中文数据库以“水痘疫苗”“保护效果”“保护率”“保护效力”“免疫效果”“免疫效力”“保护力”“有效”等为主题词或关键词检索,英文数据库增加“Chinese”或“China”进行限定,检索2019年之前的文献。追索相关综述的参考文献,以获取更多发表或未发表的相关研究。
3.文献筛选、数据提取与质量评价:由2名研究者独立进行文献筛选、数据提取与质量评价,如有分歧通过与第3位研究者讨论做出判断。经过题目摘要初筛和全文筛选,确定纳入文献,提取关键信息,包括作者、研究开展时间、研究设计(未写明研究设计的文献根据文献的数据分析方法判定)、研究对象基本信息、是否为暴发疫情、是否有企业赞助、原始数据等。采用纽卡斯尔-渥太华量表(NOS)评价纳入文献的方法学质量[8-9],该量表包括3个部分8个条目,最多可得9分,其中研究人群选择4分,可比性2分,暴露评价或结局评价3分,由2名研究者独立提取文献中涉及每个条目的信息,并进行判定和评分,如有分歧通过与第3位研究者讨论。
4.统计学分析:采用RevMan 5.3软件进行Meta分析。病例对照研究采用OR值(95%CI)描述相对效应,队列研究采用RR值(95%CI)描述,合并后采用OR值(95%CI)描述。采用I2反映研究间异质性,I2越大表明纳入文献间异质性越大,当I2<40%为低,30%~60%为中等,50%~90%为明显,75%~100%为很大,如果I2<50%选择固定效应模型进行Meta分析,如果I2≥50%选择随机效应模型进行Meta分析[10-11]。采用漏斗图评价纳入文献是否存在发表偏倚,采用森林图表示Meta分析结果。VE=(1-OR或RR)×100%。
5.整合证据质量评价:采用GRADE pro 3.5软件进行基于GRADE评级系统的证据质量评级,由2位研究者独立完成,如遇分歧通过与第3位研究者讨论达成一致。证据质量级别定义为高、中、低和极低4个级别,表示对结果真实性的把握程度。随机对照试验的证据起始质量为高,观察性研究的证据起始质量为低,降级因素包括偏倚风险、不一致性、间接性、不精确性以及发表偏倚5个因素,升级因素包括效应值很大、剂量-效应关系、负偏倚[12]。
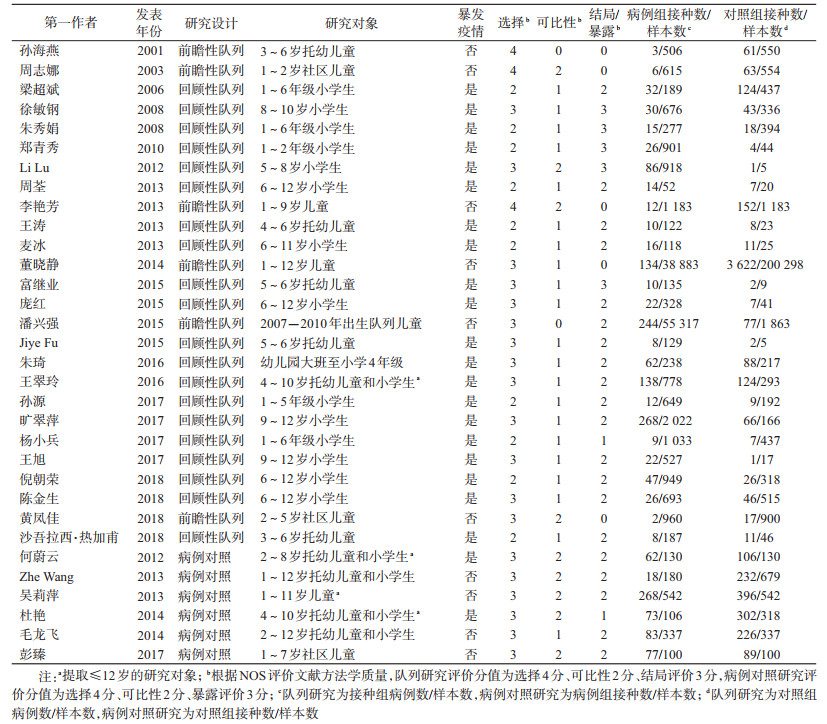
结果1.文献检索结果:检出文献1 341篇,包括中文文献1 159篇,英文文献182篇,剔除重复文献438篇,阅读文题及摘要排除系统综述、非研究主题、非研究人群等文献812篇,阅读原文排除不符合纳入标准、研究方法错误、数据提取困难等文献64篇,最终纳入32篇文献。10篇文献未写明研究对象的水痘疫苗接种剂次,但鉴于2剂次水痘程序是2012年以后在各省陆续提出[13],该10篇文献研究时间均在2012年以前,可以认为研究对象均执行1剂次接种程序,因此纳入本研究。文献筛选流程及结果见图 1。

|
| 图 1 文献筛选流程及结果 |
2.纳入文献基本特征:32篇文献发表时间为2001-2018年,其中29篇发表于中文期刊,3篇发表于英文期刊。队列研究26篇,其中20篇是基于暴发调查的回顾性队列研究设计,6篇是前瞻性队列研究设计;病例对照研究6篇,均对研究对象进行了匹配。4篇文献研究人群年龄>12岁,提取其中≤12岁人群数据进行分析(表 1)。
3.文献质量评价:全部文献NOS质量评价得分在4~8分之间,其中≥5分20篇,<5分12篇(表 1)。队列研究不得分主要原因为23篇研究对象代表性差,10篇暴露组可能存在选择偏倚,22篇两组研究对象的可比性不能确定,27篇研究结局定义不清。病例对照研究不得分主要原因为6篇病例组可能存在选择偏倚,6篇可能存在信息偏倚。
4.水痘减毒活疫苗保护效果评价:
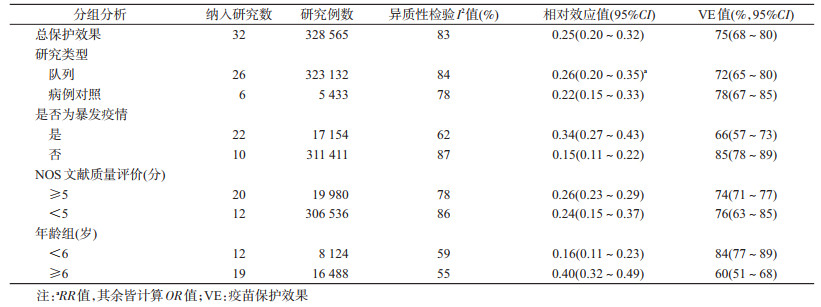
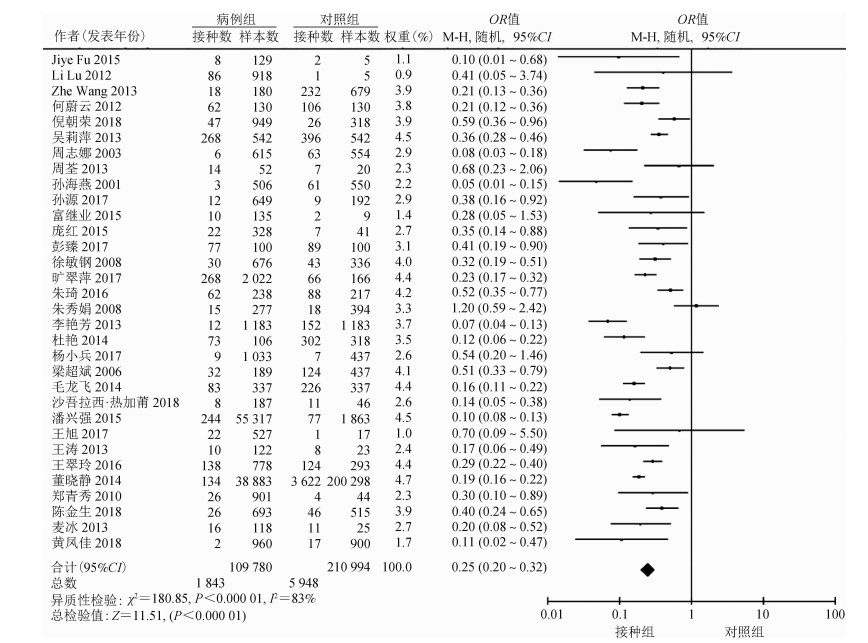
(1)水痘减毒活疫苗总保护效果分析:对32篇文献的水痘减毒活疫苗VE进行Meta分析显示,纳入研究结果间存在很大的异质性(I2=83%),遂采用随机效应模型,整合后OR值为0.25(95%CI:0.20~0.32),VE为75%(95%CI:68%~80%)(图 2)。漏斗图基本呈现对称分布,发表偏倚较小(图 3)。通过逐篇排除文献进行敏感性分析,结果显示I2在80%~85%之间、OR值在0.25~0.27之间变化,Meta分析结果稳定。
|
| 图 2 水痘减毒活疫苗保护效果Meta分析的森林图 |

|
| 图 3 水痘减毒活疫苗保护效果Meta分析的漏斗图 |
(2)水痘减毒活疫苗保护效果亚组分析:各亚组纳入文献间均存在明显或很大的异质性,均采用随机效应模型进行Meta分析。暴发疫情VE为66%(95%CI:57%~73%),低于非暴发疫情[85%(95%CI:78%~89%)],<6岁儿童VE为84%(95%CI:77%~89%),高于≥6岁儿童60%(95%CI:51%~68%)。病例对照研究[78%(95%CI:67%~85%)]与队列研究[72%(95%CI:65%~80%)]、NOS文献质量评价≥5分[74%(95%CI:71%~77%)]与<5分[76%(95%CI:63%~85%)]VE的可信区间重叠,差异无统计学意义(表 2)。
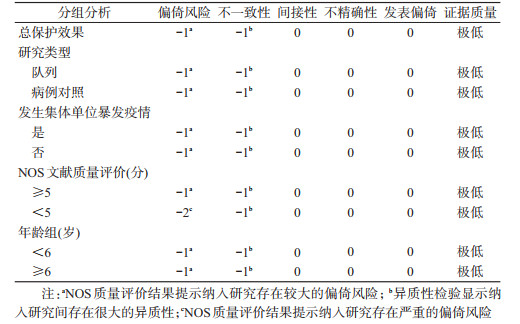
5.采用GRADE方法对整合证据评级:本次证据评价的结局指标为水痘发病,结局指标的重要程度为关键(8分),纳入研究均为观察性研究,证据起始质量为低。证据评价结果显示系统评价整合证据质量级别为“极低”,其中偏倚风险降一级,NOS质量评价结果提示纳入研究可能存在选择偏倚和信息偏倚的风险;不一致性降一级,异质性检验结果显示纳入研究间存在很大的异质性;间接性不降级,纳入研究的PICO与本次系统评价构建的PICO一致,不存在间接性问题;不精确性不降级,纳入研究总样本量较大,可信区间适度,未跨越无效线,精确性较好;发表偏倚不降级,纳入研究均无企业赞助或明显的利益关系,漏斗图呈对称分布,未见明显发表偏倚;整合证据已在两个标准上进行降级,且偏倚风险较高,因此不再对证据进行升级(表 3)。分亚组证据评价结果显示,整合证据质量级别均为“极低”,其中NOS质量评价<5分的研究存在偏倚的风险较高,考虑偏倚风险降两级(表 3)。
1.系统评价主要结论:本次系统评价纳入国内外发表文献32篇,研究对象33万例,运用GRADE系统评价中国儿童1剂水痘疫苗的VE。系统评价结果显示,1剂水痘减毒活疫苗对1~12岁中国健康儿童的VE为75%(68%~80%),结果与国外(80%~81%)、国内(73%~75%)相关研究接近[14-16]。与其他疫苗相比较,1剂水痘疫苗的VE高于流感疫苗(不同型别流感疫苗VE在33%~73%之间)[17]、轮状病毒疫苗(2剂VE为63%~72%)[18],低于麻疹减毒活疫苗(1剂VE为90%~95%)[19]、麻风腮减毒活疫苗(麻疹成分VE为92%[20]、风疹成分VE为89%[21]),属于中等水平保护。
亚组分析结果显示,在暴发疫情中VE相较于非暴发疫情呈现一定程度的降低,其主要原因是病毒的传播力以及研究对象的暴露等级在聚集性疫情中趋于更强,从而导致VE下降[22]。另外,疫苗失败或保护效果较差的疫情更容易受到研究者的关注而发表[23],造成结果的低估。年龄分层分析结果显示≥6岁儿童1剂水痘疫苗的VE明显低于<6岁儿童,该结果与我国水痘发病率调查结果显示的5~9岁为儿童水痘的发病高峰相吻合[24],可能原因为1剂水痘疫苗的VE会随接种时间的延长而降低,特别是在接种后10年内下降明显[25-26]。美国在接种单剂疫苗后,发现在接种率较高的学生中仍持续发生水痘暴发,2006年开始推荐对4~6岁儿童接种第2剂水痘疫苗[27]。北京市也在2013年推出北京市水痘疫苗使用技术指南,增加满4岁接种第2剂水痘疫苗[13]。因此,建议制定全国统一的2剂水痘疫苗接种程序,第2剂应考虑在6岁前完成。
2.证据质量评价:本次系统评价的GRADE分级结果显示证据质量为极低,提示系统评价的估计值可能与真实值相差较大。其原因为:①观察性研究的证据起始质量为低。研究纳入的文献均为观察性研究,而大多数观察性研究,即使实施较好,也只能提供低质量的证据[28]。②研究的偏倚风险严重。NOS量表评价结果显示多数文献的方法学存在缺陷,即使是评价结果相对较好的文献也仅在5~6分之间。主要表现在缺少水痘病例的诊断依据及统一的病例定义、未明确剔除既往有水痘患病史的研究对象,而信息收集后又未比较两组间的均衡性,最终导致潜在的偏倚。③研究的异质性大。多数研究为基于一次暴发疫情开展的,无论是研究现场还是研究对象的代表性均一般,存在一定的随机性。此外,研究间方法的差异也是导致本次研究结果间异质性大的原因之一。
极低的证据质量导致我们对中国儿童1剂水痘疫苗的VE的系统评价结果信心不足,如需得到更可靠的结论尚需补充更多高质量证据。研究中发现部分文献质量降级并非是在研究方法等方面存在真实缺陷,而是在撰写中存在表述模糊或信息遗漏,导致对应条目不能得分,这与我国缺少统一观察性研究撰写规范有关。因此,建议制定观察性研究技术指南,内容包括研究设计、数据分析、论文撰写等技术要点,指导研究者在研究中避免上述问题,提高证据质量,从而提高我国证据体的整体质量。虽然在GRADE证据体系中观察性研究仅能提供低质量证据,但如果是高质量的证据体同时存在很大的效应值或剂量-效应关系,也可通过证据升级提高质量分级[29]。
本研究存在不足。一是大部分纳入文献未开展疫苗效果的分层分析,因而不能提取足够原始数据,无法对疫苗品牌、疾病严重程度、疫苗接种时间、疫苗衰减等因素分析,特别是国内大部分地区水痘疫苗未纳入常规免疫或应急接种,起始免疫时间、接种程序、接种用途等均存在差异;二是GRADE方法评价证据质量对研究者相关专业领域的知识储备要求较高,且不可避免带入研究者的主观判断[30],但基于评价过程的透明化及可重复性,本研究通过多名研究者平行评价较好地减少了主观因素。
综上所述,中国1~12岁健康儿童1剂水痘减毒活疫苗可提供中等水平保护,但≥6岁儿童VE明显降低,建议对<6岁儿童开展2剂水痘疫苗接种。GRADE证据质量评级方法可用于疫苗效果的观察性研究,建议制定观察性研究技术指南,提高我国证据体的整体质量。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Arvin AM. Varicella-zoster virus[J]. Clin Microbiol Rev, 1996, 6(2): 361-381. DOI:10.1136/adc.85.2.175a |
| [2] |
许青, 徐爱强. 我国水痘流行病学分析与水痘疫苗免疫预防研究进展[J]. 中国新药杂志, 2012, 21(10): 1093-1098. Xu Q, Xu AQ. Epidemiological analysis of varicella in China and advance in immunity prevention for varicella vaccine[J]. Chin J New Drugs, 2012, 21(10): 1093-1098. |
| [3] |
索罗丹, 卢莉, 吴疆, 等. 疫苗接种对北京市托幼园所和中小学校水痘流行特征的影响[J]. 中华预防医学杂志, 2012, 46(1): 46-49. Suo LD, Lu L, Wu J, et al. The epidemiological impact of varicella vaccination in kindergartens, primary and secondary schools in Beijing[J]. Chin J Prev Med, 2012, 46(1): 46-49. DOI:10.3760/cma.j.issn.0253-9624.2012.01.012 |
| [4] |
邵晓丹, 蒋丽丽, 彭臻, 等.上海市普陀区2008-2012年水痘突发病例流行病学分析[J].中国学校卫生, 2015, 36(6): 890-893. DOI: CNKI:SUN:XIWS.0.2015-06-032. Shao XD, Jiang LL, Peng Z, et al. Epidemiological study on breakthrough cases in varicella outbreak during 2008-2012 in Putuo District of Shanghai[J]. Chin J School Health, 2015, 36(6): 890-893. DOI: CNKI:SUN:XIWS.0.2015-06-032. |
| [5] |
李媛, 孔东锋, 唐秀娟, 等. 广东省深圳市2013-2017年水痘疫情流行特征及免疫接种情况分析[J]. 医学动物防制, 2019, 35(5): 34-37. Li Y, Kong DF, Tang XJ, et al. Analysis on epidemiological characteristics and vaccination of varicella in Shenzhen of Guangdong Province from 2013 to 2017[J]. J Med Pest Contrl, 2019, 35(5): 34-37. DOI:10.7629/yxdwfz201905008 |
| [6] |
Li L, Suo LD, Li J, et al. A varicella outbreak in a school with high one-dose vaccination coverage, Beijing, China[J]. Vaccine, 2012, 30(34): 5094-5098. DOI:10.1016/j.vaccine.2012.05.072 |
| [7] |
Atkins D, Best D, Briss PA, et al. Grading quality of evidence and strength of recommendations[J]. BMJ, 2004, 328(7454): 1490-1494. DOI:10.1136/bmj.328.7454.1490 |
| [8] |
Stang A. Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in Meta-analyses[J]. Eur J Epidemiol, 2010, 25(9): 603-605. DOI:10.1007/s10654-010-9491-z |
| [9] |
Wells GA, Shea B, O'Connell D, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in Meta-analyses[EB/OL].[2012-06-15]. http://www.ohri.ca/programs/clinical_epidemiology/oxford.htm.
|
| [10] |
Deeks JJ, Higgins JPT, Altman DG. Analysing data and undertaking Meta-analyses[M]//Higgins JPT, Green S. Cochrane handbook for systematic reviews of interventions: cochrane book series. Chicester: Wiley-Blackwell, 2008. DOI: 10.1002/9780470712184.ch9.
|
| [11] |
王丹, 翟俊霞, 牟振云, 等. Meta分析中的异质性及其处理方法[J]. 中国循证医学杂志, 2009, 9(10): 1115-1118. Wang D, Zhai JX, Mou ZY, et al. Discussing on the research of heterogeneity in Meta-analysis[J]. Chin J Evid Based Med, 2009, 9(10): 1115-1118. DOI:10.3969/j.issn.1672-2531.2009.10.013 |
| [12] |
Balshem H, Helfand M, Schünemann HJ, et al. GRADE guidelines:3. Rating the quality of evidence[J]. J Clin Epidemiol, 2011, 64(4): 401-406. DOI:10.1016/j.jclinepi.2010.07.015 |
| [13] |
北京市疾病预防控制中心. 北京市水痘疫苗使用技术指南[J]. 中华预防医学杂志, 2013, 47(1): 67-69. Beijing Center for Diseases Prevention and Control. Beijing varicella vaccination technical guidelines[J]. Chin J Prev Med, 2013, 47(1): 67-69. DOI:10.3760/cma.j.issn.0253-9624.2013.01.016 |
| [14] |
Marin M, Marti M, Kambhampati A, et al. Global varicella vaccine effectiveness:a Meta-analysis[J]. Pediatrics, 2016, 137(3): e20153741. DOI:10.1542/peds.2015-3741 |
| [15] |
朱一, 竹军伟, 曹银兰, 等. 中国儿童水痘减毒活疫苗保护效果Meta分析[J]. 中国预防医学杂志, 2017, 18(8): 587-592. Zhu Y, Zhu JW, Cao YL, et al. Protective efficacy of varicella attenuated live vaccine for children in China:a Meta-analysis[J]. Chin Prev Med, 2017, 18(8): 587-592. DOI:10.16506/j.1009-6639.2017.08.008 |
| [16] |
胡宏, 曹文群, 沈天寒, 等. 水痘疫苗在聚集性疫情中保护效果的Meta分析[J]. 中国疫苗和免疫, 2017, 23(3): 331-336. Hu H, Cao WQ, Shen TH, et al. Meta-analysis of the effectiveness of varicella vaccine in outbreaks[J]. Chin J Vacc Immun, 2017, 23(3): 331-336. |
| [17] |
Belongia EA, Simpson MD, King JP, et al. Variable influenza vaccine effectiveness by subtype:a systematic review and Meta-analysis of test-negative design studies[J]. Lancet Infect Dis, 2016, 16(8): 942-951. DOI:10.1016/S1473-3099(16)00129-8 |
| [18] |
de Oliveira LH, Camacho LAB, Coutinho ESF, et al. Rotavirus vaccine effectiveness in Latin American and Caribbean countries:A systematic review and Meta-analysis[J]. Vaccine, 2015, 33 Suppl 1: A248-254. DOI:10.1016/j.vaccine.2014.11.060 |
| [19] |
King GE, Markowitz LE, Patriarca PA, et al. Clinical efficacy of measles vaccine during the 1990 measles epidemic[J]. Pediat Infect Dis J, 1991, 10(12): 883-888. DOI:10.1097/00006454-199112000-00001 |
| [20] |
Marin M, Nguyen HQ, Langidrik JR, et al. Measles transmission and vaccine effectiveness during a large outbreak on a densely populated island:implications for vaccination policy[J]. Clin Infect Dis, 2006, 42(3): 315-319. DOI:10.1086/498902 |
| [21] |
Chang CY, Mo XH, Hu P, et al. Effectiveness of Rubella vaccine in a rubella outbreak in Guangzhou city, China, 2014[J]. Vaccine, 2015, 33(28): 3223-3227. DOI:10.1016/j.vaccine.2015.04.083 |
| [22] |
吴莉萍, 刘钢, 张宏, 等. 免疫后时间及流行强度对1剂次水痘疫苗效力的影响[J]. 中国生物制品学杂志, 2013, 26(9): 109-113. Wu LP, Liu G, Zhang H, et al. Effect of time after vaccination and varicella attack rate on effectiveness of a single dose of varicella vaccine[J]. Chin J Biol, 2013, 26(9): 109-113. DOI:10.13200/j.cnki.cjb.000144 |
| [23] |
Bayer O, Heininger U, Heiligensetzer C, et al. Metaanalysis of vaccine effectiveness in varicella outbreaks[J]. Vaccine, 2007, 25(37/38): 6655-6660. DOI:10.1016/j.vaccine.2007.07.010 |
| [24] |
刘桂芳, 宋立志, 冯蕾, 等. 山东省2007年≤ 14岁儿童水痘发病率抽样调查[J]. 中国疫苗和免疫, 2010, 16(3): 225-228. Liu GF, Song LZ, Feng L, et al. Investigation on varicella incidence of the children ≤ 14 years old in Shandong province in 2007[J]. Chin J Vacc Immun, 2010, 16(3): 225-228. |
| [25] |
Vázquez M, LaRussa PS, Gershon AA, et al. Effectiveness over time of varicella vaccine[J]. JAMA, 2004, 291(7): 851-855. DOI:10.1001/jama.291.7.851 |
| [26] |
Thomas CA, Shwe T, Bixler D, et al. Two-dose varicella vaccine effectiveness and rash severity in outbreaks of varicella among public school students[J]. Pediatr Infect Dis J, 2014, 33(11): 1164-1168. DOI:10.1097/INF.0000000000000444 |
| [27] |
Marin M, Güris D, Chaves SS, et al. Prevention of varicella:recommendations of the Advisory Committee on Immunization Practices (ACIP)[J]. MMWR Recomm Rep, 2007, 56(RR-4): 1-40. |
| [28] |
Guyatt GH, Oxman AD, Sultan S, et al. GRADE guidelines:9. Rating up the quality of evidence[J]. J Clin Epidemiol, 2011, 64(12): 1311-1316. DOI:10.1016/j.jclinepi.2011.06.004 |
| [29] |
Guyatt GH, Oxman AD, Vist G, et al. GRADE guidelines:4. Rating the quality of evidence-study limitations (risk of bias)[J]. J Clin Epidemiol, 2011, 64(4): 407-415. DOI:10.1016/j.jclinepi.2010.07.017 |
| [30] |
Guyatt GH, Oxman AD, Sultan S, 等. GRADE指南: Ⅸ.证据质量升级[J].李玲, 译.中国循证医学杂志, 2011, 11(12): 1459-1463. DOI: 10.3969/j.issn.1672-2531.2011.12.019. Guyatt GH, Oxman AD, Sultan S, et al. GRADE guidelines: 9. rating up the quality of evidence[J]. Li L, trans. Chin J Evid Based Med, 2011, 11(12): 1459-1463. DOI: 10.3969/j.issn.1672-2531.2011.12.019. |
 2020, Vol. 41
2020, Vol. 41