文章信息
- 李晶, 杜玉娇, 王红丽, 杜姣洋, 屈鹏飞, 张若, 郭乐倩, 颜虹, 党少农.
- Li Jing, Du Yujiao, Wang Hongli, Du Jiaoyang, Qu Pengfei, Zhang Ruo, Guo Leqian, Yan Hong, Dang Shaonong
- 母亲围孕期被动吸烟与子代先天性心脏病关系的病例对照研究
- Association between maternal passive smoking during perinatal period and congenital heart disease in their offspring-based on a case-control study
- 中华流行病学杂志, 2020, 41(6): 884-889
- Chinese Journal of Epidemiology, 2020, 41(6): 884-889
- http://dx.doi.org/10.3760/cma.j.cn112338-20190710-00509
-
文章历史
收稿日期: 2019-07-10
2. 西安交通大学附属西北妇女儿童医院辅助生殖中心 710003
2. Assisted Reproduction Center, Northwest Women's and Children's Hospital, Xi'an Jiaotong University, Xi'an 710003, China
据统计,全球范围内不同地区,每1 000个活产新生儿中约有4~13例患有先天性心脏病(congenital heart disease,CHD)[1-2]。CHD是先天异常(出生缺陷)的最常见原因,约占28%[1];也是出生缺陷致死的最主要原因[3]。我国出生缺陷防治报告显示,2000-2011年我国CHD的发生率呈上升趋势,2011年其发病率为2000年的3.56倍,占所有监测出生缺陷病例的26.7%;此外,我国每年预计新增CHD超过13万例,新发CHD生命周期的总经济负担超过126亿元[4]。CHD的发病机制尚未阐明,可能与染色体异常、基因突变以及环境暴露因素有关。流行病学研究发现,围孕期母亲的烟草暴露可能导致不良妊娠结局[5-6],包括早产、低出生体重和出生缺陷等。相比于欧美地区,我国女性的主动吸烟率较低:据WHO报告,2016年欧洲地区>15岁女性吸烟率(年龄标准化后)高达20.7%,美洲地区为12.4%,而我国仅为1.9%[7]。但是,我国女性居民被动吸烟率却高达46.88%[8],可见我国女性主要是被动吸烟的受害者。本研究基于陕西省CHD的病例对照研究数据,探索母亲围孕期被动吸烟情况对子代患CHD的影响,为CHD的预防与控制提供科学依据。
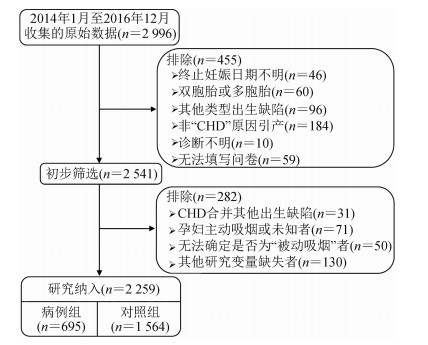
资料与方法1.资料来源:来源于2014年1月至2016年12月在陕西省开展的CHD相关危险因素的病例对照研究。研究现场选择在西安市6家三级甲等医院:西安交通大学第一附属医院、西京医院、陕西省人民医院、西安交通大学附属西北妇女儿童医院、西安交通大学第二附属医院和唐都医院,其中前4家医院是国家出生缺陷监测医院。病例组纳入标准:妊娠满28周至出生后7 d,按《国际疾病分类第十次修订本》(ICD-10)标准确诊为先心病的围产儿(包括活产儿和死胎),以及医院内妊娠<28周但经超声等检查确诊为先心病的胎儿;排除被诊断或合并其他类型出生缺陷的围产儿或胎儿。对照组为未发生出生缺陷的同时期新生儿。本研究在进行分析时,排除孕妇终止妊娠日期不明者;双胞胎或多胞胎者;诊断未明者;研究相关数据缺失者。由于本研究的主要研究变量为孕妇被动吸烟,故在分析时排除孕妇主动吸烟者。
根据相关研究,按孕妇围孕期被动吸烟率为7.8%[9]、OR=3.66[10-11]进行本研究的样本量估算,在α=0.05的检验水准和90%的把握度下所需病例和对照至少各110例,而本研究最终纳入2 259例对象,病例组695例,对照组1 564例,该样本量完全满足本研究的需要。
2.调查内容和质量控制:调查采用自行设计的结构化问卷,由调查员对母亲进行面对面调查收集其相关信息,并根据各医院病历系统填写相应新生儿或胎儿信息。问卷内容包括社会人口学特征、母亲围孕期生活行为及环境暴露、既往生育史及家族疾病史、围孕期健康状况、围孕期患病及用药情况、围孕期营养素补充剂服用情况等。所有调查员均由西安交通大学医学部公共卫生学院的研究生担任,且在项目开始前经过了统一培训,熟知调查内容和注意事项,掌握问卷询问技能和信息采集方法。调查前告知调查对象研究内容并签署知情同意书;调查过程中保持客观科学的态度,按问卷内容逐项询问并准确填写;调查完后及时检查问卷,确认无误后统一收回,并采用双录入的方法进行数据录入。
3.研究指标:①CHD是指胚胎发育时期心脏及大血管形成障碍或发育异常而引起的解剖结构异常。本研究中CHD的诊断严格按照ICD-10分类标准,参考《出生缺陷诊断图谱》,由相关医生根据症状、体征及辅助检查综合分析完成。CHD的类型包括室间隔缺损、房间隔缺损、房室间隔缺损、法洛四联症、肺动脉狭窄、主动脉缩窄、动脉导管未闭等。②WHO将被动吸烟定义为不吸烟者每周至少有1 d吸入吸烟者呼出的烟雾超过15 min,我国关于吸烟与被动吸烟现状的全国性流行病学调查也采用此定义[12]。本研究中的围孕期被动吸烟定义为怀孕前3个月至怀孕期间,不吸烟的孕妇有上述被动吸烟情况;被动吸烟者按频率进一步分为1~3 d/周和>3 d/周。
4.混杂变量:参考既往文献[13-15],一些重要的围孕期社会环境因素可能影响CHD的发生,本研究共纳入母亲年龄、母亲户籍、母亲文化程度、父亲文化程度、生育史、流产史、CHD家族史、产前检查异常、围孕期感染、围孕期叶酸服用、围孕期有害物质接触和围孕期不良环境暴露12个混杂变量,在分析围孕期被动吸烟与子代CHD的关系时进行控制。其中,孕妇流产史包括自然流产、药物流产和人工流产;CHD家族史指父母双方两代直系亲属中发生过CHD;产前检查异常指产前经B超或胎儿心动超声检查发现有异常情况者;围孕期感染指孕前3个月至怀孕期间发生感冒、发烧、泌尿或生殖系统感染以及其他病毒感染;围孕期叶酸服用指孕前3个月至怀孕期间服用叶酸或斯利安;围孕期有害物质接触是指孕前3个月至怀孕期间接触过除草剂、杀虫剂、灭鼠剂、有机溶剂、消毒剂、有害气体等有害物质;围孕期不良环境暴露是指孕前3个月至怀孕期间住宅方圆20 km有煤矿、造纸厂、水泥厂、电厂、农药化肥厂等厂矿。
5.统计学分析:采用EpiData 3.1软件建立数据库、SPSS 22.0软件分析数据、R 3.5.3软件作图。计数资料用频数(n)和百分比(%)描述,其组间比较采用χ2检验。分析母亲围孕期被动吸烟情况与子代发生CHD的风险关系时,建立未调整和调整可能混杂因素的logistic回归模型,估计该风险的OR值及其95%CI;调整模型中的12个混杂变量。此外,本研究进一步以选择的协变量进行亚组分析,以无被动吸烟为参照,采用logistic回归模型调整除亚组变量外的其他协变量后估计各亚组孕妇被动吸烟与子代发生CHD的关联风险,并以此来衡量关联的稳定性。检验水准α=0.05,以P<0.05为差异有统计学意义。
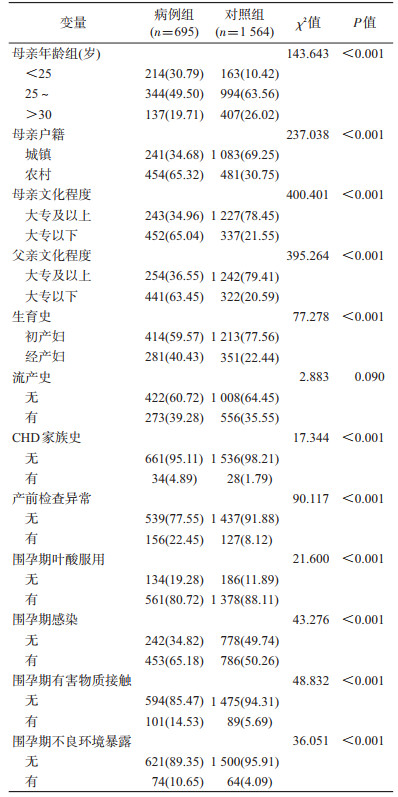
结果1.基本情况:根据纳入排除标准对研究对象进行筛选(图 1),共纳入2 259例对象,其中,病例组为695例,对照组为1 564例。病例组和对照组在母亲年龄、母亲户籍、母亲文化程度、父亲文化程度、生育史、CHD家族史、产前检查异常、围孕期感染、围孕期叶酸服用、围孕期有害物质接触和围孕期不良环境暴露上的差异有统计学意义(表 1)。
|
| 图 1 研究对象筛选流程图 |
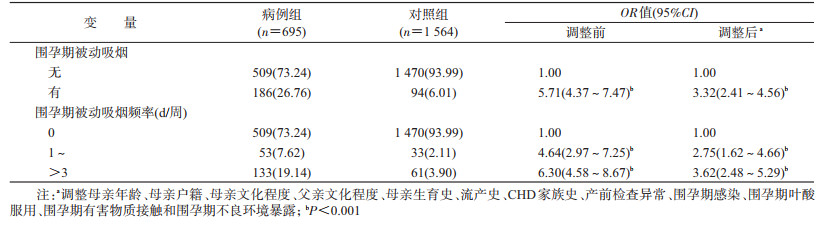
2.围孕期被动吸烟情况与子代CHD的关系:在2 259名研究对象中,围孕期被动吸烟的孕妇共280例,其中病例组186例(26.76%);对照组94例(6.01%)。在控制了潜在的混杂因素后,多因素logistic回归结果显示:围孕期被动吸烟者子代发生CHD的风险是无被动吸烟者的3.32倍(OR=3.32,95%CI:2.41~4.56)。此外,孕妇被动吸烟的暴露频率越高,该风险越大:每周被动吸烟1~3 d的孕妇生育CHD子代的风险是无被动吸烟者的2.75倍(OR=2.75,95%CI:1.62~4.66);每周被动吸烟>3 d的孕妇生育CHD子代的风险是无被动吸烟者的3.62倍(OR=3.62,95%CI:2.48~5.29)。见表 2。
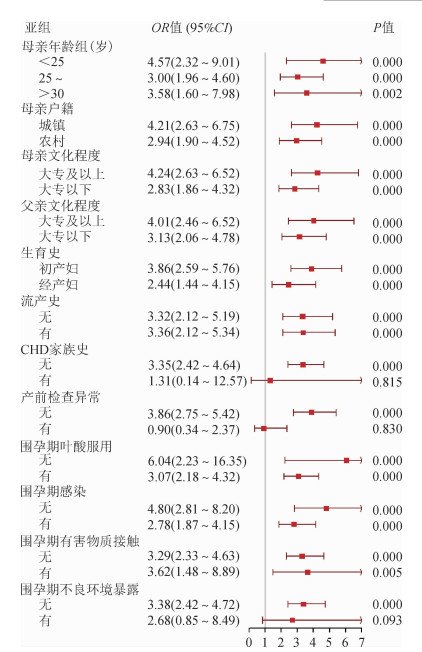
3.亚组分析:将各协变量视作亚组,调整其他协变量的混杂影响后,除CHD家族史、产前检查异常和围孕期不良环境暴露3个亚组外,其余9个亚组中各层孕妇围孕期被动吸烟和子代CHD的关系均有统计学意义,即围孕期被动吸烟增加子代发生CHD的风险;此外,无CHD家族史、产前检查无异常和无不良环境暴露3层中也发现了该风险关系。对有CHD家族史、产前检查有异常和有不良环境暴露的孕妇来说,该风险未发现有统计学意义,这可能与其暴露相对较少有关,亚组分析时样本量减少在一定程度上限制了联系性分析的把握度。此外,可能与“产前检查有异常和有不良环境暴露”这两个因素的内容较为复杂有关。整体来看,各亚组孕妇围孕期被动吸烟和子代CHD关系的方向基本保持一致,提示两者之间的关系较为稳定。见图 2。
|
| 注:调整了除亚组变量外的其他协变量,以无被动吸烟为参照 图 2 各亚组孕妇围孕期被动吸烟与子代发生CHD的关系 |
CHD位居出生缺陷之首,是出生缺陷致死的最主要原因[3]。它不仅降低了人群的健康水平,而且带来了巨大的疾病负担。然而,CHD的发病机制尚未明确,但可能与遗传因素和社会环境因素有关。探索CHD发生的可能病因,尤其是环境危险因素,对CHD的一级预防至关重要。众所周知,烟草暴露是很多疾病发生的危险因素。国外关于烟草暴露与不良妊娠结局的研究较多,但由于西方女性主动吸烟率较高,故研究多以母亲主动吸烟为主。相比西方国家,中国女性的主动吸烟率极低,被动吸烟率较高[7-8]。本研究利用陕西省CHD相关危险因素调查的病例对照数据,对母亲围孕期被动吸烟情况与子代发生CHD的关系进行深入探讨。在控制混杂因素后,分析发现围孕期被动吸烟孕妇的子代发生CHD的风险升高;而且围孕期被动吸烟的暴露频率越高,风险越大。亚组分析显示该风险关系具有较好的稳定性。因此,本研究提示母亲围孕期被动吸烟很可能是子代发生CHD的危险因素。
国外关于主动吸烟的研究发现母亲孕期主动吸烟或二手烟暴露可能是子代发生CHD的危险因素。Alverson等[16]的研究结果显示,孕前3个月母亲主动吸烟是子代发生CHD的危险因素,其中不同CHD亚型的发生风险(OR值)在1.32~1.90之间。Lee和Lupo[17]对1977-2011年发表相关研究进行Meta分析,认为母亲孕期吸烟可增加子代CHD及某些亚型的发生风险,且间隔缺损的发生风险最大。Sullivan等[18]的研究结果显示,孕前3个月吸烟的母亲子代更容易患CHD(OR=1.16)。国内一些探索CHD影响因素的研究中涉及了二手烟暴露或被动吸烟:在江西省儿童医院开展的病例对照研究结果显示,围孕期父亲吸烟和孕期暴露于吸烟环境均可能是CHD的危险因素(OR值分别为3.972和2.042)[10];在青海省开展的病例对照研究结果显示,孕期被动吸烟可能是子代发生CHD的危险因素(OR=5.288)[11]。Deng等[19]研究发现围孕期父亲吸烟增加了子代发生孤立性锥体动脉心脏缺陷、室间隔缺损和左心室流出道梗阻的风险。本研究与以上研究得出的结论均较一致,为围孕期被动吸烟增加子代CHD发生风险提供了有力证据。
被动吸烟者吸入的烟雾是其他吸烟者产生的二手烟雾(secondhand tobacco smoke,SHS),包括由燃烧着的香烟产生的侧流烟雾和吸烟者呼出的主流烟雾。SHS由数百种有毒颗粒、化学物质和气体组成,如尼古丁、一氧化碳(CO)、焦油、氨、二甲基亚硝胺、氰化氢和甲醛丙烯醛等[20]。尼古丁是一种重要的致畸剂,可引起子宫和脐动脉血管收缩,导致胎盘血流量减少和缺氧,进而可能影响胎儿血管的发育[21]。CO也是致畸物质之一,在血液中被迅速吸收,与血红蛋白结合形成羧基血红蛋白,导致低氧血症的发生,进而可能增加胎儿畸形的风险[22];动物研究发现产前CO暴露会延迟子代心室肌细胞的电生理成熟,可能导致危及生命的心律失常[23]。烟雾中其他有害成分也有着不同的毒性作用。此外,侧流烟雾(SHS的主要成分)中含有许多比主流烟雾中浓度更高的毒素,使被动吸烟者可能比主动吸烟者更具危险[20]。因此,被动吸烟的研究意义重大,孕妇作为特殊人群更应该规避其危害。
本研究存在局限性。由于少部分问卷信息采集不完整,损失了一定的样本量;研究是回顾性调查,因此回忆偏倚难以避免;本研究未对CHD进行分类分析,后续可根据CHD类型进一步分析围孕期被动吸烟与各亚型CHD的关系。由于调查问卷中涉及的围孕期被动吸烟是指孕前3个月至整个孕期,未对被动吸烟的具体孕期进行阶段划分,故无法分析不同孕期被动吸烟的效应。此外,由于数据收集方式的限制,本研究并未收集相关的环境污染物因子如空气颗粒物信息,故无法进行相应的调节性分析。然而,相关研究表明空气污染物如CO、NO、PM10等可能增加CHD的发生风险[24]。后续研究可同时收集被动吸烟和环境污染物的数据,进行调节性分析或交互分析。本研究为病例对照研究,虽无法确定因果关系,但也提示围孕期被动吸烟很可能是子代发生CHD的危险因素。因此,应加强对被动吸烟危害的宣传,严格实施并监督公共场所禁烟的举措;同时强化对孕妇及身边人士的围孕期健康教育,孕妇尽可能避开二手烟的暴露,身边人也尽可能营造良好的无烟环境,从而防范被动吸烟的危害,降低子代CHD的发生率,促进优生优育。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
van der Linde D, Konings EEM, Slager MA, et al. Birth prevalence of congenital heart disease worldwide:a systematic review and Meta-analysis[J]. J Am Coll Cardiol, 2011, 58(21): 2241-2247. DOI:10.1016/j.jacc.2011.08.025 |
| [2] |
Mat Bah MN, Sapian MH, Jamil MT, et al. The birth prevalence, severity, and temporal trends of congenital heart disease in the middle-income country:a population-based study[J]. Congenit Heart Dis, 2018, 13(6): 1012-1027. DOI:10.1111/chd.12672 |
| [3] |
Gilboa SM, Salemi JL, Nembhard WN, et al. Mortality resulting from congenital heart disease among children and adults in the United States, 1999 to 2006[J]. Circulation, 2010, 122(22): 2254-2263. DOI:10.1161/CIRCULATIONAHA.110.947002 |
| [4] |
中华人民共和国卫生部. 中国出生缺陷防治报告(2012)[M]. 北京: 中华人民共和国卫生部, 2012. Ministry of Health of the People's Republic of China. Report on prevention and treatment of birth defects in China (2012)[M]. Beijing: Ministry of Health of the People's Republic of China, 2012. |
| [5] |
Wagijo MA, Sheikh A, Duijts L, et al. Reducing tobacco smoking and smoke exposure to prevent preterm birth and its complications[J]. Paediatr Respir Rev, 2017, 22: 3-10. DOI:10.1016/j.prrv.2015.09.002 |
| [6] |
Collaco JM, Wilson KM, McGrath-Morrow SA. More evidence linking smoke-free legislation and lower risk of prematurity and low birth weight[J]. Pediatrics, 2017, 139(6): e20170795. DOI:10.1542/peds.2017-0795 |
| [7] |
World Health Organization. WHO global report on trends in prevalence of tobacco smoking 2000-2025[M]. 2nd ed. Geneva: World Health Organization, 2018: 35-38.
|
| [8] |
丁荣楣, 王平, 马丽君, 等. 中国女性居民被动吸烟率的Meta分析[J]. 预防医学, 2016, 28(7): 671-676. Ding RM, Wang P, Ma LJ, et al. A Meta-analysis on the prevalence of secondhand smoke among Chinese mainland female residents[J]. J Prev Med, 2016, 28(7): 671-676. DOI:10.19485/j.cnki.issn1007-0931.2016.07.006 |
| [9] |
施莉莉, 董艺蕾, 裴晟, 等. 上海市孕妇被动吸烟现状及其影响因素[J]. 上海交通大学学报:医学版, 2017, 37(2): 141-145. Shi LL, Dong YL, Pei S, et al. Passive smoking status and its influencing factors among pregnant women in Shanghai[J]. J Shanghai Jiaotong Univ:Med Sci, 2017, 37(2): 141-145. DOI:10.3969/j.issn.1674-8115.2017.02.002 |
| [10] |
邓鹏飞, 仲瑷玲, 黄河浪, 等. 儿童先天性心脏病环境暴露因素的病例对照研究[J]. 中华疾病控制杂志, 2015, 19(11): 1135-1137, 1141. Deng PF, Zhong AL, Huang HL, et al. A case-control study of environmental risk factors of congenital heart disease in children[J]. Chin J Dis Control Prev, 2015, 19(11): 1135-1137, 1141. DOI:10.16462/j.cnki.zhjbkz.2015.11.014 |
| [11] |
徐效龙, 祁国荣, 路霖, 等. 我国高原地区先天性心脏病影响因素的病例对照研究[J]. 中国预防医学杂志, 2018, 19(1): 1-4. Xu XL, Qi GR, Lu L, et al. Influencing factors of congenital heart disease in plateau region:A case-control study[J]. Chin Prev Med, 2018, 19(1): 1-4. DOI:10.16506/j.1009-6639.2018.01.001 |
| [12] |
杨功焕, 马杰民, 刘娜, 等. 中国人群2002年吸烟和被动吸烟的现状调查[J]. 中华流行病学杂志, 2005, 26(2): 77-83. Yang GH, Ma JM, Liu N, et al. Smoking and passive smoking in Chinese, 2002[J]. Chin J Epidemiol, 2005, 26(2): 77-83. DOI:10.3760/j.issn:0254-6450.2005.02.001 |
| [13] |
Nicoll R. Environmental contaminants and congenital heart defects:a Re-evaluation of the evidence[J]. Int J Environ Res Public Health, 2018, 15(10): 2096. DOI:10.3390/ijerph15102096 |
| [14] |
Øyen N, Boyd HA, Poulsen G, et al. Familial recurrence of midline birth defects-a nationwide danish cohort study[J]. Am J Epidemiol, 2009, 170(1): 46-52. DOI:10.1093/aje/kwp087 |
| [15] |
谢胜男, 李能, 王建敏, 等. 孕期危险因素与儿童先天性心脏病关系的Meta分析[J]. 华中科技大学学报:医学版, 2013, 42(5): 547-550, 559. Xie SN, Li N, Wang JM, et al. Relationship between Risk Factors during Pregnancy and Congenital Heart Disease in Children:a Meta-analysis[J]. Acta Med Univ Sci Technol Huazhong:Med Edition, 2013, 42(5): 547-550, 559. DOI:10.3870/j.issn.1672-0741.2013.05.009 |
| [16] |
Alverson CJ, Strickland MJ, Gilboa SM, et al. Maternal smoking and congenital heart defects in the Baltimore-Washington Infant Study[J]. Pediatrics, 2011, 127(3): e647-653. DOI:10.1542/peds.2010-1399 |
| [17] |
Lee LJ, Lupo PJ. Maternal smoking during pregnancy and the risk of congenital heart defects in offspring:a systematic review and Meta-analysis[J]. Pediatr Cardiol, 2013, 34(2): 398-407. DOI:10.1007/s00246-012-0470-x |
| [18] |
Sullivan PM, Dervan LA, Reiger S, et al. Risk of congenital heart defects in the offspring of smoking mothers:a population-based study[J]. J Pediatr, 2015, 166(4): 978-984.e2. DOI:10.1016/j.jpeds.2014.11.042 |
| [19] |
Deng K, Liu Z, Lin Y, et al. Periconceptional paternal smoking and the risk of congenital heart defects:a case-control study[J]. Birth Defects Res A Clin Mol Teratol, 2013, 97(4): 210-216. DOI:10.1002/bdra.23128 |
| [20] |
Raghuveer G, White DA, Hayman LL, et al. Cardiovascular consequences of childhood secondhand tobacco smoke exposure:prevailing evidence, burden, and racial and socioeconomic disparities:a scientific statement from the American heart association[J]. Circulation, 2016, 134(16): e336-359. DOI:10.1161/CIR.0000000000000443 |
| [21] |
Lambers DS, Clark KE. The maternal and fetal physiologic effects of nicotine[J]. Semin Perinatol, 1996, 20(2): 115-126. DOI:10.1016/S0146-0005(96)80079-6 |
| [22] |
Ziaei S, Nouri K, Kazemnejad A. Effects of carbon monoxide air pollution in pregnancy on neonatal nucleated red blood cells[J]. Paediatr Perinat Epidemiol, 2005, 19(1): 27-30. DOI:10.1111/j.1365-3016.2004.00619.x |
| [23] |
Sartiani L, Stillitano F, Luceri C, et al. Prenatal exposure to carbon monoxide delays postnatal cardiac maturation[J]. Lab Invest, 2010, 90(11): 1582-1593. DOI:10.1038/labinvest.2010.122 |
| [24] |
Agay-Shay K, Friger M, Linn S, et al. Air pollution and congenital heart defects[J]. Environ Res, 2013, 124: 28-34. DOI:10.1016/j.envres.2013.03.005 |
 2020, Vol. 41
2020, Vol. 41