文章信息
- 王莹莹, 徐芊, 徐东丽, 董晓莲, 苏美芳, 钱俊华, 江峰, 付朝伟, 姜庆五, 王娜.
- Wang Yingying, Xu Qian, Xu Dongli, Dong Xiaolian, Su Meifang, Qian Junhua, Jiang Feng, Fu Chaowei, Jiang Qingwu, Wang Na
- 青春发育与女性甲状腺形态及功能状况的关联研究
- Association between puberty with thyroid morphology and function in women
- 中华流行病学杂志, 2020, 41(6): 877-883
- Chinese Journal of Epidemiology, 2020, 41(6): 877-883
- http://dx.doi.org/10.3760/cma.j.cn112338-20190626-00470
-
文章历史
收稿日期: 2019-06-26
2. 上海市闵行区疾病预防控制中心 201100;
3. 浙江省德清县疾病预防控制中心 313000;
4. 浙江省玉环市疾病预防控制中心 317600;
5. 江苏省海门市疾病预防控制中心 226100
2. Minhang District Center for Disease Control and Prevention, Shanghai 201100, China;
3. Deqing County Center for Disease Control and Prevention, Deqing 313000, China;
4. Yuhuan City Center for Disease Control and Prevention, Yuhuan, 317600 China;
5. Haimen City Center for Disease Control and Prevention, Haimen 226100, China
成年人中甲状腺异常多发生于女性[1],但在学龄儿童中并未发现性别差异[2]。青春发育由性激素所发动,是个体从儿童期向成年期过渡的重要阶段,体格和生理机能呈现急速改变,甲状腺容积和激素水平也有显著变化[3]。同时,在青春发育的不同阶段,甲状腺形态及功能可能存在差异[4-5]。青春发育期内出现的甲状腺肿大会增加成年后甲状腺癌的发生风险[6]。碘元素是人体生长发育所必需的微量元素,也是合成甲状腺激素的原料。碘缺乏是甲状腺异常最主要的危险因素[7]。既往研究表明,青春发育期的女性存在碘缺乏现象[8]。该时期的女性由于生理原因,对碘元素的需要量增加;加之女性摄食较少,对碘元素的摄入量低于男性[9],由此可推断,女性更易发生甲状腺异常。既往对于青春期女性甲状腺形态及功能的研究较少[4-5, 10]。各地区碘盐食用现状存在差异[11-14]。本研究以上海市闵行区、江苏省海门市、浙江省玉环市、浙江省德清县4个地区的青春发育期女性为研究对象,观察不同青春发育分期的甲状腺容积大小、结节发生及激素水平的差异,分析青春发育对该人群的甲状腺形态及功能的影响。
对象与方法1.研究对象:采用分阶段整群抽样的方法,根据地理位置和食用碘盐的差异[11-14],分别在上海市闵行区(沿海,食用碘盐占优)、江苏省海门市(沿海,基本食用碘盐)、浙江省玉环市(沿海,食用非碘盐占优)、浙江省德清县(山区,喜食腌渍食物)各选定1所初中,将4所初中所有初一年级女生共491名纳入研究。排除甲状腺异常、垂体异常、其他影响甲状腺激素水平的疾病及服用碘补充剂者。年龄范围为[11~14(12.48±0.49)]岁。研究方案经复旦大学伦理委员会批准(批准文号:IRB#2012-03- 0350S),所有研究对象及其父母均签署知情同意书。
2.研究内容及方法:
(1)甲状腺B超检查和体格检查:4个地区的甲状腺B超检查均由同一名医生完成,采用探头频率为7.5 MHz的mindray PD-2C003255型超声诊断仪,检查研究对象甲状腺两侧叶的长度(mm)、宽度(mm)和厚度(mm)及结节发生情况。计算甲状腺每侧叶的容积及两侧叶容积之和:V左/右(ml)=0.479×长度×宽度×厚度/1 000,V(ml)=V左+V右[15]。4个地区的体格检查均由相同的工作人员完成,使用统一型号的身高体重仪测量研究对象身高(cm)、体重(kg)等体格发育指标,BMI(kg/m2)=体重/身高2。
(2)甲状腺功能检查:现场采集研究对象静脉血5~7 ml,采用化学发光免疫法检测血清促甲状腺激素(TSH)、血清总三碘甲状腺原氨酸(TT3)、血清总甲状腺素(TT4)、血清游离三碘甲状腺原氨酸(FT3)、血清游离甲状腺素(FT4)水平。
(3)尿碘水平检测:为区别家庭及学校饮食对学生尿碘的影响,分别采集同一周内周一、周四的清晨随机尿样各15 ml(分别称为“周一尿”和“周四尿”),采用电感耦合等离子体质谱法(ICP-MS)检测尿碘含量。
3.评价标准:
(1)青春发育分期评定:采用Petersen等编制的《青春发育事件自我评定量表》(Pubertal Development Scale,PDS)调查研究对象性发育状况[16]。计算月经初潮、乳房发育和体毛生长3个条目总分,划分为青春发育的5期:2分且没有月经初潮为“1期”、3分且没有月经初潮为“2期”,>3分且没有月经初潮为“3期”,≤7分且有月经初潮为“4期”,8分且有月经初潮为“5期”。将“2期”“3期”“4期”合并为“青春发动期”,“1期”及“5期”分别定义为“青春期前期”及“青春期后期”。最终青春发育分期可分为“青春期前期”“青春发动期”“青春期后期”3期[5]。
(2)碘营养状况评价:根据WHO推荐的标准评价群体单次尿碘水平,学龄儿童及成年人尿碘中位数<100 μg/L为碘缺乏,100~199 μg/L为碘适量,200~299 μg/L为碘超适量,≥300 μg/L为碘过量[17]。将两次尿碘水平进行加权折算出个体“加权尿碘日排出量”,计算公式:日尿碘排出量(μg)=Exp(0.010 2×身高-0.685 4)×113.1×0.001×尿碘/尿肌酐(μg/g),加权日尿碘排出量(μg)=周一尿碘含量×2/7 +周四尿碘含量×5/7[18]。
(3)甲状腺形态评价:根据原卫生部发布的《地方性甲状腺肿标准(WS 276-2007)》,当各年龄组甲状腺容积在以下情况视为甲状腺肿大:11岁组>7.0 ml,12岁组>8.0 ml,13岁组>9.0 ml,14岁组>10.5 ml[15]。
4.统计学分析:采用EpiData 3.1软件双录入数据、SPSS 25.0软件分析数据、GraphPad Prism 8软件绘制图表。年龄及各项体格指标呈正态分布,用x±s表示;盐碘、尿量含量及甲状腺激素水平均呈非正态分布,用M(P25~P75)表示,采用符号秩和检验、Wilcoxon秩和检验、Kruskal-Wallis秩和检验进行各组比较;采用多重线性回归模型分别分析青春发育分期、PDS总分与甲状腺容积大小、各激素指标水平(连续变量)的关系;采用多因素logistic回归模型分别分析青春发育分期与甲状腺容积大小、各激素指标水平(二分类变量,以P50为切点划分为“较低”“较高”2部分)的关系,同时根据地区分层后做进一步分析。模型中调整年龄、BMI、家庭人均月收入、家长文化程度、家长吸烟情况及地区(或加权尿碘日排出量)等变量。检验水准为α=0.05。
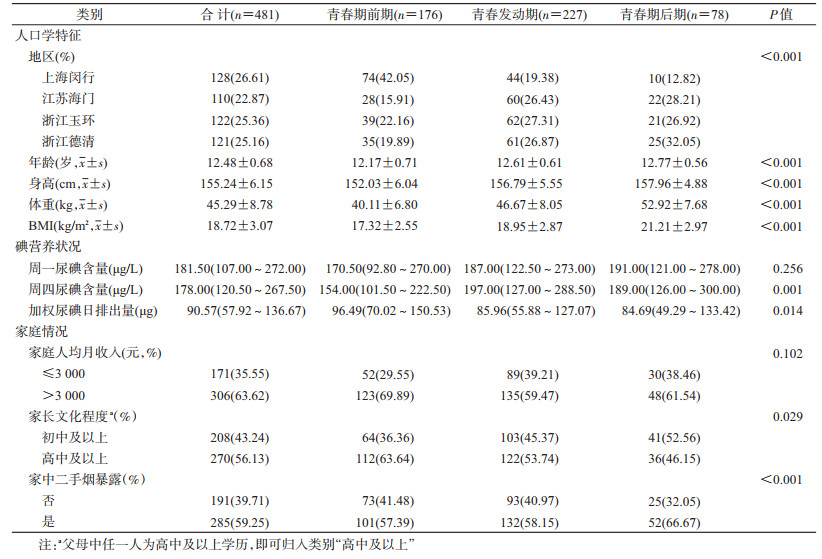
结果1.基本情况:实际纳入481名研究对象的数据进行分析,其具有完整的青春发育分期及甲状腺状况信息,应答率为97.96%。其中,青春发动期人数最多,占47.19%(227/481),青春期后期人数最少,占16.22%(78/481)(表 1)。身高、体重、BMI均表现为青春期前期<青春发动期<青春期后期(P<0.001)。各发育分期的周一尿碘、周四尿碘水平均处于碘适量状态,加权尿碘日排出量随青春发育成熟而下降(P=0.014)。青春期后期的家中二手烟暴露比例较大(P<0.001)。
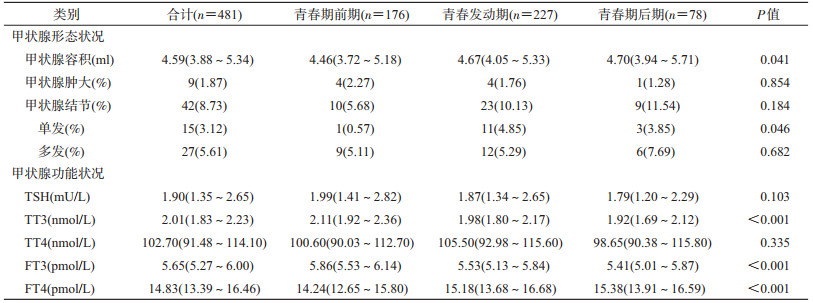
2.甲状腺形态及功能状况:不同青春发育分期的甲状腺形态及功能状况见表 2。容积中位数、结节检出率表现为青春期前期<青春发动期<青春期后期(P=0.041,P>0.05);对于结节类型,各分期均以多发结节为主,但检出率的差异仅表现在单发结节上(P=0.046)。肿大检出率随着发育程度呈相反趋势,发育越成熟,肿大率越低,差异无统计学意义(P>0.05)。对于激素指标,FT4水平的中位数表现为青春期前期<青春发动期<青春期后期(P<0.05),TT3及FT3水平均为青春期前期>青春发动期>青春期后期(P<0.001)。
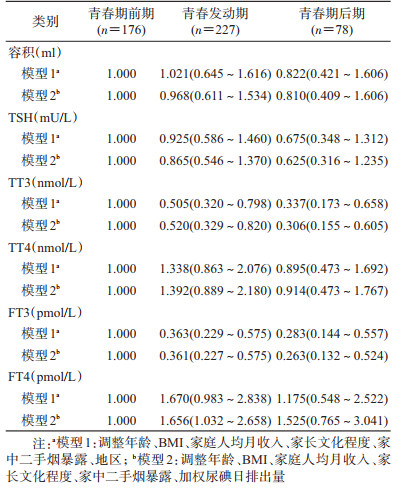
3.甲状腺容积及功能的多因素回归分析:多重线性回归模型中,青春发育分期、PDS总分均与TT3、FT3水平呈负相关(表 3)。PDS总分每增加1分,TT3和FT3水平在模型1中分别减少0.067 nmol/L和0.170 nmol/L,在模型2中分别减少0.065 nmol/L和0.162 nmol/L。
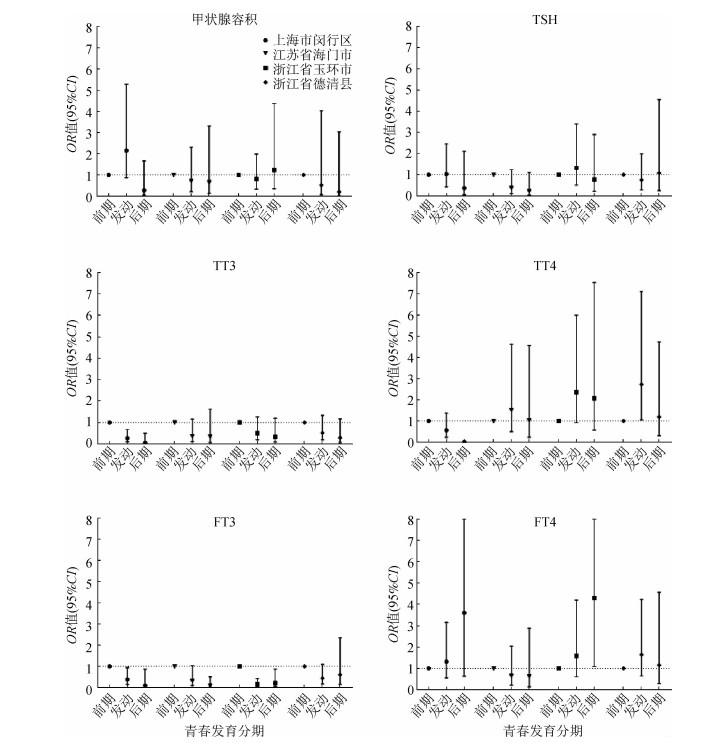
青春发育分期与TT3、FT3水平呈负相关,与多重线性回归分析的结果一致(表 4)。相较于青春期前期者,青春期后期者具有较低的TT3和FT3水平(模型1:OR=0.337,95%CI:0.173~0.658;OR=0.283,95%CI:0.144~0.557;模型2:OR=0.306,95%CI:0.155~0.605;OR=0.263,95%CI:0.132~0.524)。在模型2中,青春发动期者具有较高FT4水平的可能性是青春期前期者的1.656倍(95%CI:1.032~2.658)。按照地区进行分层后,与之前的结果一致(图 1),上海市闵行区、江苏省海门市、浙江省玉环市的FT3水平与青春发育呈负相关,青春期后期与青春期前期相比有较低的FT3水平(OR=0.094,95%CI:0.010~0.872;OR=0.093,95%CI:0.017~0.508;OR=0.211,95%CI:0.051~0.877);而青春发育与TT3水平的负相关仅表现在江苏省海门市(OR=0.052,95%CI:0.005~0.498),与FT4水平的正相关仅表现在浙江省玉环市(OR=4.302,95%CI:1.079~17.160)。浙江省德清县的结果与未分层前相反,青春发动期与青春期前期相比有较高的TT4水平(OR=2.729,95%CI:1.047~7.112)。
|
| 注:调整年龄、BMI、家庭人均月收入、家长文化程度、家中二手烟暴露、加权尿碘日排出量 图 1 不同地区分层后青春发育分期对甲状腺容积及功能影响 |
本研究利用江、浙、沪4个地区的青春期女性调查数据,分析不同青春发育分期与甲状腺形态及功能的关联。结果显示,青春发育程度对于女性甲状腺容积大小、结节产生及激素水平存在影响,但并不一致。
近10年对于青春期女性甲状腺形态及功能的讨论较少[4, 5, 10]。在本研究中,甲状腺容积大小和结节检出率均随着青春发育而增加。雌激素水平增加可刺激甲状腺细胞的增殖及组织病变,诱导腺体增大和结节产生。女性青春发育启动时间较男性提前,因此更早、更明显地出现甲状腺容积增大[19]。但在本研究中,甲状腺肿大率表现为青春期后期者最低,与之前的假设相悖,这可能由于在本研究中甲肿例数较少,该检出率并不能代表实际的患病情况,且现有的仅以年龄划定的甲状腺容积评价标准可能并不合理[20]。
本研究结果提示TSH水平不受青春发育程度的影响,与Marwaha等[5]的观察结果相似,这可能与下丘脑-垂体-甲状腺轴对能量消耗增加的适应有关。TSH对机体代谢和能量消耗方面起关键作用[21]。TT3、FT3水平在随青春发育成熟而下降,雌激素对青春期后期的下丘脑-垂体-甲状腺轴有抑制作用[10]。TT3促进生长激素的合成;在青春期前期,TT3水平最高,这反映了女孩的生长突增较早;在青春期后期,TT3水平最低,这与脂肪增加导致体重增加的时间相对应[22]。Dunger等[23]观察到,女孩FT3水平随青春发育而下降,男孩保持不变,此归结于游离甲状腺素在青春发动期后存在性别依赖性。而FT4水平在青春期后期最高,若TSH水平降低且FT4水平升高,较易发展为甲状腺功能亢进。青春期甲状腺功能亢进是由自身免疫或发生感染,导致甲状腺滤泡细胞破坏,预先形成的激素不受调节地释放到血液中,而雌激素在自身免疫中会发挥相应的作用[24]。在多因素回归分析中,无论甲状腺容积及激素指标是以连续变量还是二分类变量纳入模型,研究结果均提示,相较于青春期前期,青春期后期者具有较低的TT3和FT3水平,此结果与单因素分析结果一致。
本研究也存在局限性。虽有甲状腺形态及激素的数据,但并未检测甲状腺过氧化物酶抗体等免疫指标;国内暂无针对11~14岁女性的甲状腺激素参考值范围,因此不能对研究对象功能指标的正常与否进行判断。
综上所述,本研究通过观察江、浙、沪11~14岁青春期女性甲状腺容积大小、结节发生及激素水平的差异,探讨不同青春发育阶段对于女性甲状腺形态及功能的影响。在女生青春发育过程中,要密切观察其甲状腺形态及功能的变化,及时识别异常并给予有效干预,以降低成年期甲状腺疾病发生的风险。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
狄正霞, 田文君, 邵俊峰, 等. 体检人群甲状腺功能异常的调查研究[J]. 检验医学与临床, 2019, 16(9): 1172-1175. Di ZX, Tian WJ, Shao JF, et al. Investigation on thyroid dysfunction in physical examination population[J]. Lab Med Clin, 2019, 16(9): 1172-1175. DOI:10.3969/j.issn.1672-9455.2019.09.006 |
| [2] |
杨佳露. 上海市浦东新区8~10岁学龄儿童尿碘水平与甲状腺疾病的关系[J]. 工业卫生与职业病, 2018, 44(6): 414-417. Yang JL. The relationship between urinary iodine levels and thyroid diseases in school children aged 8-10 in Shanghai Pudong New Area[J]. Ind Health Occup Dis, 2018, 44(6): 414-417. DOI:10.13692/j.cnki.gywsyzyb.2018.06.005 |
| [3] |
Weber G, Vigone MC, Stroppa L, et al. Thyroid function and puberty[J]. J Pediatr Endocrinol Metabol, 2003, 162 Suppl 2: 253-257. |
| [4] |
Kaloumenou I, Alevizaki M, Ladopoulos C, et al. Thyroid volume and echostructure in schoolchildren living in an iodine- replete area:Relation to age, pubertal stage, and body mass index[J]. Thyroid, 2007, 17(9): 875-881. DOI:10.1089/thy.2006.0327 |
| [5] |
Marwaha RK, Tandon N, Desai AK, et al. The evolution of thyroid function with puberty[J]. Clin Endocrinol, 2012, 76(6): 899-904. DOI:10.1111/j.1365-2265.2011.04305.x |
| [6] |
Noureldine SI, Tufano RP. Association of Hashimoto's thyroiditis and thyroid cancer[J]. Curr Opin Oncol, 2015, 27(1): 21-25. DOI:10.1097/CCO.0000000000000150 |
| [7] |
Bailey RL, West KP Jr, Black RE. The epidemiology of global micronutrient deficiencies[J]. Ann Nutr Metab, 2015, 662 Suppl 2: 22-33. DOI:10.1159/000371618 |
| [8] |
Vanderpump MPJ, Lazarus JH, Smyth PP, et al. Iodine status of UK schoolgirls:a cross-sectional survey[J]. Lancet, 2011, 377(9782): 2007-2012. DOI:10.1016/S0140-6736(11)60693-4 |
| [9] |
Wu Y, Sanchez BN, Goodrich JM, et al. Dietary exposures, epigenetics and pubertal tempo[J]. Environ Epigenet, 2019, 5(1): dvz002. DOI:10.1093/eep/dvz002 |
| [10] |
Kaloumenou I, Duntas LH, Alevizaki M, et al. Gender, age, puberty, and BMI related changes of TSH and thyroid hormones in schoolchildren living in a long-standing iodine replete area[J]. Hormone Metabol Res, 2010, 42(4): 285-289. DOI:10.1055/s-0029-1246184 |
| [11] |
黄培新, 江峰, 冯新, 等. 江苏省海门市学龄儿童尿碘水平及家庭食用碘盐现况调查[J]. 中华地方病学杂志, 2014, 33(6): 654-656. Huang PX, Jiang F, Feng X, et al. A cross-sectional study of urinary iodine and salt iodine content among schoolchildren and their families in Haimen city, Jiangsu province[J]. Chin J Endemiol, 2014, 33(6): 654-656. DOI:10.3760/cma.j.issn.2095-4255.2014.06.016 |
| [12] |
刘蒲, 王娜, 方红, 等. 2012-2014年上海市某小学学生尿碘水平及其家庭食用盐状况分析[J]. 中华预防医学杂志, 2016, 50(3): 282-284. Liu P, Wang N, Fang H, et al. Alteration on household salt consumption status and urinary iodine concentration of a primary school children in Shanghai, 2012-2014[J]. Chin J Prev Med, 2016, 50(3): 282-284. DOI:10.3760/cma.j.issn.0253-9624.2016.03.020 |
| [13] |
苏美芳, 王丛昀, 李松涛, 等. 浙江省玉环县8~10岁儿童尿碘与食用盐碘现况调查[J]. 卫生研究, 2013, 42(6): 893-896. Su MF, Wang CJ, Li ST, et al. A cross-sectional study on urinary iodine and iodine content of salt among school children aged 8-10 years old in Yuhuan county, Zhejiang province in 2012[J]. J Hyg Res, 2013, 42(6): 893-896. |
| [14] |
张一鸣, 王莹莹, 王学才, 等. 德清县青春期女生碘营养及甲状腺异常状况[J]. 中国学校卫生, 2018, 39(11): 1723-1725. Zhang YM, Wang YY, Wang XC, et al. Abnormalities of iodine nutrition and thyroid status among girls during puberty in Deqing County[J]. Chin J School Health, 2018, 39(11): 1723-1725. DOI:10.16835/j.cnki.1000-9817.2018.11.037 |
| [15] |
中华人民共和国卫生部. WS 276-2007地方性甲状腺肿诊断标准[S].北京: 人民卫生出版社, 2007. Ministry of Health of the People's Republic of China. WS 276-2007 Diagnostic criteria for endemic goiter[S]. Beijing: People's Medical Publishing House, 2007. |
| [16] |
Marshall WA, Tanner JM. Variations in pattern of pubertal changes in girls[J]. Arch Dis Child, 1969, 44(235): 291-303. DOI:10.1136/adc.44.235.291 |
| [17] |
WHO/UNICEF/ICCIDD. Assessment of iodine deficiency disorders and monitoring their elimination. A guide for programme managers[M]. 3rd ed. Geneva: WHO Press, 2007: 32-33.
|
| [18] |
Wang HX, Tang CX, Yang JQ, et al. Predictors of urinary antibiotics in children of Shanghai and health risk assessment[J]. Environ Int, 2018, 121: 507-514. DOI:10.1016/j.envint.2018.09.032 |
| [19] |
Wiersinga WM, Podoba J, Srbecky M, et al. A survey of iodine intake and thyroid volume in Dutch schoolchildren:reference values in an iodine-sufficient area and the effect of puberty[J]. Eur J Endocrinol, 2001, 144(6): 595-603. DOI:10.1530/eje.0.1440595 |
| [20] |
王莹莹, 尼格德力·阿力腾赛尔, 付朝伟, 等. 学龄儿童甲状腺容积变化与体格发育变化的关联及不同甲状腺容积指数适用性的队列研究[J]. 中华流行病学杂志, 2018, 39(12): 1544-1548. Wang YY, Ni Gedeli·Alitengsaier, Fu CW, et al. A cohort study on the association between dynamics of thyroid volume and the changes of physical growth as well as the comparison of different thyroid volume indexes in school-aged children[J]. Chin J Epidemiol, 2018, 39(12): 1544-1548. DOI:10.3760/cma.j.issn.0254-6450.2018.12.002 |
| [21] |
Peper JS, Brouwer RM, van Leeuwen M, et al. HPG-axis hormones during puberty:A study on the association with hypothalamic and pituitary volumes[J]. Psychoneuroendocrinology, 2010, 35(1): 133-140. DOI:10.1016/j.psyneuen.2009.05.025 |
| [22] |
Holder AT, Wallis M. Actions of growth hormone, prolactin and thyroxine on serum somatomedin-like activity and growth in hypopituitary dwarf mice[J]. J Endocrinol, 1977, 74(2): 223-229. DOI:10.1677/joe.0.0740223 |
| [23] |
Dunger DB, Perkins JA, Jowett TP, et al. A longitudinal-study of total and free thyroid-hormones and thyroxinebinding globulin during normal puberty[J]. Acta Endocrinol, 1990, 123(3): 305-310. DOI:10.1530/acta.0.1230305 |
| [24] |
Srinivasan S, Misra M. Hyperthyroidism in Children[J]. Pediatr Rev, 2015, 36(6): 239-248. DOI:10.1542/pir.36-6-239 |
 2020, Vol. 41
2020, Vol. 41