文章信息
- 唐林, 凌倩, 吕繁, 汤后林, 李培龙, 葛琳, 陈方方, 蔡畅, 李东民.
- Tang Lin, Ling Qian, Lyu Fan, Tang Houlin, Li Peilong, Ge Lin, Chen Fangfang, Cai Chang, Li Dongmin
- 利用线性混合效应模型分析男男性行为人群中HIV疾病进程
- Using linear mixed-effects model to analyze the progression of HIV disease, among men who have sex with men
- 中华流行病学杂志, 2020, 41(6): 861-865
- Chinese Journal of Epidemiology, 2020, 41(6): 861-865
- http://dx.doi.org/10.3760/cma.j.cn112338-20190918-00679
-
文章历史
收稿日期: 2019-09-18
CD4+T淋巴细胞计数(CD4)是反映HIV感染后疾病进程的重要生物标志物之一[1],国外多项研究显示[2-6],通过CD4平方根随着时间的线性递减变化关系有助于了解HIV从感染到诊断发现甚至抗病毒治疗前的疾病进展状态,而目前国内对HIV感染到诊断发现的队列研究相对较少,不能直观地反映HIV从感染到诊断发现的疾病进程;同时,随着抗病毒治疗的不断推广,尤其是近年来“发现即治疗”的防治策略的提出,使得艾滋病的自然疾病进程更加难以观测[7],而利用既往的HIV/AIDS报告数据拟合CD4衰减与感染时间之间的数量关系,从而来反映HIV感染到诊断发现的疾病进程,在国内的报道也相对较少[8]。此外,由于CD4的重复测量形成一系列纵向数据,同一个体重复测量次数之间不独立且存在一定的相关性,采用传统的线性回归方法难以反映不同CD4测量值之间的随机效应,而利用线性混合效应模型处理不同测量个体之间的相关性更具优势[9-10]。本研究利用国家艾滋病综合防治数据信息系统中男男性行为传播的病例报告数据,采用线性混合效应模型基于全国水平探讨HIV感染后CD4衰减与感染时间的数量变化关系,旨在了解我国MSM中HIV感染的疾病进程。
对象与方法1.研究对象:来源于我国艾滋病综合防治数据集信息系统截至2019年5月31日HIV/AIDS报告数据。纳入标准:年龄≥15岁、感染途径为男男性行为传播、抗病毒治疗前CD4检测次数≥2的HIV/AIDS。纳入研究对象共计26 754例,其中含有HIV末次阴性检测日期记录的共计146例。本次研究经过中国CDC性病艾滋病预防控制中心伦理委员会批准(审批号:X190311565)。
2.研究方法:
(1)研究内容:①基本信息:年龄、民族、文化程度等;②疾病相关变量:HIV阳性诊断日期、CD4检测结果、CD4检测日期、末次HIV阴性检测日期、首次HIV阳性检测日期等。
(2)线性混合效应模型:采用线性混合效应模型拟合抗病毒治疗前CD4随时间下降的规律,建立CD4平方根与感染时间之间的线性消除关系,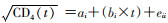
(3)相关定义:①阳转日期:指HIV感染日期,选取HIV末次阴性检测日期与首次阳性检测日期的时间间隔≤2年的数据,以末次阴性检测日期与首次阳性检测日期的中值作为阳转日期;②时间间隔t1:指历次CD4检测日期与HIV阳转日期之差,作为线性混合效应模型中CD4消除模型中截距ai的自变量;③时间间隔t2:指历次CD4检测日期与首次CD4检测日期之差,作为线性混合效应模型中CD4消除模型中斜率bi的自变量。
3.统计学分析:采用SAS 9.4软件进行数据的整理与分析,采用线性混合效用模型按年龄分层计算CD4平方根与感染时间之间的截距与斜率,并通过此公式反向计算HIV感染到不同CD4水平的时间间隔。计量资料采用M(P25~P75)描述,计数资料采用频数(百分比)描述;模型参数检验采用t检验和Z检验。双侧检验,以P<0.05为差异有统计学意义。
结果1.基本情况:研究对象26 754例,年龄M=27(P25~P75:23~35)岁,25~34岁(占40.52%,10 840/26 754)、汉族(占94.89%,25 386/26 754)、高中或以上文化程度(占72.60%,19 422/26 754)、报告年在2016年以前(占86.26%,23 075/26 754)为主,首次CD4分布中,首次CD4(535±200)个/μl,CD4≥500个/μl(占53.82%,14 399/26 754)。
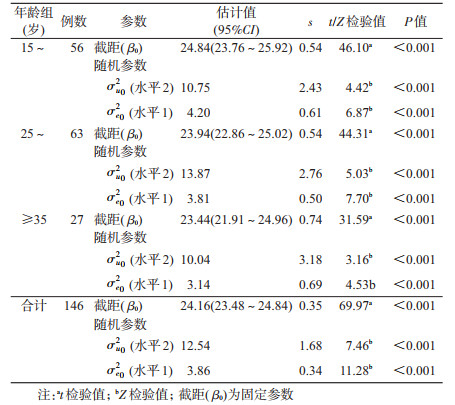
2. CD4消除模型中截距的估计:15~、25~、≥35岁年龄组固定截距β0分别为24.84、23.94、23.44,代表着各年龄组总体的CD4初始水平,经过t检验,各年龄组总体CD4在初始水平差异有统计学意义(P<0.001);随机截距的方差估计σu02表示不同个体之间(水平2)在初始测量的CD4水平差异有统计学意义(P<0.001),残差的方差估计σe02表示同一个体内(水平1)考虑随机截距后,在个体内差异有统计学意义(P<0.001)。全年龄组中固定截距为β0=24.16(P<0.001),随机截距的方差估计为σu02=12.54(P<0.001),表示在MSM个体之间初始CD4水平的差异有统计学意义。见表 1。
3. CD4消除模型中斜率的估计:模型中15~、25~、35~、≥45岁年龄组固定斜率β1分别为-1.31、-1.37、-1.53、1.59(P<0.001),表示同一年龄组中的不同个体具有相同的斜率,即CD4随时间的消除率是固定的;随机参数部分,随机截距的方差估计σu02都为0,表示截距无随机效应;对于时间t2的随机斜率,不同年龄组的方差估计σu12分别为1.04、1.16、1.57、1.43,经Z检验,不同个体之间的CD4消除率的差异有统计学意义(P<0.001)。全年龄组中CD4随时间的固定斜率为β1=-1.39(P<0.001),随机斜率的方差估计为σu12=1.19(P<0.001),表示CD4随着时间消除率在个体间的差异有统计学意义。见表 2。
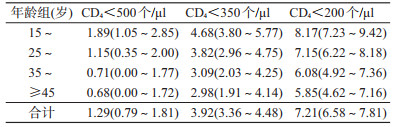
4. HIV阳转日期到不同CD4水平的时间分布情况:不同年龄组从HIV阳转日期到达CD4<500、<350、<200个/μl的时间分布。见表 3。其中15~24岁组达到CD4<500、<350、<200个/μl的中位时间最长,分别为1.89(95%CI:1.05~2.85)、4.68(95%CI:3.80~5.77)、8.17(95%CI:7.23~9.42)年,≥45岁组达到CD4<500、<350、<200个/μl的中位时间最短,分别为0.68(95%CI:0.00~1.72)、2.98(95%CI:1.91~4.14)、5.85(95%CI:4.62~7.16)年,说明低年龄CD4进展速度要低于高年龄组。
据全国艾滋病疫情报告显示,我国HIV/AIDS男男性行为传播在性传播中所占的比例已从2010年的10.8%上升至2018年的22.7%,MSM仍是艾滋病防控的重点人群[12-13]。本研究显示,纳入研究的MSM主要以25~34岁、汉族、高中及以上文化程度、首次CD4≥500个/μl、报告年在2016年以前为主。纳入对象及其CD4检测记录必须是在抗病毒治疗前的,如果是在抗病毒治疗之后,后续的CD4进展已经不是自然状态下的进展。同时,我国治疗标准也是不断改变的,2004年的治疗标准为CD4≤200个/μl、2008年为≤350个/μl、2014年为≤500个/μl,2016年对所有感染者实行“发现即治疗”防治策略[7],这导致2016年以后纳入的对象较少。
线性混合效应模型能够很好地处理不同水平之间的随机效应,在纵向重复测量数据中有着较为广泛的应用[1, 14]。本次研究显示,通过线性混合效应模型从整体水平来拟合CD4值与感染时间呈线性负相关,且年龄越大斜率变化越快,与美国、欧洲、巴西等国家MSM的HIV感染者CD4变化趋势相符[5-6, 15];其中模型估计的各年龄组截距与CASCADE Collaboration[2]的研究(22.98~23.40)、Lodi等[5]的研究(22.67~24.43)结果相似,但本研究的区间估计要略大于既往研究,可能与随机截距模型估计过程中纳入含有阴性检测日期的样本量较少(仅有146例)以及年龄分层有关。
对于线性消除模型中截距与斜率采用的是固定截距与固定斜率,表示的是从群体水平描述CD4随感染时间的变化关系,其中既考虑了群体水平,又考虑到不同个体间存在的差异,对于探讨疾病感染进程具有一定指导意义,尤其是在国内从HIV阳转到诊断发现的队列研究相对较少,此次研究为CD4与感染时间之间的消除模型的构建提供了依据。对于线性消除模型中截距与斜率估计过程中年龄分层略有不同,其中斜率的估计将≥35岁组又细分为2个年龄组,对于探讨高年龄组中CD4随时间的消除关系具有一定的参考意义。
CD4作为反映HIV感染后的疾病进程的重要生物标志物之一,研究HIV感染后不同时间节点CD4水平变化情况,对于了解HIV感染者的疾病进程有重要意义[16],是构建艾滋病疫情估计模型的重要基础参数。本研究的HIV感染者从HIV感染到CD4<500、<350、<200个/μl的中位时间与Lodi等[5]研究所得的1.19(95%CI:1.12~1.26)、4.20(95%CI:4.09~4.28)、和7.90(95%CI:7.76~8.09)年相近。国内有研究表明,近年来我国HIV-1流行的主要亚型为CRF01_AE和CRF07_ BC,尤其是在MSM中,CRF01_AE亚型是加快疾病进程的主要原因[17-18]。同时,欧洲25个队列研究显示[5],高年龄组的CD4进展要快于低年龄组,提示不同年龄组CD4进展快慢存在差异,与本次研究结果显示不同年龄组到达同一CD4水平的时间随着年龄增大而进展加快基本一致,表明高年龄组机体免疫力降低,CD4进展加快。此外,国外还有研究表明[3, 19],MSM中CD4进展速度明显要高于其他传播途径人群,可能与该人群近年来HIV感染的基因亚型改变有关[20]。
本研究采用艾滋病病例报告中抗病毒治疗前且有≥2次的CD4检测记录拟合CD4衰减与感染时间的数量关系,由于线性消除模型中的截距是采用含有部分HIV末次阴性检测日期的数据进行估计的,样本量相对较少,可能会导致截距的估计存在偏倚。
综上所述,利用CD4消除模型拟合MSM中CD4衰减随感染时间的数量关系,CD4消除率随着年龄的增大而进展加快;而高年龄组从HIV阳转到达不同CD4阈值的进展时间比低年龄组更短,提示MSM中高年龄组受HIV感染的影响更大,早诊断并及时的开展抗病毒治疗有助于延缓疾病进展。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Tilling K, Lawton M, Robertson N, et al. Modelling disease progression in relapsing-remitting onset multiple sclerosis using multilevel models applied to longitudinal data from two natural history cohorts and one treated cohort[J]. Health Technol Assess, 2016, 20(81): 1-48. DOI:10.3310/hta20810 |
| [2] |
CASCADE Collaboration. Differences in CD4 cell counts at seroconversion and decline among 5739 HIV-1-infected individuals with well-estimated dates of seroconversion[J]. J Acquir Immune Defic Syndr, 2003, 34(1): 76-83. DOI:10.1097/00126334-200309010-00012 |
| [3] |
Kiwanuka N, Robb MO, Kigozi G, et al. HIV-1 viral subtype differences in the rate of CD4+ T-cell decline among HIV seroincident antiretroviral naive persons in Rakai district, Uganda[J]. J Acquir Immune Defic Syndr, 2010, 54(2): 180-184. DOI:10.1097/QAI.0b013e3181c98fc0 |
| [4] |
Ng OT, Lin L, Laeyendecker O, et al. Increased rate of CD4+ T-cell decline and faster time to antiretroviral therapy in HIV-1 subtype CRF01_AE infected seroconverters in Singapore[J]. PLoS One, 2011, 6(1): e15738. DOI:10.1371/journal.pone.0015738 |
| [5] |
Lodi S, Phillips A, Touloumi G, et al. Time from human immunodeficiency virus seroconversion to reaching CD4+ cell count thresholds < 200, < 350, and < 500 cells/mm3:assessment of need following changes in treatment guidelines[J]. Clin Infect Dis, 2011, 53(8): 817-825. DOI:10.1093/cid/cir494 |
| [6] |
Touloumi G, Pantazis N, Pillay D, et al. Impact of HIV-1 subtype on CD4 count at HIV seroconversion, rate of decline, and viral load set point in European seroconverter cohorts[J]. Clin Infect Dis, 2013, 56(6): 888-897. DOI:10.1093/cid/cis1000 |
| [7] |
中华医学会感染病学分会艾滋病丙型肝炎学组, 中国疾病预防控制中心. 中国艾滋病诊疗指南(2018版)[J]. 中华临床感染病杂志, 2018, 11(6): 411-432. Chinese Medical Association Infectious Diseases Society HIV Hepatitis C, Chinese Center for Disease Control and Prevention. National guidelines for diagnosis and treatment of HIV/AIDS(2018)[J]. Chin J Clin Infect Dis, 2018, 11(6): 411-432. DOI:10.3760/cma.j.issn.1674-2397.2018.06.003 |
| [8] |
李爱华, 江震, 段松, 等. 基于CD4+T淋巴细胞水平反推法估计云南省德宏傣族景颇族自治州HIV诊断发现率[J]. 中华预防医学杂志, 2018, 52(8): 833-836. Li AH, Jing Z, Duan S, et al. Estimation of HIV diagnosis rate with CD4+ T-lymphocyte level and infected-time model in Dehong Prefecture, Yunnan Province[J]. Chin J Prev Med, 2018, 52(8): 833-836. DOI:10.3760/cma.j.issn.0253-9624.2018.08.011 |
| [9] |
Huang YX, Chen R, Dagne G. Simultaneous Bayesian inference for linear, nonlinear and semiparametric mixed-effects models with skew-normality and measurement errors in covariates[J]. Int J Biostat, 2011, 7(1): 8. DOI:10.2202/1557-4679.1292 |
| [10] |
Touloumi G, Pocock SJ, Babiker AG, et al. Estimation and comparison of rates of change in longitudinal studies with informative drop-outs[J]. Stat Med, 1999, 18(10): 1215-1233. DOI:10.1002/(sici)1097-0258(19990530)18:10<1215::aid-sim118>3.0.co;2-6 |
| [11] |
王济川, 谢海义, Fisher JH. 多层统计分析模型:SAS与应用[M]. 北京: 高等教育出版社, 2009. Wang JC, Xie HY, Fisher JH. Multilevel models:applications using SAS[M]. Beijing: Higher Education Press, 2009. |
| [12] |
黑发欣, 王璐, 秦倩倩, 等. 中国2006-2010年男男性行为者艾滋病疫情分析[J]. 中华流行病学杂志, 2012, 33(1): 67-70. Hei FX, Wang L, Qin QQ, et al. Epidemic characteristics of HIV/AIDS among men who have sex with men from 2006 to 2010 in China[J]. Chin J Epidemiol, 2012, 33(1): 67-70. DOI:10.3760/cma.j.issn.0254-6450.2012.01.015 |
| [13] |
中国疾病预防控制中心, 性病艾滋病预防控制中心, 性病控制中心. 2018年第3季度全国艾滋病性病疫情[J]. 中国艾滋病性病, 2018, 24(11): 1075. Chinese Center for Disease Control and Prevention, Center for STD/AIDS Prevention and Control, STD Center. Update on the AIDS/STD epidemic in China the third quarter of 2018[J]. Chin J AIDS STD, 2018, 24(11): 1075. DOI:10.13419/j.cnki.aids.2018.11.01 |
| [14] |
Song RG, Hall HI, Green TA, et al. Using CD4 data to estimate HIV incidence, prevalence, and percent of undiagnosed infections in the United States[J]. J Acquir Immune Defic Syndr, 2017, 74(1): 3-9. DOI:10.1097/QAI.0000000000001151 |
| [15] |
Szwarcwald CL, Pascom ARP, de Souza Júnior PRD. Estimation of the HIV incidence and of the number of people living with HIV/AIDS in Brazil, 2012[J]. J AIDS Clin Res, 2015, 6(3): 1000430. DOI:10.4172/2155-6113.1000430 |
| [16] |
Lewden C, Chene G, Morlat P, et al. HIV-infected adults with a CD4 cell count greater than 500 cells/mm3 on long-term combination antiretroviral therapy reach same mortality rates as the general population[J]. J Acquir Immune Defic Syndr, 2007, 46(1): 72-77. DOI:10.1097/QAI.0b013e318134257a |
| [17] |
He X, Xing H, Ruan YH, et al. A comprehensive mapping of HIV-1 genotypes in various risk groups and regions across China based on a nationwide molecular epidemiologic survey[J]. PLoS One, 2012, 7(10): e47289. DOI:10.1371/journal.pone.0047289 |
| [18] |
Li XS, Xue YL, Zhou LM, et al. Evidence that HIV-1 CRF01_AE is associated with low CD4+T cell count and CXCR4 co-receptor usage in recently infected young men who have sex with men (MSM) in Shanghai, China[J]. PLoS One, 2014, 9(2): e89462. DOI:10.1371/journal.pone.0089462 |
| [19] |
Supervie V, Marty L, Lacombe JM, et al. Looking beyond the cascade of HIV care to end the AIDS epidemic:estimation of the time interval from HIV infection to viral suppression[J]. J Acquir Immune Defic Syndr, 2016, 73(3): 348-355. DOI:10.1097/QAI.0000000000001120 |
| [20] |
Volz EM, Le Vu S, Ratmann O, et al. Molecular epidemiology of HIV-1 subtype b reveals heterogeneous transmission risk:implications for intervention and control[J]. J Infect Dis, 2018, 217(10): 1522-1529. DOI:10.1093/infdis/jiy044 |
 2020, Vol. 41
2020, Vol. 41