文章信息
- 陈蓉, 李马超, 赵丽丽, 赵秀芹, 刘海灿, 刘志广, 鲁瑶, 邓云丽, 陈紫昕, 万康林, 袁秀琴.
- Chen Rong, Li Machao, Zhao Lili, Zhao Xiuqin, Liu Haican, Liu Zhiguang, Lu Yao, Deng Yunli, Chen Zixin, Wan Kanglin, Yuan Xiuqin
- 167株耐多药结核分枝杆菌药物敏感谱分析
- Analysis on drug sensitivity spectrum of 167 multidrug-resistant Mycobacterium tuberculosis in China
- 中华流行病学杂志, 2020, 41(5): 764-769
- Chinese Journal of Epidemiology, 2020, 41(5): 764-769
- http://dx.doi.org/10.3760/cma.j.cn112338-20191121-00823
-
文章历史
收稿日期: 2019-11-21
2. 中国疾病预防控制中心传染病预防控制所 传染病预防控制国家重点实验室 感染性疾病诊治协同创新中心, 北京 102206;
3. 温州医科大学检验医学院 生命科学院 325035
2. State Key Laboratory for Infectious Diseases Prevention and Control, Collaborative Innovation Center for Diagnosis and Treatment of Infectious Diseases, National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China;
3. School of Laboratory Medicine and Life Science, Wenzhou Medical University, Wenzhou 325035, China
目前结核病在全球范围仍然是一个重大的公共卫生问题,耐多药结核病(multidrug-resistant tuberculosis,MDR-TB)和广泛耐药结核病(extensively drug-resistant tuberculosis,XDR-TB)所导致的高死亡率尤其令人担忧。MDR-TB是指结核病患者感染的结核分枝杆菌至少同时对异烟肼(Isoniazid,INH)、利福平(Rifampicin,RIF)耐药。2018年全球结核病报告指出,2017年全球范围内,在MDR-TB患者中有8.5%为XDR-TB[1]。MDR-TB具有发现率低、治疗时间长、疗效差、患者死亡率高等特征,且未治愈的患者可作为传染源进一步传播耐药菌株,导致MDR-TB在全球范围内不断扩散、并导致XDR-TB的出现,给结核病的防控带来严峻挑战。北京基因型是全球结核病流行的主要基因型,有研究表明,北京基因型菌株能有效地传播[2]、增加毒力[3]和增加耐药风险[4-5],更有可能发展成MDR-TB[6-7]。我国是全球第二大结核病高负担国家[8]。在本研究中,对收集保存的MDR-TB临床分离菌株进行了基因型鉴定及13种临床常用的一、二线抗结核药物的药物敏感性检测,为临床上选择更加有效治疗方案、制定更为科学的MDR-TB防控策略提供依据。
材料与方法1.菌株来源:从中国CDC传染病预防控制所结核病室保存的9个省份临床送检菌株(福建22株、甘肃11株、广西17株、贵州17株、湖南23株、吉林23株、内蒙古22株、新疆12株、西藏23株)中,挑取已经比例法初步鉴定为MDR-TB的菌株,采用罗氏培养基进行传种复活后用于本研究。对菌株进行复苏、传代培养作为药物敏感性检测样本;选择结核分枝杆菌参考菌株H37Rv(ATCC27294)作为质控菌株。
2.药物敏感性检测试剂:药物敏感性检测采用微孔板药敏检测法,选择赛默飞世尔科技(中国)有限公司生产的结核分枝杆菌药敏检测板(MYCOTBI)用于最小抑菌浓度(Minimal Inhibitory Concentration,MIC)测定。MYCOTBI可检测结核分枝杆菌对12种临床常用一、二线抗结核药物的敏感性,包括INH、RIF、乙胺丁醇(Ethambutol,EMB)、链霉素(Streptomycin,SM)、利福布汀(Rifabutin,RFB)、乙硫异烟胺(Ethionamide,ETO)、环丝氨酸(Cycloserine,CS)、氧氟沙星(Ofloxacin,OFL)、莫西沙星(Moxifloxacin,MOX)、卡那霉素(Kanamycin,KAN)和阿米卡星(Amikacin,AMI)。
吡嗪酰胺(Pyrazinamide,PZA)药物敏感性试验采用WHO推荐的BACTECTM MGIT 960TM液体培养方法检测,BACTECTM MGIT 960TM全自动分析仪和PZA药敏试剂盒购于美国BD公司。
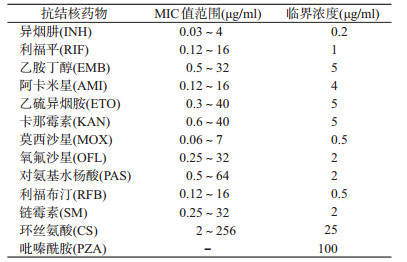
结核分枝杆菌药敏检测的临界浓度参考CLSI M24-A3批准的药敏实验解释标准[9](CS临界浓度参考MYCOTBI药敏板说明书)。见表 1。
3.药物敏感性检测:
(1)微孔板法药敏检测:根据结核分枝杆菌药敏板操作说明书进行,将配制好的菌悬液转移100 μl至每个孔中,密封平板并在37 ℃孵育14 d后由VizionTM数字观察系统辅助测量。MIC定义为与阳性对照相比没有明显可见细菌生长的最低浓度。
(2)PZA药敏检测:根据BACTECTM MGIT 960TM PZA试剂盒操作说明书进行,将配制好的菌悬液分别转移500 μl至对应的液体培养管中,再放入BACTECTMMGIT 960TM全自动分析仪培养4~13 d,根据生长单位(growthunit)值,分析仪自动报告药敏试验结果。
4.基因分型:
(1)DNA制备:刮取新鲜培养的菌落,水煮法制备DNA,-20 ℃保存备用。
(2)基因测序:通过扩增iysX基因、并与参考序列比对的方法,对MDR-TB菌株进行基因分型[10]。上游引物iysX-F:5′-CGGCCTATTGCATCACGA CGGCTC-3′,下游引物iysX-R:5′-GGCATCCCA TTGGGTCCGATAGGGG-3′;扩增体系(50 μl):25 μl 2×Taq Master Mix,引物各2 μl,DNA样品4 μl及水16 μl。反应条件:94 ℃ 5 min;94 ℃ 30 s,66 ℃ 30 s,72 ℃ 45 s,30个循环;72 ℃ 10 min;扩增产物为1 156 bp。PCR产物测序结果使用BioEdit软件与标准菌株H37Rv基因序列进行比对。密码子995发生突变(CCG→CCA)为北京基因型,未发生突变为非北京基因型;密码子701(ATT→ACT)和995密码子同时突变为现代北京基因型[10]。
5.统计学分析:使用Excel软件双录入,采用SPSS 21.0软件进行统计学分析,计数资料组间比较采用χ2检验,以P<0.05为差异有统计学意义。不同抗结核药物之间的耐药相关矩阵使用R软件(判断:|r|<0.4为低度相关,0.4<|r|<0.7为中度相关,|r|>0.7为高度相关)。
结果1. MDR-TB菌株的耐药情况:170株纳入本研究的菌株中,3株未能复活成功(甘肃2株、新疆1株),最终将167株纳入本研究结果分析。
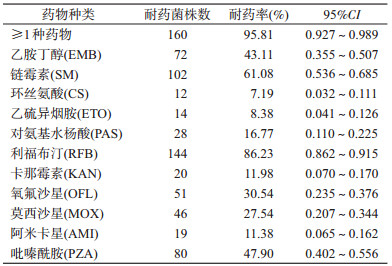
167株MDR-TB菌株对除INH、RIF外11种抗结核药物呈现高度耐药,总耐药率达到95.81%,耐药率从高到低依次为RFB(86.23%)、SM(61.08%)、PZA(47.90%)、EMB(43.11%)、OFL(30.54%)、MOX(27.54%)、PAS(16.77%)、KAN(11.98%)、AMI(11.38%)、ETO(8.38%)、CS(7.19%)。见表 2。
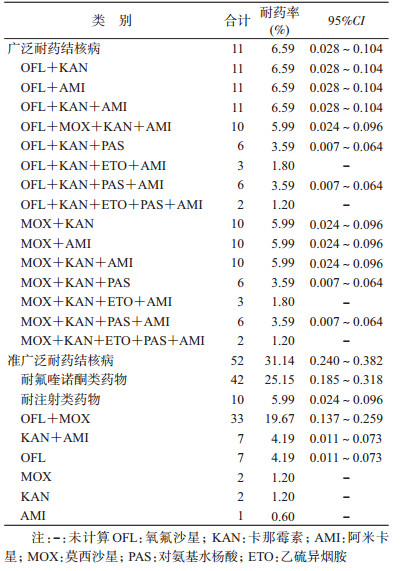
2.菌株耐药性分析:共检出XDR-TB 11株,占MDR-TB的6.59%;XDR-TB菌株中OFL耐药组合类型所占比例最高,共11株;在本研究中,对MOX耐药的XDR-TB菌株均对OFL耐药;对AMI耐药的XDR-TB菌株均对KAN耐药;pre-XDR菌株共52株,占MDR-TB的31.14%,氟喹诺酮类药物耐药为主要耐药形式,共42株,其中又以OFL+MOX耐药形式为主,共33株。见表 3。
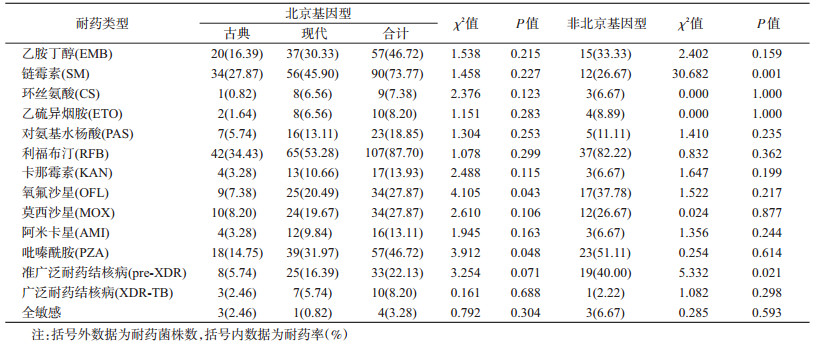
3. MDR-TB菌株基因型与药物敏感性分析:对lysX基因的测序结果进行比较,167株MDR-TB菌株中,北京基因型122株(73.05%),非北京基因型45株(26.95%)。北京基因型菌株中,古典北京基因型50株(40.98%),现代北京基因型72株(59.02%)。北京基因型SM耐药率高于非北京基因型,差异有统计学意义(χ2=30.682,P<0.05),非北京基因型pre-XDR发生率高于北京基因型,差异有统计学意义(χ2=5.332,P<0.05),此外,OFL耐药率与PZA耐药率在现代北京基因型与古典北京基因型中差异有统计学意义(χ2=4.105和χ2=3.912,P<0.05)。见表 4。
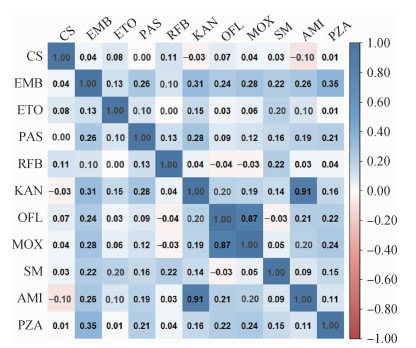
4.交叉耐药情况:不同抗结核药物耐药关联性分析发现,MDR-TB菌株中OFL耐药与MOX耐药有相关性(r=0.87)、KAN耐药与AMI耐药有相关性(r=0.91),关联程度较高;不同抗结核药物耐药相关性见图 1。
|
| 注:本研究选用MDR-TB菌株,相关矩阵不纳入INH和RIF;CS:环丝氨酸;EMB:乙胺丁醇;ETO:乙硫异烟胺;PAS:对氨基水杨酸;RFB:利福布汀;KAN:卡那霉素;OFL:氧氟沙星;MOX:莫西沙星;SM:链霉素;AMI:阿米卡星;PZA:吡嗪酰胺 图 1 不同抗结核药物耐药相关矩阵 |
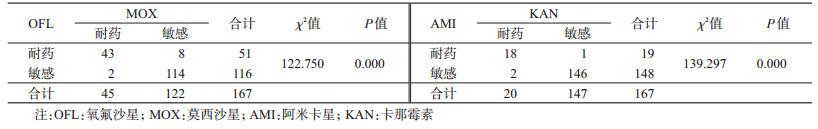
氟喹诺酮类药物耐药共53株,其中OFL耐药51株,MOX耐药45株,对二者同时耐药43株;关联性分析显示,OFL耐药与MOX耐药有关联性(χ2=122.750,P<0.05),r=0.87>0.7,高度相关。对注射类药物耐药共21株,其中KAN耐药20株,AMI耐药19株,对二者同时耐药18株;关联性分析显示,KAN耐药与AMI耐药有关联性(χ2=139.297,P<0.05),r=0.91>0.7,高度相关。见表 5。
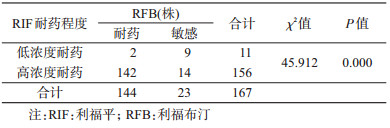
RFB耐药共144株,与RIF交叉耐药率为86.23%。将RIF分为低浓度耐药(MIC值为2~8 μg/ml)和高浓度耐药(MIC值≥16 μg/ml),RIF低浓度耐药与RFB交叉耐药率为18.18%(2/11),而高浓度RIF耐药与RFB交叉耐药率为91.03%(142/156);关联性分析显示,低浓度RIF耐药组与高浓度RIF耐药组之间RFB耐药率差异有统计学意义(χ2=45.912,P=0.000)。见表 6。
在本研究中,167株MDR-TB菌株对除INH、RIF外11种抗结核药物耐药率高达95.81%,整体耐药形势非常严峻。pre-XDR菌株所占比例低于印度的49.4%[10],pre-XDR菌株中,氟喹诺酮类药物耐药形式所占比例最高;XDR-TB菌株比例低于国内[11]、南非[12]及WHO的报告;氟喹诺酮类药物耐药是MDR-TB发展为pre-XDR甚至XDR-TB的主要形式,其耐药情况不容忽视。临床应开展快速准确的抗结核药物药敏试验,尽早发现MDR-TB及pre-XDR,并及时合理地治疗,阻止其向XDR-TB进展,减少XDR-TB的产生和传播。
本研究中,SM、EMB的耐药率低于国内其他报道[13],PZA耐药率高于其他研究[13],本研究中PZA耐药情况比较严峻。PZA、EMB、PAS和ETH均为作为长程MDR-TB治疗方案中的备选药物[14],在采用其他抗结核药物可以组成合理治疗方案的情况下,不推荐使用该类药物;选择EMB时需要考虑患者的用药史,尤其是复治患者,如果患者有长期使用EMB的情况,即使药敏结果敏感,也不推荐使用该药物。ETO是一种异烟酸衍生物类抗结核药物,其抗结核作用仅为INH的1/5,由于MDR-TB的流行,因此ETO成为MDR-TB化疗方案中一个基本组成部分[15]。CS耐药率与韩国报道的7.1%一致[16]。CS是治疗耐药结核病口服类药物中最为优先选择的药品[15],主要用于耐药尤其是MDR-TB和XDR-TB的治疗,与其他抗结核药物无交叉耐药。本研究中MDR-TB菌株中CS耐药率较低,表明CS在治疗MDR-TB中的重要作用,可在临床上推广使用。
北京基因型是全球结核病流行的主要基因型。在动物研究中北京基因型较其他基因型显示出更高的致病性和死亡率[17];一些研究表明北京基因型突变率高,是导致结核病耐药的优势菌株[18-19],更有可能发展成MDR-TB[6-7]。也有研究认为,北京基因型菌株与结核病耐药之间没有相关性[20]。在本研究中,北京基因型菌株占73.05%,表明在MDR-TB菌株中北京基因型的主导地位。不同基因型MDR-TB菌株与药物耐药率的比较,仅发现SM耐药与北京基因型有相关性,pre-XDR发生与非北京基因型有相关性,这可能是不同研究中北京基因型各亚型菌株比例的差异导致。本研究中,现代北京基因型菌株占59.02%,提示现代北京基因型菌株可能更容易在人群中传播。另外,本结果还显示,现代北京基因型OFL耐药率与PZA耐药率显著高于古典北京基因型,提示OFL耐药与PZA耐药同现代北京基因型关系更为密切。
本研究中RFB与RIF的交叉耐药率为86.23%,不同浓度RIF耐药菌株中RFB耐药率的差异有统计学意义,提示RIF和RFB交叉耐药现象随RIF耐药程度上升而增加。RFB与RIF存在高度交叉耐药,所以当结核分枝杆菌对RIF耐药时,应避免使用RFB。研究结果显示OFL、MOX的耐药率较高,这可能是因为氟喹诺酮类药物作为广谱类抗生素,经常被不规范用于临床抗感染治疗导致;且OFL耐药与MOX耐药高度相关。对于MDR-TB患者而言,应该谨慎使用氟喹诺酮类药物。有研究提示耐低代氟喹诺酮类药物的菌株使用高代氟喹诺酮类药物时,仍具有一定的抗菌活性[14]。本研究中一些MDR-TB菌株OFL耐药时对MOX仍敏感,因此对于低代氟喹诺酮类药物(如OFL)耐药的患者,无其他有效药物选择时可考虑使用高代氟喹诺酮类药物(如MOX),但不应将其作为MDR-TB化疗方案中的核心用药。氟喹诺酮类药物之间具有不完全交叉耐药,在条件允许的情况下,推荐临床根据患者药敏试验结果直接使用高代氟喹诺酮类药物如MOX等,确保疗效的同时降低氟喹诺酮类药物耐药概率,临床上也应加强氟喹诺酮类药物的规范管理及合理使用。本研究中,KAN或AMI呈高度交叉耐药,因此,建议已知对KAN和AMI其中一种药物耐药时,不主张使用另一种药物。SM、KAN和AMI均为注射类抗结核药物,注射类药物由于操作不便,患者依从性差,所以在有新药如贝达奎宁等的情况下,一般不推荐使用于MDR-TB的治疗;相比于SM和KAN,AMI对结核分枝杆菌的杀菌活性更高,不良反应小[15],对于复治、耐药结核病的患者中推荐使用AMI。
MDR-TB一直是结核病防控的重点和难点,在临床结核病治疗过程中开展快速准确的药敏谱检测,根据药敏试验制定合理的MDR-TB化疗方案,对于提高MDR-TB的治疗效果、减少MDR-TB的传播具有重要意义。本研究通过微孔板药敏法检测MDR-TB菌株对11种主要的一线及二线抗结核药物的耐药情况,为临床制定合理的MDR-TB治疗方案提供重要的参考依据。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
World Health Organization. Global tuberculosis report 2018[R]. Geneva: WHO, 2018.
|
| [2] |
Yang CG, Luo T, Sun GM, et al. Mycobacterium tuberculosis Beijing strains favor transmission but not drug resistance in China[J]. Clin Infect Dis, 2012, 55(9): 1179-1187. DOI:10.1093/cid/cis670 |
| [3] |
Hanekom M, van der Spuy GD, Streicher E, et al. A recently evolved sublineage of the Mycobacterium tuberculosis Beijing strain family is associated with an increased ability to spread and cause disease[J]. J Clin Microbiol, 2007, 45(5): 1483-1490. DOI:10.1128/JCM.02191-06 |
| [4] |
European Concerted Action on New Generation Genetic Markers and Techniques for the Epidemiology and Control of Tuberculosis. Beijing/W genotype Mycobacterium tuberculosis and drug resistance[J]. Emerg Infect Dis, 2006, 12(5): 736-743. DOI:10.3201/eid1205.050400 |
| [5] |
Casali N, Nikolayevskyy V, Balabanova Y, et al. Evolution and transmission of drug-resistant tuberculosis in a Russian population[J]. Nat Genet, 2014, 46(3): 279-286. DOI:10.1038/ng.2878 |
| [6] |
Buu TN, Huyen MN, Lan NTN, et al. The Beijing genotype is associated with young age and multidrug-resistant tuberculosis in rural Vietnam[J]. Int J Tubercul Lung Dis, 2009, 13(7): 900-906. |
| [7] |
Singh J, Sankar MM, Kumar P, et al. Genetic diversity and drug susceptibility profile of Mycobacterium tuberculosis isolated from different regions of India[J]. J Infect, 2015, 71(2): 207-219. DOI:10.1016/j.jinf.2015.04.028 |
| [8] |
World Health Organization. Global tuberculosis report 2016[R]. Geneva: WHO, 2016.
|
| [9] |
Clinical and Laboratory Standards Institute. Susceptibility testing of mycobacteria, nocardia spp., and other aerobic actinomycetes[M]. 3rd ed. CLSI, 2018.
|
| [10] |
Zhao LL, Xiao TY, Sun Q, et al. Mutations in lysX as the new and reliable markers for tuberculosis Beijing and modern Beijing strains[J]. Tuberculosis, 2016, 97: 33-37. DOI:10.1016/j.tube.2015.12.006 |
| [11] |
Zhao YL, Ou XC, Yu P, et al. National survey of drug-resistant tuberculosis in China[J]. N Engl J Med, 2012, 366(23): 2161-2170. DOI:10.1056/NEJMoa1108789 |
| [12] |
Said HM, Kock MM, Ismail NA, et al. Molecular characterization and second-line antituberculosis drug resistance patterns of multidrug-resistant Mycobacterium tuberculosis isolates from the northern region of South Africa[J]. J Clin Microbiol, 2012, 50(9): 2857-2862. DOI:10.1128/JCM.00358-12 |
| [13] |
Huang HR, Ding N, Yang TT, et al. Cross-sectional whole-genome sequencing and epidemiological study of multidrug-resistant Mycobacterium tuberculosis in China[J]. Clin Infect Dis, 2018, 69(3): 405-413. DOI:10.1093/cid/ciy883 |
| [14] |
中华医学会结核病学分会. 中国耐多药和利福平耐药结核病治疗专家共识(2019年版)[J]. 中华结核和呼吸杂志, 2019, 42(10): 733-749. Chinese Society for Tuberculosis of Chinese Medical Association. Chinese expert consensus on multidrug-resistant tuberculosis and Rifampicin-resistant tuberculosis treatment[J]. Chin J Tuberc Respir Dis, 2019, 42(10): 733-749. DOI:10.3760/cma.j.issn.1001-0939.2019.10.006 |
| [15] |
肖和平. 耐药结核病化学治疗指南(2019年简版)[J]. 中国防痨杂志, 2019, 41(10): 1025-1073. Xiao HP. Guidelines for chemotherapy of drug resistant tuberculosis[J]. Chin J Antituberc, 2019, 41(10): 1025-1073. DOI:10.3969/j.issn.1000-6621.2019.10.001 |
| [16] |
Mok JH, Kang BH, Lee T, et al. Additional drug resistance patterns among multidrug-resistant tuberculosis patients in Korea:implications for regimen design[J]. J Korean Med Sci, 2017, 32(4): 636-641. DOI:10.3346/jkms.2017.32.4.636 |
| [17] |
Parwati I, van crevel R, van Soolingen D. Possible underlying mechanisms for successful emergence of the Mycobacterium tuberculosis Beijing genotype strains[J]. Lancet Infect Dis, 2010, 10(2): 103-111. DOI:10.1016/S1473-3099(09)70330-5 |
| [18] |
Merker M, Kohl TA, Roetzer A, et al. Whole genome sequencing reveals complex evolution patterns of multidrug-resistant Mycobacterium tuberculosis Beijing strains in patients[J]. PLoS One, 2013, 8(12): e82551. DOI:10.1371/journal.pone.0082551 |
| [19] |
Pang H, Tong J, Liu HC, et al. Molecular characterization and drug-resistance of Mycobacterium tuberculosis strains in Xuzhou, China[J]. Biomed Environ Sci, 2014, 27(12): 960-964. DOI:10.3967/bes2014.136 |
| [20] |
Zhao LL, Li MC, Liu HC, et al. Beijing genotype of Mycobacterium tuberculosis is less associated with drug resistance in south China[J]. Int J Antimicrob Agents, 2019, 54(6): 766-770. DOI:10.1016/j.ijantimicag.2019.08.005 |
 2020, Vol. 41
2020, Vol. 41