文章信息
- 孟凡顺, 谌丁艳, 吴宇, 苏喆, 谢红卫, 周丽.
- Meng Fanshun, Chen Dingyan, Wu Yu, Su Zhe, Xie Hongwei, Zhou Li
- 深圳市学龄女童膳食模式和性早熟的相关性研究
- Study of relationship between dietary patterns and precocious puberty of school-age girls in Shenzhen
- 中华流行病学杂志, 2020, 41(5): 738-742
- Chinese Journal of Epidemiology, 2020, 41(5): 738-742
- http://dx.doi.org/10.3760/cma.j.cn112338-20190630-00478
-
文章历史
收稿日期: 2019-06-30
2. 深圳市疾病预防控制中心 518000;
3. 深圳市儿童医院 518000
2. Shenzhen City Center for Disease Control and Prevention, Shenzhen 518000, China;
3. Shenzhen Children's Hospital, Shenzhen 518000, China
性早熟是指女童在8岁之前性腺轴提前启动[1]。自19世纪中叶至20世纪中叶月经初潮年龄发生了下降,20世纪中叶至今乳房发育年龄和月经初潮年龄呈下降趋势[2]。随着生活水平的提高,健康、营养和卫生状况的改善,青春启动年龄不断提前,国内外性早熟的发病率呈现显著的逐年上升趋势,就诊人次和医疗成本成倍增加[3]。儿童性早熟已经成为儿童内分泌系统第二常见疾病[4]。研究报道多种因素和性早熟的发生具有相关性,但具体病因机制仍然不明。性早熟可对女童造成多种危害,如激素相关癌症、MS、全死因死亡率增加、患儿成年期的终身高受损[5]。膳食模式(food pattern)可将儿童的饮食行为半定量化或定量化,可较为细致和准确地评价饮食对于性早熟的影响。本研究通过病例-对照研究,采用膳食频率问卷调查(food-frequency questionnaire,FFQ)的方法[6],初步探讨饮食模式和性早熟是否相关。
对象与方法1.研究对象:选取2016年9月至2018年12月在深圳市某医院初次确诊为性早熟的部分患儿,均为新发病例,所有性早熟病例均由专科医师依据标准诊断。选取深圳市各区26所小学的6~10周岁、发育正常(无性器官及第二性征的发育,且性发育年龄未早于正常阈值)、无严重器质性病变的健康女童。进行1:1匹配,要求性别与病例组一致,年龄相差≤3个月。纳入和排除标准:病例纳入标准:女孩8岁前出现第二性征发育,女孩出现乳房结节为首发表现;骨龄超过实际年龄≥1岁;盆腔B超显示女孩子宫、卵巢容积增大,且卵巢内可见多个直径>4 mm的卵泡;血清促性腺激素及性激素达青春期水平;女孩性腺轴未启动,但合并>2项的性发育指标异常。病例排除标准:中枢神经系统先天畸形病变;中枢系统的肿瘤;非中枢系统异常:肉芽肿性疾病、脑性瘫痪等。对照纳入标准:发育正常(第二性征均未发育,无月经来潮);无严重器质性病变及内分泌系统疾病。对照排除标准同病例组。
2.调查内容:包括儿童的基本情况(姓名、性别、身高、体重等)、家庭情况、环境暴露、饮食习惯。膳食调查儿童过去1年内日常是否吃过某种食物,估计食用频率(次/d、次/周、次/月、次/年)。膳食模式为多种形式结合的、人们实际生活中所食用的食物成分的组合,其将几种食物或食物组归位一个广义的变量。本研究共调查12种食物种类,包括粮谷类、畜肉、海产品(鱼虾)、豆或豆制品、坚果类、油炸食品、洋快餐、新鲜蔬菜、新鲜水果、奶及奶制品、果汁饮料、补品和营养品。定义膳食模式的方式为公因子中载荷较大的多种食物种类。本研究经深圳市CDC伦理委员会批准(批准文号:SZCDC2016002)。所有儿童的父母均签署知情同意书。
3.调查方法:病例问卷调查者为课题组统一培训的调查员,问卷在医院通过询问患儿家长来完成。对照样本问卷收集通过班主任发放自制的调查问卷连同详细的填写说明,由家长进行填写,并由班主任、校医隔日回收,课题组成员进行核对,对严重缺漏项问卷发回给家长重填,保证问卷调查质量。
4.样本量的估计:本研究为成组资料比较而且人数相等,根据文献[5]取p0=0.1,OR=2.0,α=0.05,β=0.10。根据各指标的关系:q0=1-p0,q1=1-p1,p=(p0+p1)/2,q=1-p,p1=(OR×p0)/(1-p0+OR×p0),求得n=185,最终纳入病例组和对照组各284人。
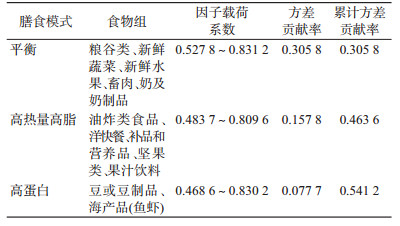
5.膳食行为的构建和分析:将膳食部分共涉及的12类食物的摄入频率标准化为次/d。采用探索性因子分析的方法将全部食物组纳入模型,并对初始因子进行因子旋转。根据实质重要性原则、Kaiser(1974)特征值原则、Cattel(1965)碎石图原则提取公因子。根据食物特点结合专业知识对公因子命名。计算因子得分,根据因子得分四分位数将调查对象进行分组,由低到高依次是Q1、Q2、Q3、Q4组。
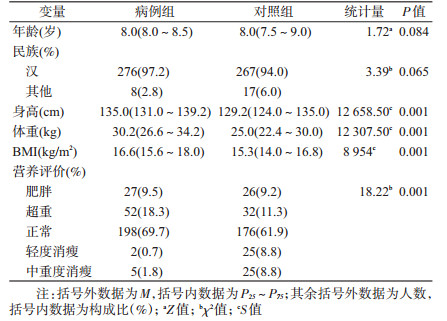
6.指标与定义:年龄计算方法以半岁为单位,使用实足年龄。实足年龄计算:调查日期减去出生日期,指的是从出生到计算时为止共经历的周年数。营养评价(mini nutritional assessment,MNA)根据《WS/T 586-2018学龄儿童青少年超重与肥胖筛查》中6~18岁学龄儿童青少年BMI筛查超重与肥胖界值表以及《WS/T 456-2014学龄儿童青少年营养不良筛查》进行判断。
7.统计学分析:使用EpiData 3.1软件建立数据库进行数据录入,核对数据无误后锁定数据库。采用R3.5.2软件对数据进行统计学分析。组间年龄比较采用两独立样本t检验,民族的比较采用配对χ2检验,身高、体重、BMI采用符号秩检验。MNA采用单向有序资料的χ2检验。病例对照摄入频率的比较采用符号秩检验。采用因子分析提取膳食模式,因子旋转时采用斜交旋转的方法,寻找因子模式矩阵,使之最接近简单结构,同时保证因子数量和变量的共同值保持不变。3种膳食模式组间比较采用χ2检验。使用条件二分类logistic回归分析膳食模式和性早熟的关联性,入选标准为0.10,剔除标准为0.15。
结果1.基本情况:共纳入研究对象568人。其中8岁组年龄人数最多(43.9%),6岁组(4.0%)和10岁组(0.5%)人数较少。见表 1。根据年龄进行病例对照匹配,结果显示病例组和对照组实足年龄的中位数相同,均为8.0岁,2组民族差异无统计学意义(P>0.05)。病例组的身高(135.0 cm)、体重(30.2 kg)和BMI(16.6 kg/m2)均高于对照组(129.2 cm、25.0 kg、15.3 kg/m2),差异有统计学意义(P<0.05)。2组在MNA方面差异也有统计学意义(P<0.05)。见表 2。
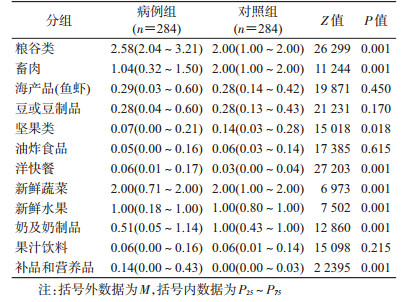
2.各类食物摄入频率的比较:在粮谷类、洋快餐、补品和营养品摄入频率上病例组高于对照组;在畜肉、坚果类、新鲜蔬菜、新鲜水果、奶及奶制品摄入上对照组高于病例组,差异均有统计学意义(P<0.05)。在海产品(鱼虾)、豆或豆制品、油炸食品、果汁饮料摄入频率上2组差异均无统计学意义(P>0.05)。见表 3。
3.膳食模式:根据因子分析法原则进行分析,共提取3个公因子。平衡、高热量高脂、高蛋白3种膳食模式的累计方差贡献率为0.541 2。因子载荷阵见表 4。
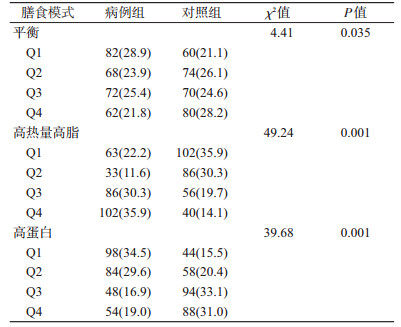
4.组间膳食模式比较:平衡、高热量高脂、高蛋白膳食模式在2组间差异均有统计学意义(P<0.05)。见表 5。
5.性早熟的logistic回归分析:调整年龄、MNA,logistic回归分析结果显示,平衡膳食模式(OR=0.633,95%CI:0.504~0.769)及高蛋白膳食模式(OR=0.622,95%CI:0.498~0.776)是性早熟的保护因素,高热量高脂膳食模式是性早熟的危险因素(OR=1.850,95%CI:1.461~2.342)。
讨论流行病学调查显示性发育进程时间和饮食摄入密切相关。儿童摄入较高植物性蛋白较摄入动物性蛋白者,其青春发动年龄相差晚7个月[7-8],此外高膳食纤维摄入者有较晚的月经初潮年龄[9]。本研究采用病例对照研究方法,采用年龄进行匹配,结果发现病例组超重/肥胖率要高于对照组,侧面反映出超重和肥胖是性早熟的危险因素,与国内外研究结果一致[3, 8, 10-12]。
本研究共定义了3种膳食模式:平衡、高热量高脂、高蛋白[13]。平衡膳食是女童的主要的膳食模式,提示深圳市学龄女童大部分有较健康的饮食习惯。病例组较多存在高热量高脂、高蛋白的饮食习惯。
多因素分析显示,高热量高脂饮食是性早熟的危险因素,而相对平衡和高蛋白膳食模式是性早熟的保护因素,提示较多摄入粮谷类、畜肉、新鲜蔬菜、新鲜水果、奶及奶制品的食物以及鱼虾或豆制品将有利于儿童的正常的生长发育。有证据显示膳食对体内的激素水平产生一定影响,Peeters等[14]研究表明在青春期或成年期摄入较高的异黄酮类物质(主要存在于蔬菜和水果中)对女性的乳腺癌的发生是一个保护因素。吕红仙[4]的研究显示膳食结构的改变可改善性早熟儿童性激素水平与第二性特征。Chen等[7]的研究显示调整年龄和BMI后不健康的饮食模式(与本研究高热量高脂饮食一致)是性早熟的危险因素(OR=1.25,95%CI:1.04~1.49),但其未发现传统饮食(与本例平衡膳食模式一致)是性早熟的保护因素。Aubertin-Leheudre等[15]的研究显示摄入较多脂肪可影响雌激素代谢进而影响青春发动时相。多项研究显示较多摄入动物性蛋白与早初潮及阴毛发育等性早熟特征相关[16]。
探究性早熟女童的日常膳食行为有助于针对性的制定干预措施,以便更好地进行性早熟的三级预防。膳食因素是一个可以控制和改变的重要影响因素,学龄儿童应从小养成平衡膳食的习惯,尽量避免高热量高脂饮食。此外提倡多摄入豆类及鱼类,有利于学龄儿童的正常生长发育。
本研究存在局限性。首先,研究存在一定的选择偏倚和信息偏倚,前者主要是由于在研究设计阶段病例选择仅为深圳市某医院一家,病例患儿对医院具有选择性所致;后者主要是由于在研究的实施过程中由于家长的心理状态和记忆力等因素对于膳食频率的填写不准确可能导致的信息偏倚。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
中华预防医学会妇女保健分会青春期学组. 女性性早熟的诊治共识[J]. 中国妇幼健康研究, 2018, 29(2): 135-138. Adolescent Health Care Croup of Women Health Care Society, China Preventive Medicine Association. Consensus on diagnosis and treatment of female precocious puberty[J]. Chin J Women Child Health Res, 2018, 29(2): 135-138. DOI:10.3969/j.issn.1673-5293.2018.02.001 |
| [2] |
Lomenick JP, Calafat AM, Castro MSM, et al. Phthalate exposure and precocious puberty in females[J]. J Pediatr, 2010, 156(2): 221-225. DOI:10.1016/j.jpeds.2009.09.047 |
| [3] |
Heo JS, Moon HS, Kim MK. A study on dietary habits and lifestyle of girls with precocious puberty[J]. Pediatr Gastroenterol Hepatol Nutr, 2016, 19(2): 130-138. DOI:10.5223/pghn.2016.19.2.130 |
| [4] |
吕红仙. 儿童性早熟日常膳食习惯分析与干预效果研究[J]. 中国妇幼保健, 2015, 30(18): 2977-2979. Lyu HX. Dietary habits in children with precocious puberty analysis and study on the effect of intervention[J]. Matern Child Health Care China, 2015, 30(18): 2977-2979. DOI:10.7620/zgfybj.j.issn.1001-4411.2015.18.29 |
| [5] |
Winter S, Durand A, Brauner R. Precocious and early central puberty in children with pre-existing medical conditions:a single center study[J]. Front Pediatr, 2019, 7: 35. DOI:10.3389/fped.2019.00035 |
| [6] |
de Cassia Ribeiro Silva R, Assis AMO, Cruz AA, et al. Dietary patterns and wheezing in the midst of nutritional transition:a study in brazil[J]. Pediatr Allergy Immunol Pulmonol, 2013, 26(1): 18-24. DOI:10.1089/ped.2012.0182 |
| [7] |
Chen C, Chen Y, Zhang YT, et al. Association between dietary patterns and precocious puberty in children:a population-based study[J]. Int J Endocrinol, 2018, 2018: 4528704. DOI:10.1155/2018/4528704 |
| [8] |
Cheng G, Buyken AE, Shi LJ, et al. Beyond overweight:nutrition as an important lifestyle factor influencing timing of puberty[J]. Nutr Rev, 2012, 70(3): 133-152. DOI:10.1111/j.1753-4887.2011.00461.x |
| [9] |
Poli F, Pizza F, Mignot E, et al. High prevalence of precocious puberty and obesity in childhood narcolepsy with cataplexy[J]. Sleep, 2013, 36(2): 175-181. DOI:10.5665/sleep.2366 |
| [10] |
Ko JH, Lee HS, Lim JS, et al. Changes in bone mineral density and body composition in children with central precocious puberty and early puberty before and after one year of treatment with GnRH agonist[J]. Horm Res Paediatr, 2011, 75(3): 174-179. DOI:10.1159/000320039 |
| [11] |
Rosenfield RL, Lipton RB, Drum ML. Thelarche, pubarche, and menarche attainment in children with normal and elevated body mass index[J]. Pediatrics, 2009, 123(1): 84-88. DOI:10.1542/peds.2008-0146 |
| [12] |
Latronico AC, Brito VN, Carel JC. Causes, diagnosis, and treatment of central precocious puberty[J]. Lancet Diabetes Endocrinol, 2016, 4(3): 265-274. DOI:10.1016/S2213-8587(15)00380-0 |
| [13] |
Zhang XY, Shu L, Si CJ, et al. Dietary patterns, alcohol consumption and risk of coronary heart disease in adults:a Meta-analysis[J]. Nutrients, 2015, 7(8): 6582-6605. DOI:10.3390/nu7085300 |
| [14] |
Peeters PHM, Keinan-Boker l, van der Schouw YT, et al. Phytoestrogens and breast cancer risk[J]. Breast Cancer Res Treat, 2003, 77(2): 171-183. DOI:10.1023/A:1021381101632 |
| [15] |
Aubertin-Leheudre M, Gorbach S, Woods M, et al. Fat/fiber intakes and sex hormones in healthy premenopausal women in USA[J]. J Steroid Biochem Mol Biol, 2008, 112(1/3): 32-39. DOI:10.1016/j.jsbmb.2008.08.002 |
| [16] |
Villamor E, Jansen EC. Nutritional determinants of the timing of puberty[J]. Annu Rev Public Health, 2016, 37: 33-46. DOI:10.1146/annurev-publhealth-031914-122606 |
 2020, Vol. 41
2020, Vol. 41