文章信息
- 王铜, 陶晓霞, 孟凡亮, 李心朋, 小野久弥, 王多, 胡东良, 张建中, 王国庆, 闫笑梅.
- Wang Tong, Tao Xiaoxia, Meng Fanliang, Li Xinpeng, Ono-Hisaya, Wang Duo, Hu Dongliang, Zhang Jianzhong, Wang Guoqing, Yan Xiaomei
- 重组缩短的葡萄球菌类肠毒素X蛋白克隆表达及催吐活性评价
- Cloning and expression of recombinant truncated SElX protein and evaluation on the related emetic activities
- 中华流行病学杂志, 2020, 41(4): 567-570
- Chinese Journal of Epidemiology, 2020, 41(4): 567-570
- http://dx.doi.org/10.3760/cma.j.cn112338-20191010-00724
-
文章历史
收稿日期: 2019-10-10
2. 传染病预防控制国家重点实验室, 感染性疾病诊治协同创新中心, 中国疾病预防控制中心传染病预防控制所, 北京 102206;
3. 山东省疾病预防控制中心, 济南 250014;
4. 弘前大学大学院医学研究科, 弘前 036-8562, 日本;
5. 北里大学兽医学部, 十和田 034-8628, 日本
2. State Key Laboratory of Infectious Disease Prevention and Control, Collaborative Innovation Center for Diagnosis and Treatment of Infectious Diseases, National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China;
3. Shandong Center for Disease Control and Prevention, Jinan 250014, China;
4. Hirosaki University Graduate School of Medicine, Hirosaki 036-8562, Japan;
5. Kitasato University School of Veterinary Medicine, Towada 034-8628, Japan
金黄色葡萄球菌肠毒素是一种分泌蛋白,通常具有催吐活性和超抗原活性。依据肠毒素国际命名原则,可以引起哺乳动物呕吐的毒素被命名为肠毒素,不能引起呕吐或未测定催吐活性的毒素则命名为类肠毒素[1]。目前已知19种肠毒素和5种类肠毒素,由肠毒素引起的食物中毒是食品安全问题的重要关注点之一。葡萄球菌类肠毒素X(Staphylococcal enterotoxin-like toxin X,SElX)是2011年发现的一种新型类肠毒素,具有超抗原活性,但其催吐活性还没有得到证实[2-3]。本课题组前期通过基因组测序方法,从一起食物中毒暴发事件相关菌株中发现了与SElX第111~203位氨基酸高度同源的蛋白序列,命名为缩短的SElX(truncated SElX,tSElX)。启动子序列预测结果表明,编码该蛋白的基因存在启动子区域,推测其可以表达。由于基因组序列分析未发现该菌株携带已知肠毒素及类肠毒素,且食物中毒患者具有呕吐症状,故提示tSElX可能具有催吐活性。本研究利用大肠杆菌重组表达系统进行tSElX克隆表达,并通过哺乳动物试验,对其催吐活性进行评价。
材料与方法 1 研究材料(1)菌株及培养基:tselx扩增用菌株DC51617和原核表达载体pET-28a(+)由中国CDC传染病预防控制所保存,原核表达载体pGEX-6p-1质粒购自美国GE公司,pMD18-T载体购自日本TaKaRa公司。pGEX-6p-1和pET-28a(+)质粒的筛选平板分别为含氨苄青霉素(100 μg/ml)和卡那霉素(50 μg/ml)的LB培养基。
(2)主要试剂和仪器:IPTG、氨苄青霉素、卡那霉素和质粒小提试剂盒购自中国北京全式金生物技术有限公司。限制性内切酶购自日本TaKaRa公司。Bradford蛋白定量试剂盒和尿素等化学试剂购自中国北京索莱宝科技有限公司。PCR仪购自德国sensoquest公司。
2 研究方法(1)tSElX氨基酸多态性分析:根据食物中毒相关菌株全基因组测序结果,基因组注释软件预测tSElX编码基因tselx共282 bp。将tselx序列与本课题组前期完成的145株CC398菌株基因组序列进行比对分析。将tSElX氨基酸序列与NCBI数据库进行比对(https://blast.ncbi.nlm.nih.gov/Blast.cgi)。
(2)重组表达质粒的构建:①目的基因的扩增:根据tselx序列设计上下游引物。上游引物:5′-CC CCGGATCCTATACACCTAAGAGGAA-3′,下游引物:5′- CCCCGAATTCTCAAACTTGTTCAATGTC- 3′。上下游引物5′端分别引入保护碱基和BamHⅠ和EcoRⅠ的酶切位点。扩增体系为25 μl,包括:上下游引物(10 μmol/L)各1 μl,2×Taq Transart Pfu supermix 12.5 μl,DNA模板2 μl,补水至25 μl。扩增条件:94 ℃ 5 min,1个循环;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 45 s,30个循环;72 ℃ 7 min,1个循环。②重组质粒表达载体的构建:PCR产物纯化后连接到T载体上,鉴定阳性的质粒进行测序。表达载体pGEX-6P-1和pET-28a(+)与经测序正确的重组T载体质粒同时用BamH Ⅰ和EcoR Ⅰ进行酶切,将目的片段连接到表达载体上,并分别转入E.coli BL21和DH5α感受态菌中,在含氨苄/卡那霉素的LB固体培养基中进行筛选,进行菌落PCR和双酶切鉴定。
(3)重组蛋白诱导表达:对诱导条件进行优化,PGEX-6P-1-tselx分别选择IPTG浓度为0.5 mmol/L,37 ℃诱导4 h;浓度为0.1 mmol/L,选取32 ℃和25 ℃,分别诱导6、8和10 h;浓度为0.5 mmol/L和0.1 mmol/L,16 ℃过夜。pET-28a(+)-tselx用0.1 mmol/L IPTG、16 ℃过夜诱导。采用PAGE分析蛋白表达。
(4)重组蛋白包涵体变性、复性和浓缩:对pET-28a(+)载体表达的重组蛋白包涵体进行变性、复性。包涵体沉淀用含8 mol/L尿素和20 mmol/L咪唑的溶液进行室温溶解,收集上清。溶解后的重组蛋白用纯化柱进行纯化。将纯化后的重组蛋白装入3K透析袋,依次用浓度为6、4、2、1、0.5和0 mol/L的尿素透析液透析,收集上清。选择3K的超滤管对蛋白进行浓缩,并进行蛋白浓度检测。
(5)催吐活性动物试验:此试验在日本完成。所有动物实验均经弘前大学医学院动物研究伦理委员会批准(批准文号:M 10037),并遵循弘前大学动物实验指南。肠毒素SEA作为阳性对照。在禁食16 h后,将普通狨猴麻醉。将tSElX和SEA溶于1.5 ml无菌PBS中,经口胃插管,以50或者250 μg/kg的剂量喂饲。毒素喂饲后,对动物的首次呕吐反应的潜伏期、呕吐次数及其行为变化进行评估。
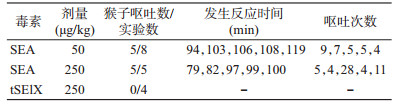
结果1. tSElX氨基酸多态性分析:将tselx序列与本课题组前期完成的145株CC398菌株基因组序列进行比对分析发现,我国不同来源(患者、健康人群和动物)的145株CC398菌株均存在tselx基因,其核酸及氨基酸序列同源性为100.0%。将tSElX氨基酸序列与NCBI数据库进行比对,共获得4条氨基酸序列不同的tSElX序列。菌株号分别为09S01694(GenBankEZU00153.1)、R0487(GenBankEZY724 15.1)、C2679(GenBankEZX35531.1)、VET0779S(GenBankKAG23863.1)。这4株菌均为美国ST398耐甲氧西林金黄色葡萄球菌,与我国CC398克隆群菌株的tSElX氨基酸序列同源性较高,为97.8%(1株)和98.9%(3株)。09S01694菌株末端2个氨基酸缺失,其余菌株仅存在1个突变位点,突变位点分别位于第30、40、67个氨基酸(图 1)
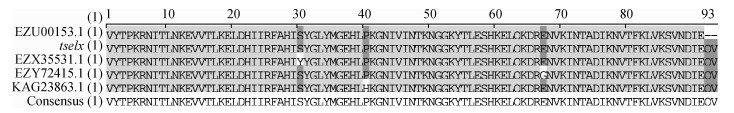
|
| 图 1 tSElX氨基酸多态性分析结果 |
2. tselx重组质粒的鉴定:tselx以DC51617为模板,PCR产物与T载体连接成功后,基因测序结果表明tselx基因全长282 bp,无碱基插入或缺失,无点突变。将测序正确的目的片段分别与表达载体pGEX-6P-1和pET-28a(+)连接转化成功后,分别提取质粒进行双酶切鉴定,结果除质粒条带外,在280 bp左右有1条目的条带与tselx基因大小相同(图 2),提示重组表达载体pGEX-6P-1-tselx及pET-28a(+)-tselx构建成功。
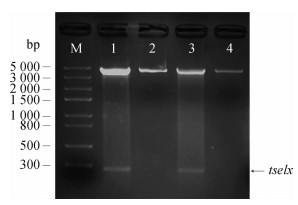
|
| 注:M为5K Marker;1:pET-28a(+)-tselx;2:pET-28a(+);3:pGEX-6P-1-tselx;4:pGEX-6P-1 图 2 重组质粒双酶切鉴定结果 |
3. tSElX重组蛋白诱导表达及包涵体变性、复性:采用pGEX-6P-1及pET-28a(+)两套表达系统。通过两套表达系统及摸索条件tSElX均以包涵体形式表达。用pET-28a(+)-tselx进行包涵体的变性、复性。包涵体用8 mol/L尿素重悬,沉淀溶解,见图 3泳道1。纯化后,在10 kDa左右可见单一条带,为目的蛋白tSElX,见图 3泳道2。在随后的梯度复性过程中,当尿素浓度降为0 mol/L的时候,有大量沉淀析出,收集上清部分,经SDS-PAGE鉴定,得到了纯度较高的可溶性tSElX蛋白。

|
| 注:M为10~180 kDa Marker;1:变性蛋白;2:纯化后蛋白;3:复性后蛋白;4:超滤后蛋白 图 3 tSElX包涵体蛋白变性、纯化和复性SDS-PAGE |
4.催吐活性评价:以SEA作为阳性对照,当剂量为50 μg/kg时,8只猴子中有5只出现呕吐,初次呕吐时间为94~119 min,呕吐频率为4~9次;当剂量为250 μg/kg,测试的5只猴子全部出现呕吐,初次呕吐时间缩短为79~100 min,呕吐频率增加到4~11次。tSELX作为测试蛋白,在观察时间内,当剂量为250 μg/kg时,4只猴子均无呕吐反应。见表 1。
本研究结果显示,tselx存在于我国不同来源的CC398克隆群菌株,与NCBI数据库比对后,证实了该基因目前仅存在于该克隆群的菌株中。该蛋白的氨基酸序列保守性较高,我国菌株序列与国外菌株比较,仅存在个别突变位点。
本研究发现tSElX用原核表达系统进行表达时,只能以包涵体的形式表达。由于完整的SElX可以可溶性表达[3],而tSElX不能可溶性表达的原因,推测可能与其N端的缺失,空间构象改变,表达量过高,影响中间体稳定的各种未知因素等有关[4]。包涵体的复性有不同的方法,包括稀释法[5]、透析法[6-8]、滤过法[9]和色谱方法[10]。本实验在复性时发现蛋白会有不同程度的析出,表明一些蛋白没有正确折叠恢复活性。影响复性效果的因素除了复性方法有所不同外,化学添加剂、复性样品浓度、透析时间和温度、pH值以及溶剂的类型等对包涵体的增溶和复性都有显著的影响[11-12]。化学添加剂有助于蛋白质的高效复性[5],如甘油可以增加疏水作用,稳定蛋白质构象。本研究结果显示,针对tSElX蛋白的复性,在溶剂中加入甘油,使用低浓度蛋白,且在4 ℃条件下延长透析时间,可以获得较好的复性效果。
Bergdoll[13]利用灵长类动物做肠毒素催吐模型,被公认为是肠毒素的标准呕吐模型。然而,由于高成本,导致使用该模型作为肠毒素催吐动物模型的研究减少。Ono等[14]应用与人类亲缘关系更近、更便宜的普通绒候,作为肠毒素呕吐动物模型。本研究通过普通狨猴催吐试验,当剂量为250 μg/kg时,tSElX不能引起呕吐反应。在这些食物中毒菌株中,是否存在其他潜在肠毒素,还值得深入发掘。既往研究表明,SElX具有超抗原活性。它的第154、156和169位氨基酸是与中性粒细胞相结合的重要位点,与坏死性肺炎的致病相关[15]。tSElX在第111个氨基酸后与SElX相似性达到97%以上,是否tSElX也具有超抗原活性,将会在后续试验进行验证。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Lina G, Bohach GA, Nair SP, et al. Standard nomenclature for the superantigens expressed by Staphylococcus[J]. J Infect Dis, 2004, 189(12): 2334-2336. DOI:10.1086/420852 |
| [2] |
Langley RJ, Ting YT, Clow F, et al. Staphylococcal Enterotoxin-Like X (SElX) is a unique superantigen with functional features of two major families of staphylococcal virulence factors[J]. PLoS Pathog, 2017, 13(9): e1006549. DOI:10.1371/journal.ppat.1006549 |
| [3] |
Wilson GJ, Seo KS, Cartwright RA, et al. A novel core genome-encoded superantigen contributes to lethality of community-associated MRSA necrotizing pneumonia[J]. PLoS Pathog, 2011, 7(10): e1002271. DOI:10.1371/journal.ppat.1002271 |
| [4] |
邝爱丽, 陈圆圆, 彭志峰, 等. 包涵体的形成原因及其处理方法[J]. 上海畜牧兽医通讯, 2009(1): 62-63. Kuang AL, Chen YY, Peng ZF, et al. The causes of the formation of inclusion bodies and their treatment[J]. Shanghai J Anim Husb Vet Med, 2009(1): 62-63. DOI:10.3969/j.issn.1000-7725.2009.01.041 |
| [5] |
Yamaguchi H, Miyazaki M. Refolding techniques for recovering biologically active recombinant proteins from inclusion bodies[J]. Biomolecules, 2014, 4(1): 235-251. DOI:10.3390/biom4010235 |
| [6] |
Sørensen HP, Sperling-Petersen HU, Mortensen KK. Dialysis strategies for protein refolding:preparative streptavidin production[J]. Protein Expr Purif, 2003, 31(1): 149-154. DOI:10.1016/s1046-5928(03)00133-5 |
| [7] |
罗巧, 李霜君, 肖彤洋, 等. 结核分枝杆菌4种新抗原的克隆表达及血清学评价[J]. 中华流行病学杂志, 2018, 39(4): 514-518. Luo Q, Li SJ, Xiao TY, et al. Cloning expression and serological evaluation on Mycobacterium tuberculosis four new antigens[J]. Chin J Epidemiol, 2018, 39(4): 514-518. DOI:10.3760/cma.j.issn.0254-6450.2018.04.026 |
| [8] |
李晓琴, 肖彤洋, 李马超, 等. 结核分枝杆菌Dnak和MPT83蛋白的抗原性评价[J]. 中华微生物学和免疫学杂志, 2019, 39(2): 106-113. Li XQ, Xiao TY, Li MC, et al. Evaluation of the antigenicity of Dnak and MPT83 proteins of Mycobacterium tuberculosis[J]. Chin J Microbiol Immunol, 2019, 39(2): 106-113. DOI:10.3760/cma.j.issn.0254-5101.2019.02.005 |
| [9] |
Yoshii H, Furuta T, Yonehara T, et al. Refolding of denatured/reduced lysozyme at high concentration with diafiltration[J]. Biosci Biotechnol Biochem, 2000, 64(6): 1159-1165. DOI:10.1271/bbb.64.1159 |
| [10] |
Gu ZY, Weidenhaupt M, Ivanova N, et al. Chromatographic methods for the isolation of, and refolding of proteins from, Escherichia coli inclusion bodies[J]. Protein Expr Purif, 2002, 25(1): 174-179. DOI:10.1006/prep.2002.1624 |
| [11] |
Esmaili I, Sadeghi HMM, Akbari V. Effect of buffer additives on solubilization and refolding of reteplase inclusion bodies[J]. Res Pharm Sci, 2018, 13(5): 413-421. DOI:10.4103/1735-5362.236834 |
| [12] |
郭帅, 陈梦仟, 朱新术, 等. 大肠杆菌表达的重组琼胶酶包涵体的纯化与复性条件研究[J]. 基因组学与应用生物学, 2018, 37(3): 1197-1202. Guo S, Chen MQ, Zhu XS, et al. Purification and renaturation of recombinant agarase from inclusion body expressed by Escherichia coli[J]. Genomics Appl Biol, 2018, 37(3): 1197-1202. DOI:10.13417/j.gab.037.001197 |
| [13] |
Bergdoll MS. Monkey feeding test for staphylococcal enterotoxin[J]. Methods Enzymol, 1988, 165: 324-333. DOI:10.1016/S0076-6879(88)65048-8 |
| [14] |
Ono HK, Omoe K, Imanishi K, et al. Identification and characterization of two novel staphylococcal enterotoxins, types S and T[J]. Infect Immun, 2008, 76(11): 4999-5005. DOI:10.1128/IAI.00045-08 |
| [15] |
Tuffs SW, James DBA, Bestebroer J, et al. The Staphylococcus aureus superantigen SElX is a bifunctional toxin that inhibits neutrophil function[J]. PLoS Pathog, 2017, 13(9): e1006461. DOI:10.1371/journal.ppat.1006461 |
 2020, Vol. 41
2020, Vol. 41