文章信息
- 张力, 金鹏飞, 李靖欣, 朱凤才.
- Zhang Li, Jin Pengfei, Li Jingxin, Zhu Fengcai
- 检测阴性设计在疫苗效果评价中的应用
- Application of test-negative design in vaccine efficacy evaluation
- 中华流行病学杂志, 2020, 41(2): 280-283
- Chinese Journal of Epidemiology, 2020, 41(2): 280-283
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2020.02.024
-
文章历史
收稿日期: 2019-06-19
2. 江苏省疾病预防控制中心疫苗临床评价所, 南京 210009;
3. 江苏省疾病预防控制中心国家卫生健康委员会肠道病原微生物重点实验室, 南京 210009
2. Department of Vaccine Clinical Evaluation, Jiangsu Provincial Center for Disease Control and Prevention, Nanjing 210009, China;
3. National Health Commission Key Laboratory of Enteric Pathogenic Microbiology, Jiangsu Provincial Center for Disease Control and Prevention, Nanjing 210009, China
疫苗上市前,安慰剂-随机对照试验是评价其效力/效果的“金标准”。但疫苗上市后,出于伦理学方面的考虑,将无法采用安慰剂-随机对照试验评价疫苗的效果[1]。不仅如此,对于上市后疫苗的效果评价,可能还存在试验设计、实验方法、疾病诊断和安全性监测等问题。因此,疫苗上市后的效果评价一直是公共卫生领域面临的难题。
近10年来,“检测阴性设计”(test-negativedesign)方法被广泛用于疫苗上市后的效果评价。检测阴性设计方法最先于1980年用于肺炎疫苗的效果评价[2],直到2005年,加拿大的研究人员在英属哥伦比亚地区使用检测阴性设计评价季节性流感疫苗的效果[3],至此才被人们所关注,并逐渐成为评价上市之后季节性流感疫苗效果的首选方法,而且,也逐渐扩展到其他上市后疫苗效果的评价中,例如肺炎疫苗[4-5]、轮状病毒疫苗[6-7]、霍乱疫苗[8-9]和EV71疫苗[10]。在一些发达国家,如美国、加拿大、澳大利亚、新西兰和日本等[11],也已经广泛开展检测阴性设计在上市后疫苗的评价工作。目前国内还很少有使用检测阴性设计来评价疫苗效果的文献报道,因此,对检测阴性设计方法作简要的介绍。
1.基本原理:检测阴性设计是基于医疗服务机构的就诊人群,将符合某种或某些临床症状或特征的疑似病例均纳入研究,通过特异性的实验室检测进行确诊,将符合目标疾病的病原体检测阳性的患者归为病例组,而检测阴性的患者归为对照组,同时收集其早期的免疫接种史。然后比较两组间的疫苗接种比例,从而评价疫苗的保护效果。检测阴性设计的实施需要基于3个基本假设[12]:①疫苗对所包含的病原体是有保护作用的;②其他病原体同样可以导致类似症状;③疫苗对其他病原体没有保护作用或者没有影响。
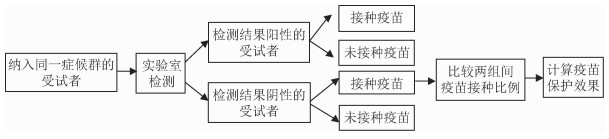
|
| 图 1 检测阴性设计原理示意图 |
在检测阴性设计中,由于存在其他病原的干扰,因此对照组的选择至关重要。阴性组作为对照组,同样需要满足传统病例对照研究中对照组的原则:①对照和病例应来自同一源人群;②病例和对照均有相同程度的暴露于目标病原的机会;③对照的选择应独立于研究因素的暴露状态。
2.检测阴性设计应用步骤:
(1)确定研究目的:研究目的是进行研究的基础,是确定以后各步骤的出发点。检测阴性设计的目的是评价疫苗的保护效果。实施检测阴性设计需要确定研究的疫苗种类、目标人群、研究时间以及其他的协变量。疫苗种类可以是一种,也可以是多种。目标人群的选择需要根据疫苗所针对的地区、人群和疾病而定。如果疫苗所针对的疾病通常为轻症,则可以选择门诊患者作为纳入人群;如果是重症,或者患病人数很多,可以选择住院患者[13-14]。人群具体的年龄和性别则需要根据疫苗所针对的对象和地区的具体情况而定。
(2)确定受试者定义:受试者是纳入研究对象的标准,直接影响纳入人群的数量和质量。纳入的受试者必须是疫苗所针对的接种对象,并且要在疫苗覆盖率适当的地区招募受试者。目前推荐在疫苗覆盖率在20%~80%的地区实施[15]。
以流感疫苗为例,Skowronski等[16]采用的流感样症状定义为:自述咳嗽伴发热,并至少有下列一项症状:咽喉痛、肌痛、关节痛或虚脱,对于≥65岁人群可以没有发热症状;而Kittikraisak等[17]则对儿童进行年龄划分后再进行定义。7~24月龄流感样症状定义为:体温>38 ℃,有以下一种或多种症状:流涕、鼻塞、咳嗽、结膜炎、呼吸窘迫(呼吸急促或撤退)、咽喉痛或近期癫痫发作;24~60月龄定义为:体温>38 ℃,伴有咳嗽或咽喉痛。因此,同样是针对流感疫苗评价的检测阴性设计,受试者流感样症状的最终定义可能需要研究者根据不同年龄段受试者可能观察到的典型临床症状而确定。
此外,针对同一种疫苗保护效果评价的检测阴性设计,还可能因为地区不同,如评价轮状病毒疫苗时的受试者定义,Tate等[18]在卢旺达评价五价轮状病毒疫苗时,对于受试者的定义为:年龄在7~18周,在24 h内腹泻至少3次的症状;Araki等[19]评价轮状病毒疫苗在日本儿童中的效果时,给出的定义为:年龄2月龄至3岁,24 h内有过至少2次腹泻,或有呕吐症状。因此,胃肠道症状的具体定义可能需要研究者根据地区具体发病人群的特征而确定。
(3)样本量估算:样本量计算可以参照非匹配病例对照研究的样本量计算方法。计算样本量需要考虑一些参数,包括疫苗的预期保护效果、受试者的疫苗覆盖率、检测结果阳性人数与阴性人数比例,以及Ⅰ类和Ⅱ类错误。
计算公式可以参考非匹配病例对照研究的样本量估计:
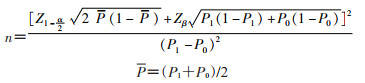

P1=(OR×P0)/(1-P0+OR×P0)
例如,假设疫苗的覆盖率为40%,检测结果阳性的人数占25%,检测阳性组的疫苗预期覆盖率为28%,计算可得检测阴性组的疫苗预期覆盖率为42%,OR≈0.495;在α=0.05水平下,保证把握度为80%,即β 
(4)确定研究时间阶段:大多数评价疫苗的检测阴性设计研究,将研究时间定为一个完整的疾病流行季[20],或者是限制在流行期间。以流感为例,Chiu等[21]在中国香港地区评价2017-2018年流感疫苗对住院儿童的保护效果,将研究时间限制在2017年12月4日至2018年1月31日,因为这是中国香港地区流感流行的高峰时期。轮状病毒疫苗的检测阴性设计同样如此,Araki等[19]将研究时间限制在2014年和2015年的1月1日至5月31日,该时间段是轮状病毒在日本的流行高峰。也有使用全年监测数据的文献;Ho等[22]在新加坡开展的检测阴性设计评价2010-2013年的流感疫苗效果,收集了全年的数据进行分析。但是,Jackson等[23]建议,检测阴性设计的最佳适用阶段是在疾病流行期间,非流行期间的病例不适合入组研究,因为他们与流行季节的病例暴露程度是不一致的。如果纳入了非流行期间的病例,那么在后续的统计分析中需要调整因纳入时期不同而带来的混杂。
(5)实验室检测:是检测阴性设计研究中的关键环节,符合入组标准的受试者需要根据病原学检测结果以划分病例或对照。进行病原学检测之前需要采集患者样本,呼吸道病原检测通常是采集鼻拭子或咽拭子,肠道病原通常采集肛拭子或粪便等样本。实验室检测方法通常选用PCR或RT- PCR,或者免疫学检测方法,例如ELISA等。在流感疫苗的检测阴性设计中,也有研究者采用快速流感诊断测试(rapid influenza diagnostic test)方法进行病原学检测[24]。
检测方法的灵敏度和特异度可能会对最后的疫苗效果评价产生影响,因此,Jackson等[25]采用模拟研究的方式探讨了灵敏度和特异度对最后效果评价的影响。假设疫苗实际效果为50%,采用的检测方法灵敏度为80%,特异度为90%,最后使用检测阴性设计得出的结果为37%。并且,假如固定特异度为100%,将灵敏度从100%降到80%,疫苗的效果会从50%降到48%;假如固定灵敏度为100%,将特异度从100%降到80%,疫苗的效果会从50%降到36%。由此可以得出,检测方法的特异度可能比灵敏度对结果的影响更大。因此,采用特异度高的检测方法可能更适合检测阴性设计。
对于检测结果阴性的人群,可以将其分为两类:①目标病原检测阴性,但其他病原检测为阳性。例如,轮状病毒检测阴性,其他肠道病原检测为阳性。②目标病原和其他病原检测均为阴性。在一些文献中发现,如果将其他病原阳性的患者归为阴性对照组,最后可能会使疫苗的效果估计偏高[26],需要将这两类患者分开作为对照组分析,或者排除第一类病例进行分析。但是,Sundaram等[27]和Blyth等[28]的研究结果表明第一类患者对于最后的结果并没有影响,可以将两类患者同时归为阴性对照组进行分析。
(6)收集免疫接种信息:在检测阴性设计中,由于分组依据是实验室检测结果,因此,在结果出来之前,并不知道哪些受试者是病例组,哪些受试者是对照组,处于一种盲态,这可以减少收集免疫信息时人为的干扰。
我们需要掌握患者是否接种过疫苗、何时接种了疫苗以及接种过哪些疫苗等信息。通常情况下,通过电子接种记录、医疗记录或者免疫接种记录卡来获得患者的免疫接种信息。如果没有免疫接种记录,可以采用问卷调查的方式来获得。而且,在出现症状的14 d前接种疫苗的人才会被归为疫苗组[20]。但是,也有缩短时间间隔的情况。评价2008-2009和2009-2010年流感疫苗效果时[29],正遇上2009年流感大流行,他们没有将接种疫苗和出现症状的时间间隔定为14 d,而是定为了7 d。除了免疫接种信息,还需要收集其他人口统计学数据,以便于控制混杂偏倚。
(7)统计分析:
统计指标采用优势比(OR):
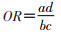
lnOR的方差:
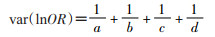
疫苗效果(vaccine effectiveness,VE):
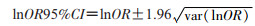
3.检测阴性设计的优缺点:
(1)优点:检测阴性设计可以看成是病例对照研究的一种特殊形式。其与传统的病例对照研究相比,不需要额外寻找对照,操作更加简便,易于实施。由于纳入的人群均为因某种类似临床症状而就诊人群,可以认为病例组和对照组之间具有较高的同质性。此外,病例收集在流行季节,使得病例组和对照组的暴露风险较为一致,且由于是前瞻性的入组并依靠实验室诊断,因此病例和对照的错分可能性较传统病例对照研究更低,且数据质量更为可靠。
(2)局限性:
其他病原的干扰:检测阴性设计的实施需要满足基本原理中的3个基本假设。前两个假设:①疫苗对所包含的病原体是有保护作用的;②其他病原体同样可以导致类似症状;通常情况下都是成立的,关键是第3个假设:疫苗对其他病原体没有保护作用或者没有影响;这一条有可能是未知的。以流感疫苗为例,如果流感疫苗对其他呼吸道病原有交叉保护作用,那么检测阴性设计中对照组中接种疫苗的人数就会减少(即四格表中的b减小),OR值增大,得出的疫苗效果就会偏低。又或者,有文献报道,接种疫苗的人感染其他病原的机会反而高于未接种疫苗的人(即四格表中的b增大),导致OR值减小,得出的疫苗效果偏高[26]。见表 1。
影响就医行为的因素:由于检测阴性设计纳入的都是就诊的病例,因此,影响疫苗接种和就医行为的因素就会对检测阴性设计产生偏倚。例如,健康意识强的人更有可能接种疫苗,患病的风险降低,就医的行为减少;又或者,健康意识强的人更加关注自己的身体状况,身体状况稍有不适就会去医疗机构就诊,就医的行为可能增加[30]。此外,医疗资源分布也可能影响就医行为,在某些医疗资源较为匮乏的地区,人们的就医行为可能低于生活在医疗资源较为丰富的地区的人群。
结论的外推受限:检测阴性设计通常评价疫苗对就医病例的保护效果,所得结论可能无法外推至全人群,特别是某些轻症病例可能会因忽略就医而漏诊。但是,从公共卫生角度考虑,评价疫苗对出现症状的病例的保护效果同样非常重要,因为这些病例可能成为传染源,具有疾病负担、经济负担。而为了使结论可以外推至更多的人群,检测阴性设计的实施尽可能采取多中心收纳人群,单中心检测阴性设计所得结论代表性很可能要劣于多中心的结论。
4.讨论与展望:检测阴性设计是一种简便、快速的研究方案,为上市后疫苗保护效果评价提供了一种新的思路。以往评价上市后疫苗的效果会采用队列研究或者传统的病例对照研究,相比于这两种研究设计,检测阴性设计更加省时省力[23]。但是,检测阴性设计并不能随意实施,必须充分考虑它的每个应用步骤以及局限性。
设计合理,实施质量良好的检测阴性设计研究可以获得可靠的疫苗保护效果数据。de Serres等[31]用四项流感疫苗临床试验的结果和其上市后检测阴性设计的结果进行了比较。研究结果显示,检测阴性设计得出的结果与临床试验得出的结果差异无统计学意义,提示检测阴性设计得出的结论是有效的。另外,也有学者采用多组对照的方式来验证检测阴性设计的可靠性。Bar-Zeev等[32]在马拉维地区评价单价轮状病毒疫苗的效果时,不仅采用了检测阴性组作为对照,同时也收集了普通的社区人群作为对照。使用两种对照组所得结果分别是64%(95%CI:24%~83%)和63%(95%CI:23%~83%)。这也间接证明了检测阴性设计结论的可靠性。
2017年,WHO的第67次报告文献中正式提出,检测阴性设计可以用来评价疫苗上市后的效果[33]。这也促使更多的国家和地区会采取检测阴性设计的方法来监测和评价疫苗效果。随着我国研发能力的增强,新的疫苗不断上市,需要加强对上市后疫苗的保护效果评价体系的建设和加大对疫苗监管的力度。检测阴性设计作为一种快速、简便的观察性研究方法,是值得推广的。检测阴性设计对疫苗上市后效果的评价可以补充先前随机对照试验的结果,为以后疾病预防控制、优化疫苗计划实施以及政府和捐助者持续投资疫苗提供重要的依据[34]。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Rid A, Saxena A, Baqui AH, et al. Placebo use in vaccine trials:recommendations of a WHO expert panel[J]. Vaccine, 2014, 32(37): 4708-4712. DOI:10.1016/j.vaccine.2014.04.022 |
| [2] |
Broome CV, Facklam RR, Fraser DW. Pneumococcal disease after pneumococcal vaccination:an alternative method to estimate the efficacy of pneumococcal vaccine[J]. N Engl J Med, 1980, 303(10): 549-552. DOI:10.1056/NEJM198009043031003 |
| [3] |
Effectiveness of vaccine against medical consultation due to laboratory-confirmed influenza: results from a sentinel physician pilot project in British Columbia, 2004-2005[J]. Can Commun Dis Rep, 2005, 31(18): 181-191. https://www.ncbi.nlm.nih.gov/pubmed/16669132
|
| [4] |
McLaughlin JM, Jiang Q, Isturiz RE, et al. Effectiveness of 13-valent pneumococcal conjugate vaccine against hospitalization for community-acquired pneumonia in older US adults:a test-negative design[J]. Clin Infect Dis, 2018, 67(10): 1498-1506. DOI:10.1093/cid/ciy312 |
| [5] |
Suzuki M, Dhoubhadel BG, Ishifuji T, et al. Serotype-specific effectiveness of 23-valent pneumococcal polysaccharide vaccine against pneumococcal pneumonia in adults aged 65 years or older:a multicentre, prospective, test-negative design study[J]. Lancet Infect Dis, 2017, 17(3): 313-321. DOI:10.1016/s1473-3099(17)30049-x |
| [6] |
Lopez AL, Daag JV, Esparagoza J, et al. Effectiveness of monovalent rotavirus vaccine in the Philippines[J]. Sci Rep, 2018, 8: 14291. DOI:10.1038/s41598-018-32595-9 |
| [7] |
Schwartz LM, Halloran ME, Rowhani-Rahbar A, et al. Rotavirus vaccine effectiveness in low-income settings:An evaluation of the test-negative design[J]. Vaccine, 2017, 35(1): 184-190. DOI:10.1016/j.vaccine.2016.10.077 |
| [8] |
Franke MF, Jerome JG, Matias WR, et al. Comparison of two control groups for estimation of oral cholera vaccine effectiveness using a case-control study design[J]. Vaccine, 2017, 35(43): 5819-5827. DOI:10.1016/j.vaccine.2017.09.025 |
| [9] |
Ali M, You YA, Sur D, et al. Validity of the estimates of oral cholera vaccine effectiveness derived from the test-negative design[J]. Vaccine, 2016, 34(4): 479-485. DOI:10.1016/j.vaccine.2015.12.004 |
| [10] |
Wang XL, An ZJ, Huo D, et al. Enterovirus A71 vaccine effectiveness in preventing enterovirus A71 infection among medically-attended hand, foot, and mouth disease cases, Beijing, China[J]. Human Vacc Immun, 2019, 15(5): 1183-1190. DOI:10.1080/21645515.2019.1581539 |
| [11] |
Belongia EA, Simpson MD, King JP, et al. Variable influenza vaccine effectiveness by subtype:a systematic review and Meta-analysis of test-negative design studies[J]. Lancet Infect Dis, 2016, 16(8): 942-951. DOI:10.1016/s1473-3099(16)00129-8 |
| [12] |
Fukushima W, Hirota Y. Basic principles of test-negative design in evaluating influenza vaccine effectiveness[J]. Vaccine, 2017, 35(36): 4796-4800. DOI:10.1016/j.vaccine.2017.07.003 |
| [13] |
Foppa IM, Ferdinands JM, Chaves SS, et al. The case test-negative design for studies of the effectiveness of influenza vaccine in inpatient settings[J]. Int J Epidemiol, 2016, 45(6): 2052-2059. DOI:10.1093/ije/dyw022 |
| [14] |
Feng S, Cowling BJ, Sullivan SG. Influenza vaccine effectiveness by test-negative design-Comparison of inpatient and outpatient settings[J]. Vaccine, 2016, 34(14): 1672-1679. DOI:10.1016/j.vaccine.2016.02.039 |
| [15] |
Verani JR, Baqui AH, Broome CV, et al. Case-control vaccine effectiveness studies:Preparation, design, and enrollment of cases and controls[J]. Vaccine, 2017, 35(25): 3295-3302. DOI:10.1016/j.vaccine.2017.04.037 |
| [16] |
Skowronski DM, Leir S, Sabaiduc S, et al. Interim estimates of 2018/19 vaccine effectiveness against influenza A(H1N1)pdm09, Canada, January 2019[J]. Euro Surveill, 2019, 24(4): 1900055. DOI:10.2807/1560-7917.ES.2019.24.4.1900055 |
| [17] |
Kittikraisak W, Suntarattiwong P, Ditsungnoen D, et al. Effectiveness of the 2013 and 2014 southern hemisphere influenza vaccines against laboratory-confirmed influenza in young children using a test-negative design, Bangkok, Thailand[J]. Pediat Infect Dis J, 2016, 35(10): e318-325. DOI:10.1097/INF.0000000000001280 |
| [18] |
Tate JE, Ngabo F, Donnen P, et al. Effectiveness of pentavalent rotavirus vaccine under conditions of routine use in rwanda[J]. Clin Infect Dis, 2016, 62(Suppl 2): S208-212. DOI:10.1093/cid/civ1016 |
| [19] |
Araki K, Hara M, Tsugawa T, et al. Effectiveness of monovalent and pentavalent rotavirus vaccines in Japanese children[J]. Vaccine, 2018, 36(34): 5187-5193. DOI:10.1016/j.vaccine.2018.07.007 |
| [20] |
Sullivan SG, Feng S, Cowling BJ. Potential of the test-negative design for measuring influenza vaccine effectiveness:a systematic review[J]. Expert Rev Vacc, 2014, 13(12): 1571-1591. DOI:10.1586/14760584.2014.966695 |
| [21] |
Chiu SS, Kwan MYW, Feng S, et al. Early season estimate of influenza vaccination effectiveness against influenza hospitalisation in children, Hong Kong, winter influenza season 2018/19[J]. Euro Surveill, 2019, 24(5): 1900056. DOI:10.2807/1560-7917.ES.2019.24.5.1900056 |
| [22] |
Ho HP, Zhao XH, Pang JX, et al. Effectiveness of seasonal influenza vaccinations against laboratory-confirmed influenza-associated infections among Singapore military personnel in 2010-2013[J]. Influenza Other Respir Viruses, 2014, 8(5): 557-566. DOI:10.1111/irv.12256 |
| [23] |
Jackson ML, Nelson JC. The test-negative design for estimating influenza vaccine effectiveness[J]. Vaccine, 2013, 31(17): 2165-2168. DOI:10.1016/j.vaccine.2013.02.053 |
| [24] |
Suzuki M, LeMinh N, Yoshimine H, et al. Vaccine effectiveness against medically attended laboratory-confirmed influenza in Japan, 2011-2012 Season[J]. PLoS One, 2014, 9(2): e88813. DOI:10.1371/journal.pone.0088813 |
| [25] |
Jackson ML, Rothman KJ. Effects of imperfect test sensitivity and specificity on observational studies of influenza vaccine effectiveness[J]. Vaccine, 2015, 33(11): 1313-1316. DOI:10.1016/j.vaccine.2015.01.069 |
| [26] |
Kelly H, Jacoby P, Dixon GA, et al. Vaccine effectiveness against laboratory-confirmed influenza in healthy young children[J]. Pediatr Infect Dis J, 2011, 30(2): 107-111. DOI:10.1097/INF.0b013e318201811c |
| [27] |
Sundaram ME, McClure DL, van Wormer JJ, et al. Influenza vaccination is not associated with detection of noninfluenza respiratory viruses in seasonal studies of influenza vaccine effectiveness[J]. Clin Infect Dis, 2013, 57(6): 789-793. DOI:10.1093/cid/cit379 |
| [28] |
Blyth CC, Jacoby P, Effler PV, et al. Effectiveness of trivalent flu vaccine in healthy young children[J]. Pediatrics, 2014, 133(5): e1218-1225. DOI:10.1542/peds.2013-3707 |
| [29] |
Puig-Barbera J, Arnedo-Pena A, Pardo-Serrano F, et al. Effectiveness of seasonal 2008-2009, 2009-2010 and pandemic vaccines, to prevent influenza hospitalizations during the autumn 2009 influenza pandemic wave in Castellon, Spain.A test-negative, hospital-based, case-control study[J]. Vaccine, 2010, 28(47): 7460-7467. DOI:10.1016/j.vaccine.2010.09.042 |
| [30] |
de Smedt T, Merrall E, Macina D, et al. Bias due to differential and non-differential disease-and exposure misclassification in studies of vaccine effectiveness[J]. PLoS One, 2018, 13(6): e0199180. DOI:10.1371/journal.pone.0199180 |
| [31] |
de Serres G, Skowronski DM, Wu XW, et al. The test-negative design:validity, accuracy and precision of vaccine efficacy estimates compared to the gold standard of randomised placebo-controlled clinical trials[J]. Euro Surveill, 2013, 18(37): 20585. DOI:10.2807/1560-7917.es2013.18.37.20585 |
| [32] |
Bar-Zeev N, Kapanda L, Tate JE, et al. Effectiveness of a monovalent rotavirus vaccine in infants in Malawi after programmatic roll-out:an observational and case-control study[J]. Lancet Infect Dis, 2015, 15(4): 422-428. DOI:10.1016/s1473-3099(14)71060-6 |
| [33] |
WHO. WHO expert committee on biological standardization[R]. Geneva: WHO, 2017.
|
| [34] |
Verani JR, Baqui AH, Broome CV, et al. Case-control vaccine effectiveness studies:Data collection, analysis and reporting results[J]. Vaccine, 2017, 35(25): 3303-3308. DOI:10.1016/j.vaccine.2017.04.035 |
 2020, Vol. 41
2020, Vol. 41



