文章信息
- 杨淞淳, 樊萌语, 余灿清, 郭彧, 卞铮, 裴培, 陈君石, 陈铮鸣, 吕筠, 李立明.
- Yang Songchun, Fan Mengyu, Yu Canqing, Guo Yu, Bian Zheng, Pei Pei, Chen Junshi, Chen Zhengming, Lyu Jun, Li Liming
- 基于前瞻性人群队列的中国成年人排便频率与帕金森病的关联研究
- Frequency of bowel movements and risk of Parkinson's disease: a prospective cohort study in adults in China
- 中华流行病学杂志, 2020, 41(1): 48-54
- Chinese Journal of Epidemiology, 2020, 41(1): 48-54
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2020.01.010
-
文章历史
收稿日期: 2019-05-17
2. 中国医学科学院, 北京 100730;
3. 国家食品安全风险评估中心, 北京 100022;
4. 英国牛津大学临床与流行病学研究中心纳菲尔德人群健康系OX3 7LF;
5. 北京大学分子心血管学教育部重点实验室 100191
2. Chinese Academy of Medical Sciences, Beijing 100730, China;
3. China National Center for Food Safety Risk Assessment, Beijing 100022, China;
4. Clinical Trial Service Unit and Epidemiological Studies Unit, Nuffield Department of Population Health, University of Oxford, Oxford OX3 7LF, UK;
5. Key Laboratory of Molecular Cardiovascular Sciences, Ministry of Education, Peking University, Beijing 100191, China
帕金森病(Parkinson’s disease,PD)是仅次于阿尔兹海默病的第二大神经退行性疾病。PD早期诊断困难,病因尚不完全明确,可能与遗传、行为以及环境因素有关[1-2]。由于PD病程具有不可逆性,明确病因并及早实施预防具有重要意义[3]。临床上,PD的起病过程长,便秘、焦虑障碍、睡眠障碍等临床表现出现的时间可能早于PD的主要运动症状数年[4]。既往大多数的观察性研究均发现,便秘者出现PD的风险更高[5-6]。排便频率(bowel movement frequency)<3次/周是便秘的症状表现之一[7],美国的3项队列研究直接检验了排便频率与PD风险的关联[8-9],来自中国人群的研究证据尚缺乏;同时,既往研究关于排便频率在不同性别人群中对PD风险的长期影响结果尚不一致[8-10]。本研究旨在利用中国慢性病前瞻性研究(China Kadoorie BioBank,CKB)平均随访10年的数据,检验基线排便频率与随访期间确定的PD的关联。
对象与方法1.研究对象:CKB的研究现场为全国的5个城市和5个农村项目地区。2004-2008年开展基线调查,内容包括问卷调查、体格测量和血标本采集,最终纳入512 715名有完整基线调查数据并签署知情同意书的研究对象。项目详细介绍参见文献[11-13]。剔除BMI信息缺失(2人)、基线调查后即失访(1人)及自报患有恶性肿瘤(2 578人)的研究对象,共510 134人纳入分析。
2.暴露评价:基线调查时,统一培训的调查员通过询问获得研究对象的排便频率信息:“通常情况下,你一般多久解1次大便?”,调查对象可以选择的答案为:“<3次/周”“隔天1次”“1次/d”或“>1次/d”。通过问卷收集社会人口学特征(年龄、性别、文化程度、职业、婚姻状况),生活方式因素(饮茶,吸烟,饮酒,体力活动水平[14],乳类及其制品、新鲜蔬菜、新鲜水果等膳食的摄入频率),个人健康情况(脑外伤、神经衰弱、高血压、糖尿病、冠心病和卒中病史,服用药品及营养品的情况)。身高(m)、体重(kg)、腰围(cm)、臀围(cm)均采用统一校正的工具测量。BMI(kg/m2)为体重(kg)与身高(m)平方的比值,腰臀比为腰围(cm)与臀围(cm)的比值。
3.随访结局评价:研究通过链接全民医疗保险数据库确定随访期间队列成员首次出现PD诊断的时间,对于极少数未参与医保的个体,工作人员会定期进行主动随访获取因PD住院的情况。疾病分类采用国际疾病分类第10版(ICD-10)。本研究以随访期间首次出现PD诊断作为结局(ICD-10编码为G20)。
4.统计学分析:数据分析采用Stata 15.0软件,双侧检验,以P<0.05为差异有统计学意义。本研究的随访人年从研究对象完成基线调查的时间开始算起,到最早出现下列任一事件的时间为止:首次出现PD诊断、任意原因死亡、失访或2016年12月31日。采用Cox比例风险模型,以年龄为时间尺度,计算排便频率与首次出现PD诊断的风险比(hazard ratio,HR)及其95%CI。考虑到不同年龄和10个地区发病风险的组别效应,模型以年龄(每5岁1组)和项目地区(10个地区)进行联合分层。
本研究参考既往文献[1-2],在多变量模型中调整以下可能的混杂因素:性别(分性别分析时不调整),文化程度(未正规上过小学、小学、初中、高中、大专、大学),婚姻状况(已婚、丧偶、分居/离婚、从未结婚),每日吸烟(是/否),体力活动水平(MET-h/d),腰臀比,每日饮茶(是/否),每日饮酒(是/否),摄入乳类及其制品≥4 d/周(是/否),基线脑外伤病史(是/否)和家中储存农药的时长(月/年)。为检验效应值的稳健性,在多变量模型的基础上又进行了以下敏感性分析:①剔除基线调查时患有脑外伤、神经衰弱的个体,并在模型中不再调整脑外伤病史作为协变量;②剔除基线调查时患有冠心病、中风/小卒中的个体;③剔除随访不足2年的个体;④额外调整新鲜蔬菜、新鲜水果等11种膳食的摄入频率;⑤额外调整基线高血压和糖尿病的患病状况;⑥额外调整基线BMI。
进一步按随访期(≤5年和>5年)进行亚组分析。考虑到亚组分析导致样本量的进一步降低,我们减少暴露因素的分组数,即将排便频率的“<3次/周”与“隔天1次”合并为“<1次/d”,将“1次/d”与“>1次/d”合并为“≥1次/d”。本研究还按性别(男、女),年龄(<60、≥60岁),城乡(农村、城市),体力活动水平(低、中、高),每日吸烟(是/否),每日饮酒(是/否),BMI(<18.5、18.5~23.9、≥24.0 kg/m2),腰臀比(男性≥0.90,女性≥0.85;是/否),基线时高血压和基线时糖尿病(是/否)进行了亚组分析。交互作用检验采用似然比检验法。
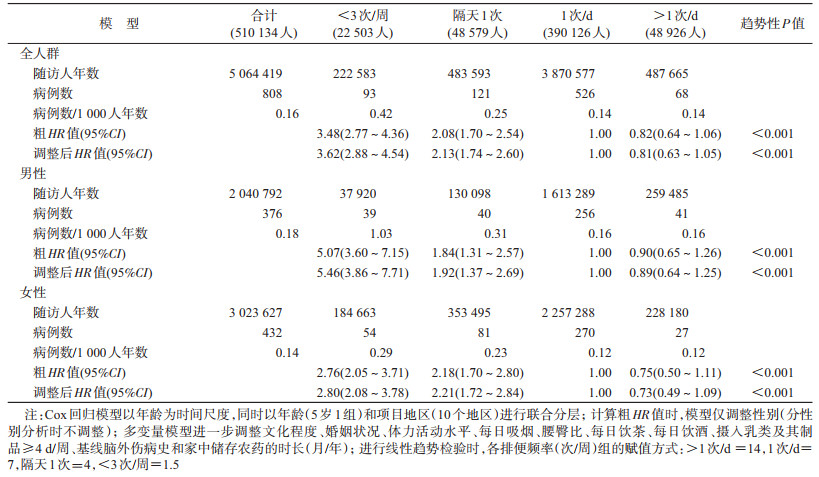
结果1.一般情况:各组的基本特征分布见表 1。在纳入分析的510 134名研究对象中,女性占59.0%,年龄(52.0±10.7)岁,城市居民占44.1%。相比其他排便频率者,在排便频率<3次/周的人群中,女性、城市人群的比例更高,男性中每日饮酒者的比例更低。
2.关联分析:研究对象随访(9.9±1.9)年,最长随访达12.5年,累计随访5 064 419人年。随访期间,诊断PD共808例。控制潜在混杂因素后,与排便频率为1次/d者相比,排便频率<3次/周者、隔天1次者和>1次/d者出现PD诊断的HR值分别为3.62(95%CI:2.88~4.54)、2.13(95%CI:1.74~2.60)和0.81(95%CI:0.63~1.05),排便频率与PD诊断之间的关联存在有统计学意义的线性趋势(P<0.001)(表 2)。更多敏感性分析显示,在剔除随访不足2年的个体,剔除基线时患有脑外伤、神经衰弱、冠心病或中风/小卒中的个体,或额外调整其他潜在混杂因素后,效应值均无明显变化(结果未展示)。在男性中,与排便频率为1次/d者相比,排便频率<3次/周者、隔天1次者和>1次/d者的HR值分别为5.46(95%CI:3.86~7.71)、1.92(95%CI:1.37~2.69)和0.89(95%CI:0.64~1.25);在女性中相应的HR值分别为2.80(95%CI:2.08~3.78)、2.21(95%CI:1.72~2.84)和0.73(95%CI:0.49~1.09);排便频率与性别存在统计学显著的交互作用(交互性P=0.026)。
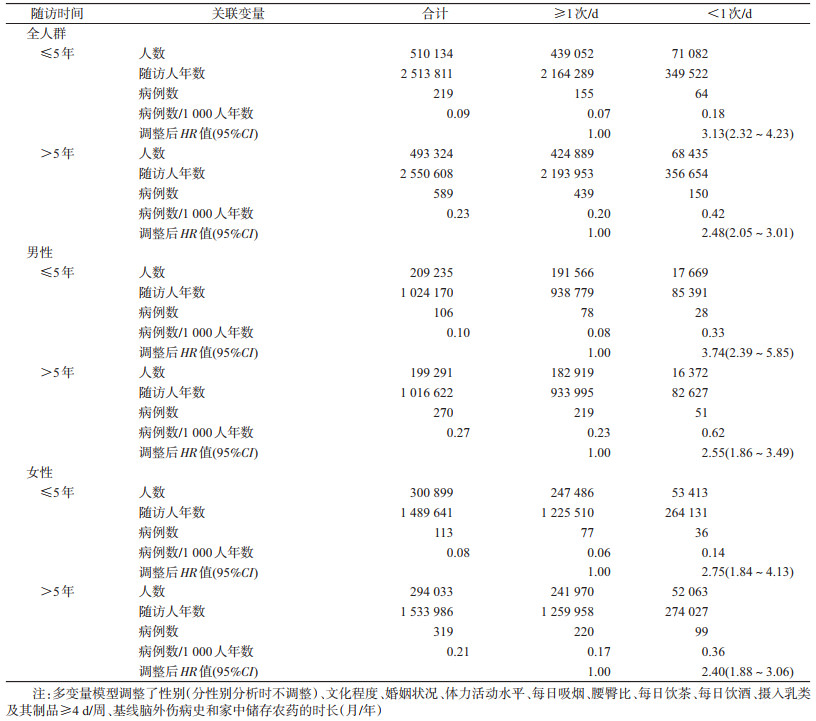
3.按随访期进行的亚组分析:全人群中,与排便频率≥1次/d者相比,排便频率<1次/d者在随访≤5年内的HR=3.13(95%CI:2.32~4.23);在随访>5年后,相应的HR=2.48(95%CI:2.05~3.01)。分性别分析时的结果与在全人群中相似(表 3)。
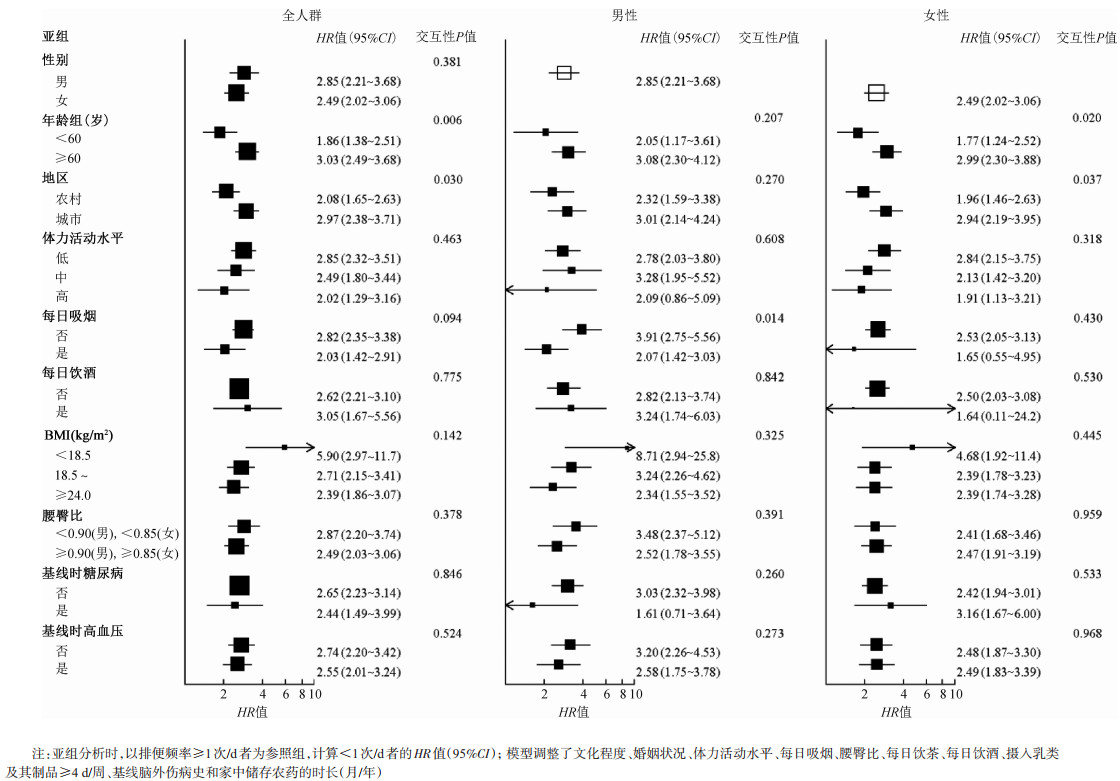
4.其他亚组分析:全人群中,排便频率<1次/d与PD诊断的关联在>60岁的老年人和城市居民中表现得更强(交互性P=0.006和0.030)。在男性中,低排便频率与PD诊断之间的关联在非吸烟者中表现得更强(交互性P=0.014)。在按其他基线特征进行亚组分析时,均未发现有统计学意义的交互作用(图 1)。
|
| 图 1 其他基线特征对排便频率与帕金森病的关联进行亚组分析 |
本研究利用CKB项目平均随访10年的数据检验了基线排便频率与随访期间PD诊断的关联。结果显示,无论男女,调整潜在混杂因素后,排便频率越低,随访期间出现PD诊断的风险越高。对随访>5年后出现的结局,这种关联仍然存在。
既往多数的观察性研究发现,便秘者随后出现PD的风险更高[5-6]。本研究发现,相比排便频率为1次/d者,排便频率<3次/周者和隔天1次者出现PD诊断的风险均更高。美国檀香山心脏研究(Honolulu Heart Program,HHP)对6 790名45~68岁的男性随访约24年后发现,与排便频率为1次/d、2次/d和>2次/d者相比,排便频率<1次/d者发生PD的HR值分别为2.7(95%CI:1.3~5.5)、4.1(95%CI:1.7~9.6)和4.5(95%CI:1.2~16.9)[8]。美国医生随访研究(Health Professionals Follow-up Study)在对33 901名>50岁的男性随访6年后同样观察到排便频率与PD风险之间存在显著的负相关;与1次/d者相比,排便频率≤3 d/次者和隔天1次者出现PD诊断的HR值分别为4.35(95%CI:1.80~10.5)和3.31(95%CI:1.96~5.58)[9]。这些研究与本研究一致,提示排便频率降低即使未达到便秘标准(<3次/周),也有预测疾病风险的意义。
本研究发现,在随访>5年后,无论男女,排便频率<1次/d者出现PD诊断的风险仍是排便频率≥1次/d者的近2.5倍。HHP在随访>12年后观察到排便频率<1次/d者发生PD的风险是排便频率≥1次/d者的近3倍(95%CI:1.0~8.6;P=0.042)[8]。一项丹麦队列研究纳入了年龄>15岁的便秘者31 905万人和非便秘者159 092人进行随访后发现,便秘者在未来的≤1、2~、6~和11~15年出现PD诊断的HR值分别为3.53(95%CI:2.39~5.23)、2.88(95%CI:2.20~3.77)、2.90(95%CI:1.85~4.53)和3.65(95%CI:1.67~7.95)[10]。一项基于英国初级保健数据库电子医疗记录的病例对照研究纳入了8 166名PD患者和46 755名匹配的对照,与对照组相比,PD患者在被诊断前5~9年内、前10年内出现便秘的RR值分别为2.24(95%CI:2.04~2.46)和2.01(95%CI:1.62~2.49)[15]。上述研究与本研究较为一致,均提示低排便频率可预测PD长期风险。然而,美国护士队列研究(Nurses’ Health Study)对93 767名36~61岁的女性随访约24年后,仅在随访6年内发现排便频率与PD诊断之间存在弱负相关;随访6年之后,排便频率与PD诊断之间无统计学显著的关联[9]。
低排便频率与PD发病之间的生物学机制尚不明确。较早的“二次打击假说”(dual-hit hypothesis)认为,某种嗜神经的病原体可能先侵入鼻腔或肠道的神经组织,引起这些部位的神经功能异常,如嗅觉损伤、迷走神经功能失调等,从而表现出便秘等非运动症状;经过较长时间后,病原体渐渐累及中枢神经系统,引起PD的运动症状[16]。近年来,起源于肠道的α-突触核蛋白(α-synuclein)引起关注,这种蛋白在周围自主神经系统中聚集,可通过迷走神经病理性地传播进入中枢神经系统[17]。这一假说已在小鼠模型中得到证实[18]。也有研究指出,肠道菌群可通过“菌群-肠-脑轴”(microbiota-gut-brain axis)直接影响大脑中多巴胺的合成过程[19]。这些假说和既往多数人群研究提示,低排便频率可能是PD起病极早期肠道的症状反应,排便频率的降低可能提示病原体已侵入肠道或肠道菌群存在失调,其病因学机制有待后续研究加以阐明。
本研究观察到排便频率<3次/周与PD诊断风险的关联在男性中比女性中更强,与丹麦队列研究结果类似,但丹麦队列研究的交互作用检验差异无统计学意义(交互性P=0.14)[10]。在我国台湾地区开展的一项基于健康保险数据库的回顾性队列研究发现,与非便秘者相比,轻度、中度、重度便秘者在男性中HR值均高于同组的女性,交互作用检验差异有统计学意义(交互性P<0.000 1)[20]。既往有学者提出,低排便频率与PD风险之间关联强度的性别差异可能与雌性激素对神经系统的保护作用有关[21]。本研究在≥60岁老年人中观察到排便频率<1次/d与PD诊断风险的关联比在<60岁的人群中更强,可能是由于PD早期病变累及肠神经系统时,衰老引起的肠道和盆底功能失调更容易使人体表现为低排便频率。本研究中观察到低排便频率与PD的关联在男性非吸烟者中比男性吸烟者中更强,这一现象也有待后续研究加以检验。
本研究的优势包括大样本量、前瞻性设计,同时在不同性别人群中进行分析,尽可能控制了已知的混杂因素,以及对主要的基线特征进行了详细的亚组分析。本研究仍存在局限性。首先,排便频率信息为研究对象自报,可能存在无差异错分,使结果趋向于无效假设。其次,本研究仅使用基线时的排便频率作为分组依据,未能考虑排便频率随时间的变化情况。此外,本研究的结局信息主要来源于医保住院数据,可能会低估PD的发生。最后,由于在基线调查时未能获取研究对象现患PD的信息,在关联分析前未能剔除现患PD的个体;但由于PD的发病率相对较低,且难以早期诊断,在实际开展现场调查时明确知道自己患有PD的研究对象极少,难以对本研究结果造成较大的影响。此外,本研究在敏感性分析时剔除了随访不足2年的个体,也进一步按随访期≤5年和>5年进行分析,能较好地控制因果倒置。
综上所述,本研究利用CKB项目50万人的数据发现,基线排便频率越低的研究对象在未来平均10年的随访期内出现PD诊断的风险越高。低排便频率作为一个容易识别的症状,可以考虑结合其他与PD可能相关的早期症状,用于老年人群中PD的早期发现。
利益冲突 所有作者均声明不存在利益冲突
志谢 感谢所有参加CKB项目的队列成员和各项目地区的现场调查队调查员;感谢项目管理委员会、国家项目办公室、牛津协作中心和10个项目地区办公室的工作人员
| [1] |
Ascherio A, Schwarzschild MA. The epidemiology of Parkinson's disease:risk factors and prevention[J]. Lancet Neurol, 2016, 15(12): 1257-1272. DOI:10.1016/s1474-4422(16)30230-7 |
| [2] |
宋亚南, 郁金泰, 谭兰. 帕金森病的危险因素及其预防[J]. 中华行为医学与脑科学杂志, 2019, 28(2): 188-192. Song YN, Yu JT, Tan L. The risk factors and prevention of Parkinson's disease[J]. Chin J Behav Med Brain Sci, 2019, 28(2): 188-192. DOI:10.3760/cma.j.issn.1674-6554.2019.02.017 |
| [3] |
Kalia LV, Lang AE. Parkinson's disease[J]. Lancet, 2015, 386(9996): 896-912. DOI:10.1016/s0140-6736(14)61393-3 |
| [4] |
Savica R, Rocca WA, Ahlskog JE. When does Parkinson disease start?[J]. Arch Neurol, 2010, 67(7): 798-801. DOI:10.1001/archneurol.2010.135 |
| [5] |
Adams-Carr KL, Bestwick JP, Shribman S, et al. Constipation preceding Parkinson's disease:a systematic review and Meta-analysis[J]. J Neurol Neurosurg Psychiatry, 2016, 87(7): 710-716. DOI:10.1136/jnnp-2015-311680 |
| [6] |
Wu YH, Liao YC, Chen YH, et al. Risk of premotor symptoms in patients with newly diagnosed PD:a nationwide, population-based, case-control study in Taiwan[J]. PLoS One, 2015, 10(6): e0130282. DOI:10.1371/journal.pone.0130282. DOI:10.1371/journal.pone.0130282 |
| [7] |
Lacy BE, Mearin F, Chang L, et al. Bowel disorders[J]. Gastroenterology, 2016, 150(6): 1393-1407. DOI:10.1053/j.gastro.2016.02.031 |
| [8] |
Abbott RD, Petrovitch H, White LR, et al. Frequency of bowel movements and the future risk of Parkinson's disease[J]. Neurology, 2001, 57(3): 456-462. DOI:10.1212/WNL.57.3.456 |
| [9] |
Gao X, Chen HL, Schwarzschild MA, et al. A prospective study of bowel movement frequency and risk of Parkinson's disease[J]. Am J Epidemiol, 2011, 174(5): 546-551. DOI:10.1093/aje/kwr119 |
| [10] |
Svensson E, Henderson VW, Borghammer P, et al. Constipation and risk of Parkinson's disease:A Danish population-based cohort study[J]. Parkinsonism Relat Disord, 2016, 28: 18-22. DOI:10.1016/j.parkreldis.2016.05.016 |
| [11] |
Chen ZM, Chen JS, Collins R, et al. China Kadoorie Biobank of 0.5 million people:survey methods, baseline characteristics and long-term follow-up[J]. Int J Epidemiol, 2011, 40(6): 1652-1666. DOI:10.1093/ije/dyr120 |
| [12] |
Chen ZM, Lee L, Chen JS, et al. Cohort profile:The Kadoorie study of chronic disease in China (KSCDC)[J]. Int J Epidemiol, 2005, 34(6): 1243-1249. DOI:10.1093/ije/dyi1d74 |
| [13] |
李立明, 吕筠, 郭彧, 等. 中国慢性病前瞻性研究:研究方法和调查对象的基线特征[J]. 中华流行病学杂志, 2012, 33(3): 249-255. Li LM, Lyu J, Guo Y, et al. The China Kadoorie Biobank:related methodology and baseline characteristics of the participants[J]. Chin J Epidemiol, 2012, 33(3): 249-255. DOI:10.3760/cma.j.issn.0254-6450.2012.03.001 |
| [14] |
樊萌语, 吕筠, 郭彧, 等. 中国慢性病前瞻性研究:10个项目地区成人体力活动和休闲静坐时间特征差异的分析[J]. 中华流行病学杂志, 2015, 36(8): 779-785. Fan MY, Lyu J, Guo Y, et al. Regional differences on patterns of physical activity and leisure sedentary time:findings from the China Kadoorie Biobank study, including a million people from 10 regions[J]. Chin J Epidemiol, 2015, 36(8): 779-785. DOI:10.3760/cma.j.issn.0254-6450.2015.08.002 |
| [15] |
Schrag A, Horsfall L, Walters K, et al. Prediagnostic presentations of Parkinson's disease in primary care:a case-control study[J]. Lancet Neurol, 2015, 14(1): 57-64. DOI:10.1016/s1474-4422(14)70287-x |
| [16] |
Hawkes CH, Del Tredici K, Braak H. Parkinson's disease:a dual-hit hypothesis[J]. Neuropathol Appl Neurobiol, 2007, 33(6): 599-614. DOI:10.1111/j.1365-2990.2007.00874.x |
| [17] |
Kujawska M, Jodynis-Liebert J. What is the evidence that Parkinson's disease is a prion disorder, which originates in the gut?[J]. Int J Mol Sci, 2018, 19(11): 3573. DOI:10.3390/ijms19113573 |
| [18] |
Kim S, Kwon SH, Kam TI, et al. Transneuronal Propagation of Pathologic alpha-Synuclein from the Gut to the Brain Models Parkinson's Disease[J]. Neuron, 2019, 103(4): 627-641. DOI:10.1016/j.neuron.2019.05.035 |
| [19] |
Nair AT, Ramachandran V, Joghee NM, et al. Gut microbiota dysfunction as reliable non-invasive early diagnostic biomarkers in the pathophysiology of Parkinson's disease:a critical review[J]. J Neurogastroenterol Motil, 2018, 24(1): 30-42. DOI:10.5056/jnm17105 |
| [20] |
Lin CH, Lin JW, Liu YC, et al. Risk of Parkinson's disease following severe constipation:a nationwide population-based cohort study[J]. Parkinsonism Relat Disord, 2014, 20(12): 1371-1375. DOI:10.1016/j.parkreldis.2014.09.026 |
| [21] |
Jurado-Coronel JC, Cabezas R, ávila Rodríguez MF, et al. Sex differences in Parkinson's disease:Features on clinical symptoms, treatment outcome, sexual hormones and genetics[J]. Front Neuroendocrinol, 2018, 50: 18-30. DOI:10.1016/j.yfrne.2017.09.002 |
 2020, Vol. 41
2020, Vol. 41