文章信息
- 陈清, 赵峰, 黄清湄, 吕跃斌, 钟文芳, 周锦辉, 李志浩, 曲英莉, 刘玲, 刘迎春, 王蛟男, 曹兆进, 吴娴波, 施小明, 毛琛.
- Chen Qing, Zhao Feng, Huang Qingmei, Lyu Yuebin, Zhong Wenfang, Zhou Jinhui, Li Zhihao, Qu Yingli, Liu Ling, Liu Yingchun, Wang Jiaonan, Cao Zhaojin, Wu Xianbo, Shi Xiaoming, Mao Chen
- 中国8个长寿地区65岁及以上老年人肾小球滤过率对全因死亡风险的影响
- Effects of estimated glomerular filtration rate on all-cause mortality in the elderly aged 65 years and older in 8 longevity areas in China
- 中华流行病学杂志, 2020, 41(1): 36-41
- Chinese Journal of Epidemiology, 2020, 41(1): 36-41
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2020.01.008
-
文章历史
收稿日期: 2019-06-13
2. 中国疾病预防控制中心环境与健康相关产品安全所, 北京 100021
2. National Institute of Environmental Health, Chinese Center for Disease Control and Prevention, Beijing 100021, China
慢性肾脏疾病(chronic kidney disease,CKD)目前已成为一个全球公共卫生问题[1-3],是危害老年人健康的常见慢性病之一,CKD独立于其他传统危险因素,不仅会增加老年人群的死亡风险及心血管疾病的发病风险,还可能进一步发展为肾功能衰竭,严重影响老年人群的生活质量[4-6]。肾小球滤过率(glomerular filtration rate,GFR)是评估整体肾功能的最佳指标[1, 7],美国、英国及加拿大的一些研究表明,估算GFR(estimated GFR,eGFR)水平的下降与不同人群的全因死亡率相关[8-10]。在中国,大多数研究的对象为特定疾病患者,如糖尿病、脑卒中等[11-13],只有少数研究关注过中国一般人群eGFR水平与死亡风险的关系[14-15]。本研究利用“中国老年健康影响因素跟踪调查”(Chinese Longitudinal Healthy Longevity Survey)子队列—“老年健康生物标志物队列研究”(Healthy Aging and Biomarkers Cohort Study,HABCS)的数据,分析eGFR水平与中国长寿地区≥65岁老年人全因死亡率的关联,并进一步探索可能影响两者关系的潜在因素。
对象与方法1.研究对象:来自HABCS,有关队列的详细研究设计及具体的抽样方法参见文献[16]。该项目选择了中国8个长寿地区(包括山东省莱州市、河南省夏邑县、湖北省钟祥市、湖南省麻阳县、广东省佛山市、广西壮族自治区永福县、海南省澄迈县以及江苏省如东县)作为调查现场,采用不等比例目标随机抽样方法,对于每位百岁老人,按照就近原则(在同一个村庄或街道,或者同一个抽样县或城市)随机访问与百岁老人及其他所有受访者无任何血缘关系的90~99岁、80~89岁和70~79岁间预定年龄和性别的老年人各1名以及65~69岁老年人0.5名。2009-2017年总调查≥65岁老年人5 605名,其中百岁老人1 385名、90~99岁老年人1 350名、80~89岁老年人1 294名以及65~79岁老年人1 577名。该研究经北京大学伦理委员会审查(批准文号:IRB00001052- 13074),研究对象均签署知情同意书。本研究纳入标准:①年龄≥65岁;②在基线调查时进行血肌酐(serum creatinine,Scr)检测;③至少完成1次随访调查,最终纳入符合条件的研究对象共1 802名。
2.研究内容和方法:①问卷调查:由经统一培训的调查员入户进行面对面访谈式问卷调查,收集调查对象个人基本状况、对现状评价及性格特征、认知功能、生活方式、日常生活自理能力(activities of daily living,ADL)、工具性ADL、个人背景及家庭状况、生理健康状况;②体格检查:包括身高、体重、腰围、血压;③实验室检测:HABCS的生物样本指标包括血常规、尿常规、生化指标、炎性指标、氧化抗氧化指标、微量与宏量元素、营养状况指标。所有生物样本均在-80 ℃下送首都医科大学临床检验中心,并集中完成检测与分析。本研究使用日本Hitachi 7180全自动分析仪(日本Hitachi公司),采用酶法测量肾功能损害指标Scr水平。
3. eGFR的计算及分组:使用改良的4变量Chronic Kidney Disease Epidemiology Collaboration(CKD-EPI)公式(调整系数为1.1)计算eGFR[17]:
男性:

女性:

eGFR单位:ml·min-1·(1.73 m2)-1;Scr单位:mg·dl-1。
根据2012全球改善肾脏病预后委员会(Kidney Disease:Improving Global Outcomes,KDIGO)肾病评估与管理临床实践指南以及我国开滦1项eGFR水平与全因死亡的队列研究[15, 18],本研究将老年人eGFR水平划分为4组:肾功能中-重度损伤组[<45 ml·min-1·(1.73 m2)-1]、肾功能轻-中度损伤组[45~ml·min-1·(1.73 m2)-1]、肾功能轻度损伤组[60~ml·min-1·(1.73 m2)-1]、肾功能正常组[≥90 ml·min-1·(1.73 m2)-1]。
4.死亡信息的收集:在2014和2017年的随访调查中,确认调查对象的生存结局,对死亡老年人家属进行死亡问卷调查,通过与家属、村医或其他医疗卫生机构医务人员进行面对面访谈,收集死亡日期和死亡原因等信息。本研究的结局为全死因死亡(含意外死亡)。若无法联系到家属则定义为失访。
5.协变量评估及标准与定义:根据文献报道,选择可能会混淆eGFR与死亡率之间关联的协变量。从结构化问卷中收集了协变量信息[19],包括一般人口学特征(年龄、性别、受教育年限以及居住状况)、生活行为方式(吸烟、饮酒、锻炼以及蔬菜水果消费)、身体测量与功能状态(BMI、认知功能、ADL)以及慢性病(高血压、糖尿病、心脏病和脑血管疾病)患病情况。
分类变量的标准与定义:①BMI分组[20]:<18.5 kg/m2为低体重,18.5~kg/m2为正常体重,≥24.0 kg/m2为超重;②认知功能测定[21]:采用国际通用的简易精神状况检查(Mini-Mental State Examination,MMSE)量表评估,量表总分为30分,将评分<18定义为认知功能受损,评分≥18定义为认知功能正常;③ADL[22]:包括洗澡、穿衣、进食、室内活动、如厕和控制大小便6项活动,如能独立完成,则定义为“ADL正常”,否则为“ADL失能”。
6.统计学分析:所有数据均使用R 3.5.0软件进行分析。按照eGFR分组归纳研究对象的基线特征,应用方差分析或χ2检验比较eGFR各分组基线特征的差异。采用Kaplan-Meier法估计eGFR 4个分组水平下的生存率与全因死亡率,并绘制生存曲线,且使用log-rank检验法比较各分组的生存率差异。采用单因素和多因素Cox比例风险回归模型评估eGFR各分组(以肾功能正常组为参照)的死亡风险比(hazard ratio,HR)及其95%CI,多因素模型的校正变量包括年龄、性别、BMI、认知功能、ADL、居住情况、受教育年限、吸烟、饮酒、锻炼、蔬菜消费、水果消费以及高血压、糖尿病、心脏病和脑血管疾病的患病情况。为进一步探讨影响eGFR水平与死亡风险关系的相关因素,对主要分层变量进行分层分析,其交互作用采用似然比检验。所有统计检验均为双侧检验。以P<0.05为差异有统计学意义。
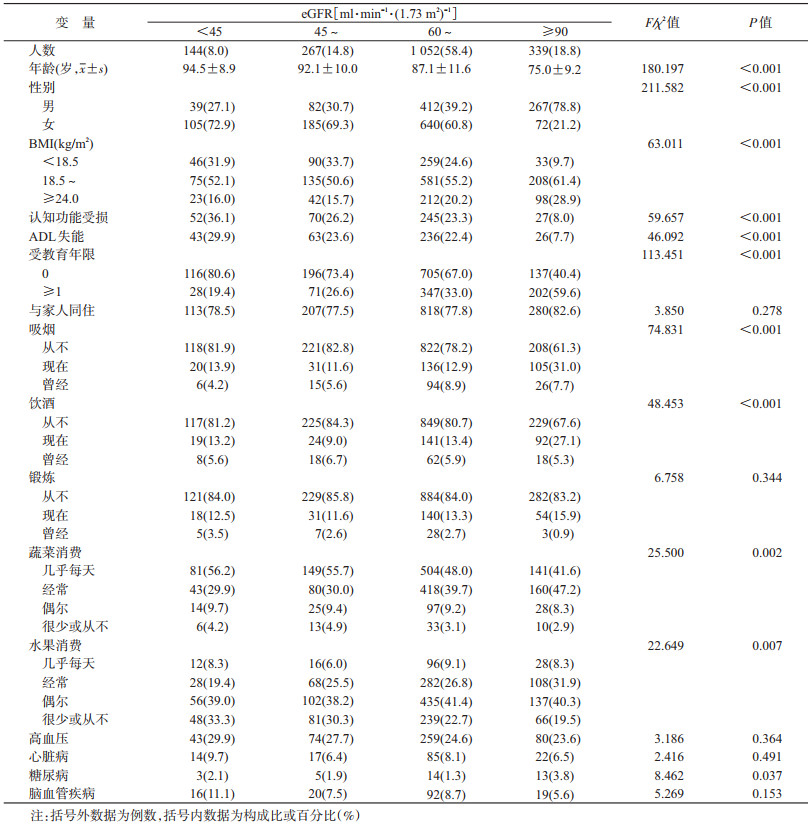
结果1.一般情况:共纳入1 802名老年人(年龄65~112岁),女性1 002人(55.6%),eGFR范围为9.77~127.21 ml·min-1·(1.73 m2)-1;eGFR平均值为73.47 ml·min-1·(1.73 m2)-1,男性eGFR水平[79.67 ml·min-1·(1.73 m2)-1]高于女性[68.52 ml·min-1·(1.73 m2)-1],差异有统计学意义(P<0.001);各组间的性别、年龄、BMI、认知功能受损、ADL失能、受教育年限、吸烟、饮酒、蔬菜消费、水果消费及糖尿病患病率差异有统计学意义(均P<0.05),而各组间的锻炼、居住状况、高血压、心脏病及脑血管疾病患病率差异无统计学意义(表 1)。
2. eGFR与全因死亡的关系:经6年随访共计死亡852人。不同eGFR水平分组的生存曲线分析显示,肾功能中-重度损伤组老年人全因死亡率最高(68.1%),而肾功能正常组老年人全因死亡率最低(23.9%)(log-rank检验χ2=128.908,P<0.001)(图 1)。

|
| 图 1 不同eGFR水平分组的Kaplan-Meier生存曲线 |
模型4分析结果显示,eGFR水平与老年人全因死亡风险呈负相关[eGFR每升高1 ml·min-1·(1.73 m2)-1老年人死亡HR=0.993,95%CI:0.989~0.997,P<0.001];相较于肾功能正常组,肾功能中-重度损伤组、轻-中度损伤组及轻度损伤组老年人死亡HR值(95%CI)分别为1.690(1.224~2.332,P=0.001)、1.312(0.978~1.758,P=0.070)、1.349(1.047~1.737,P=0.020)(趋势检验P<0.001)(表 2)。趋势检验显示,随着eGFR水平的降低,全因死亡率呈逐渐上升趋势(P<0.001)。
3.分层分析与敏感性分析:调整相关变量后,对主要分层变量[性别(男、女)、年龄组(<80、≥80岁)、BMI分组(<18.5、18.5~、≥24.0 kg/m2)、ADL(正常、失能)、吸烟(从不、现在、曾经)、饮酒(从不、现在、曾经)]进行分层分析发现,各分层变量和eGFR水平对老年人全因死亡风险的影响无交互作用(均P>0.05)(表 3)。进行敏感性分析后[校正生化指标(血脂、FPG、TG以及高敏C反应蛋白)并排除随访2年内死亡的参与者],结果未发生重大变化(数据未显示)。
本研究发现,老年人全因死亡风险随eGFR水平的下降而升高。在调整调查对象一般人口学特征、生活行为方式、身体测量与功能状态以及慢性病患病情况后,低水平eGFR仍与该老年人群高死亡风险相关联。此前在基于不同人群的研究也证实eGFR水平的降低是全因死亡率的危险因素[23-25]。例如:在南欧地区和日本的长期队列随访研究中发现[26-27],一般人群的全因死亡风险会随着eGFR水平的降低而升高。在一项针对中国北方地区一般人群的队列研究中发现[15],相比于肾功能正常组,肾功能中-重度损伤组的老年人全因死亡HR值为1.51(95%CI:1.30~1.74),与本研究结果相似(HR=1.690,95%CI:1.224~2.332)。此外,在中国台湾地区的1项研究中[4],也表明当eGFR降低时,全因死亡风险升高。同时,在心血管疾病、糖尿病、脑卒中患者人群中也显示eGFR水平降低者死亡风险升高[11-13]。本研究在一般人群的基础上重新探讨了中国长寿地区老年人群eGFR水平与死亡风险的关系,结果显示,eGFR水平的下降是老年人全因死亡率升高的独立危险因素。
KDIGO指南指出衰老、蛋白尿、高血压、高血糖、脂质代谢异常、心血管疾病史是CKD发展的危险因素,可影响人体内eGFR水平[18, 28],诱发肾脏损伤,从而增加死亡风险。同时,有研究发现eGFR的降低也会加快高血压、贫血、心肌营养不良、蛋白尿等的发生发展[29-30],进而导致老年人群的死亡风险升高;eGFR的下降还是多种脑卒中的危险因素,当eGFR急剧下降时,急性脑卒中也将显著增加老年人群的死亡风险[13, 31-32]。本研究结果显示,eGFR水平的下降可能会增加老年人死亡风险,由于研究对象样本量不够大,肾功能轻-中度损伤组老年人eGFR水平对全因死亡风险的影响无统计学意义,但趋势检验显示随eGFR水平的降低,全因死亡率呈逐渐上升趋势。此外,肾脏病和其他心血管代谢疾病的治疗情况可能会影响eGFR与全因死亡风险的关系,但遗憾的是本研究未收集老年人CKD治疗及预后相关情况。
本研究具有局限性。首先,本研究无法直接测量GFR,缺乏肾脏损伤的生物标志物,即尿液微量和大量白蛋白以及胱抑素C,故未对各种eGFR方程进行综合比较以评估eGFR对老年人群全因死亡风险的影响;其次,未对死因分类以探讨eGFR与非意外总死亡及不同死因别死亡风险间的关系;最后,研究对象为长寿地区老年人,且年龄段在≥80岁的老年人数量远多于<80岁的老年人,对低龄老年人的代表性较局限,研究结果的外推尚待验证。
综上所述,在老年人群中,eGFR水平的下降与高死亡风险相关联,提示老年人群eGFR低于正常水平可能并非人体正常的老化。因此,在我国老龄化挑战日益严峻的背景下[33],通过监测老年人肾功能,妥善照料和治疗低eGFR水平的老年人,对降低由eGFR水平下降导致的高死亡风险,提高我国老年人生活质量,实现健康老龄化有着重要意义。
利益冲突 所有作者均声明不存在利益冲突
志谢 感谢CLHLS及其子队列HABCS项目组提供数据支持以及参加本项目现场调查的所有工作人员
| [1] |
Webster AC, Nagler EV, Morton RL, et al. Chronic kidney disease[J]. Lancet, 2017, 389(10075): 1238-1252. DOI:10.1016/S0140-6736(16)32064-5 |
| [2] |
Eckardt KU, Coresh J, Devuyst O, et al. Evolving importance of kidney disease:from subspecialty to global health burden[J]. Lancet, 2013, 382(9887): 158-169. DOI:10.1016/S0140-6736(13)60439-0 |
| [3] |
王蓓丽, 郭玮, 潘柏申. 估算肾小球滤过率在慢性肾脏疾病诊疗中的研究现状[J]. 中华检验医学杂志, 2014, 37(12): 899-902. Wang BL, Guo W, Pan BS. Research progress of estimating glomerular filtration rate in chronic kidney disease[J]. Chin J Lab Med, 2014, 37(12): 899-902. DOI:10.3760/cma.j.issn.1009-9158.2014.12.007 |
| [4] |
Cheng TYD, Wen SF, Astor BC, et al. Mortality risks for all causes and cardiovascular diseases and reduced GFR in a middle-aged working population in Taiwan[J]. Am J Kidney Dis, 2008, 52(6): 1051-1060. DOI:10.1053/j.ajkd.2008.05.030 |
| [5] |
Stevens LA, Li SY, Wang CC, et al. Prevalence of CKD and comorbid illness in elderly patients in the United States:results from the Kidney Early Evaluation Program (KEEP)[J]. Am J Kidney Dis, 2010, 55(3 Suppl 2): S23-33. DOI:10.1053/j.ajkd.2009.09.035 |
| [6] |
Stevens LA, Coresh J, Levey AS. CKD in the elderly-old questions and new challenges:World Kidney Day 2008[J]. Am J Kidney Dis, 2008, 51(3): 353-357. DOI:10.1053/j.ajkd.2008.01.009 |
| [7] |
袁丹, 陈海平. 肾小球滤过率水平对老年患者死亡情况的影响[J]. 中国老年学杂志, 2013, 33(3): 544-545. Yuan D, Chen HP. Effect of glomerular filtration rate on mortality in elderly patients[J]. Chin J Gerontol, 2013, 33(3): 544-545. DOI:10.3969/j.issn.1005-9202.2013.03.023 |
| [8] |
Canales MT, Blackwell T, Ishani A, et al. Estimated GFR and mortality in older men:are all eGFR formulae equal[J]. Am J Nephrol, 2016, 43(5): 325-333. DOI:10.1159/000445757 |
| [9] |
Conley J, Tonelli M, Quan HD, et al. Association between GFR, proteinuria, and adverse outcomes among White, Chinese, and South Asian individuals in Canada[J]. Am J Kidney Dis, 2012, 59(3): 390-399. DOI:10.1053/j.ajkd.2011.09.022 |
| [10] |
Roderick PJ, Atkins RJ, Smeeth L, et al. CKD and mortality risk in older people:a community-based population study in the United Kingdom[J]. Am J Kidney Dis, 2009, 53(6): 950-960. DOI:10.1053/j.ajkd.2008.12.036 |
| [11] |
Fung CSC, Wan EYF, Chan AKC, et al. Association of estimated glomerular filtration rate and urine albumin-to-creatinine ratio with incidence of cardiovascular diseases and mortality in Chinese patients with type 2 diabetes mellitus-a population-based retrospective cohort study[J]. BMC Nephrol, 2017, 18: 47. DOI:10.1186/s12882-017-0468-y |
| [12] |
Wan EYF, Fong DYT, Fung CSC, et al. Prediction of five-year all-cause mortality in Chinese patients with type 2 diabetes mellitus-a population-based retrospective cohort study[J]. J Diabet Complicat, 2017, 31(6): 939-944. DOI:10.1016/j.jdiacomp.2017.01.017 |
| [13] |
Zheng LQ, Sun ZQ, Zhang XG, et al. The association between glomerular filtration rate and stroke in hypertensive patients in rural areas of China[J]. J Hypertens, 2012, 30(5): 901-907. DOI:10.1097/HJH.0b013e328352abc0 |
| [14] |
Wen CP, Cheng TYD, Tsai MK, et al. All-cause mortality attributable to chronic kidney disease:a prospective cohort study based on 462293 adults in Taiwan[J]. Lancet, 2008, 371(9631): 2173-2182. DOI:10.1016/S0140-6736(08)60952-6 |
| [15] |
Wu JW, Jia JK, Li ZX, et al. Association of estimated glomerular filtration rate and proteinuria with all-cause mortality in community-based population in China:A Result from Kailuan Study[J]. Sci Rep, 2018, 8: 2157. DOI:10.1038/s41598-018-20554-3 |
| [16] |
Zeng Y. Towards deeper research and better policy for healthy aging-using the unique data of Chinese longitudinal healthy longevity survey[J]. China Economic J, 2012, 5(2/3): 131-149. DOI:10.1080/17538963.2013.764677 |
| [17] |
Teo BW, Xu H, Wang DH, et al. GFR estimating equations in a multiethnic Asian population[J]. Am J Kidney Dis, 2011, 58(1): 56-63. DOI:10.1053/j.ajkd.2011.02.393 |
| [18] |
Stevens PE, Levin A, Kidney Disease:Improving Global Outcomes Chronic Kidney Disease Guideline Development Work Group Members. Evaluation and management of chronic kidney disease:synopsis of the kidney disease:improving global outcomes 2012 clinical practice guideline[J]. Ann Intern Med, 2013, 158(11): 825-830. DOI:10.7326/0003-4819-158-11-201306040-00007 |
| [19] |
Mao C, Yuan JQ, Lv YB, et al. Associations between superoxide dismutase, malondialdehyde and all-cause mortality in older adults:a community-based cohort study[J]. BMC Geriatr, 2019, 19: 104. DOI:10.1186/s12877-019-1109-z |
| [20] |
Stern D, Smith LP, Zhang B, et al. Changes in waist circumference relative to body mass index in Chinese adults, 1993-2009[J]. Int J Obes (Lond), 2014, 38(12): 1503-1510. DOI:10.1038/ijo.2014.74 |
| [21] |
Zhang ZM, Gu DN, Hayward MD. Early life influences on cognitive impairment among oldest old Chinese[J]. J Gerontol Ser B, 2008, 63(1): S25-33. DOI:10.1093/geronb/63.1.s25 |
| [22] |
Katz S, Ford AB, Moskowitz RW, et al. Studies of illness in the aged. The index of ADL:a standardized measure of biological and psychosocial function[J]. JAMA, 1963, 21: 914-919. DOI:10.1001/jama.1963.03060120024016 |
| [23] |
Warnock DG, Delanaye P, Glassock RJ. Risks for all-cause mortality:stratified by age, estimated glomerular filtration rate and albuminuria[J]. Nephron, 2017, 136(4): 292-297. DOI:10.1159/000455197 |
| [24] |
Chen YT, Shih CJ, Ou SM, et al. Periodontal disease and risks of kidney function decline and mortality in older people:a community-based cohort study[J]. Am J Kidney Dis, 2015, 66(2): 223-230. DOI:10.1053/j.ajkd.2015.01.010 |
| [25] |
Iff S, Wong G, Webster AC, et al. Relative energy balance, CKD, and risk of cardiovascular and all-cause mortality[J]. Am J Kidney Dis, 2014, 63(3): 437-445. DOI:10.1053/j.ajkd.2013.08.026 |
| [26] |
Salvador-González B, Gil-Terrón N, Cerain-Herrero MJ, et al. Estimated glomerular filtration rate, cardiovascular events and mortality across age groups among individuals older than 60 years in Southern Europe[J]. Rev Esp Cardiol (Engl Ed), 2018, 71(6): 450-457. DOI:10.1016/j.recesp.2017.08.022 |
| [27] |
Nagai K, Sairenchi T, Irie F, et al. Relationship between estimated glomerular filtration rate and cardiovascular mortality in a Japanese cohort with long-term follow-up[J]. PLoS One, 2016, 11(6): e156792. DOI:10.1371/journal.pone.0156792 |
| [28] |
Kramer H. The national kidney foundation's kidney Disease Outcomes Quality Initiative (KDOQI) Grant Initiative:moving clinical practice forward[J]. Am J Kidney Dis, 2010, 55(3): 411-444. DOI:10.1053/j.ajkd.2009.11.001 |
| [29] |
Go AS, Chertow GM, Fan DJ, et al. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization[J]. N Engl J Med, 2004, 351(13): 1296-1305. DOI:10.1056/NEJMoa041031 |
| [30] |
Mok Y, Matsushita K, Ballew SH, et al. Kidney function, proteinuria, and cancer incidence:the Korean heart study[J]. Am J Kidney Dis, 2017, 70(4): 512-521. DOI:10.1053/j.ajkd.2017.03.018 |
| [31] |
Lee M, Saver JL, Chang KH, et al. Low glomerular filtration rate and risk of stroke:Meta-analysis[J]. BMJ, 2010, 341: c4249. DOI:10.1136/bmj.c4249 |
| [32] |
Tsagalis G, Akrivos T, Alevizaki M, et al. Renal dysfunction in acute stroke:an independent predictor of long-term all combined vascular events and overall mortality[J]. Nephrol Dial Transplant, 2009, 24(1): 194-200. DOI:10.1093/ndt/gfn471 |
| [33] |
何耀. 开展老年健康影响因素的系统研究, 推动老年健康促进行动的科学实践[J]. 中华流行病学杂志, 2020, 41(1): 9-12. He Y. Conducting systematic researches on influencing factors for healthy ageing and promoting scientific implementation of health promotion program for the elderly[J]. Chin J Epidemiol, 2020, 41(1): 9-12. DOI:10.3760/cma.j.issn.0254-6450.2020.01.003 |
 2020, Vol. 41
2020, Vol. 41