文章信息
- 魏锣沛, 李霓, 王刚, 温艳, 吕章艳, 冯小双, 李鑫, 陈玉恒, 陈宏达, 陈朔华, 任建松, 石菊芳, 崔宏, 吴寿岭, 代敏, 赫捷.
- Wei Luopei, Li Ni, Wang Gang, Wen Yan, Lyu Zhangyan, Feng Xiaoshuang, Li Xin, Chen Yuheng, Chen Hongda, Chen Shuohua, Ren Jiansong, Shi Jufang, Cui Hong, Wu Shouling, Dai Min, He Jie.
- 身体测量指标与胃癌发病风险的流行病学研究进展
- Progress in epidemiologic research of association between anthropometric indicators and risk for gastric cancer
- 中华流行病学杂志, 2019, 40(11): 1481-1486
- Chinese Journal of Epidemiology, 2019, 40(11): 1481-1486
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.11.025
-
文章历史
收稿日期: 2019-04-24
2. 开滦总医院肿瘤科, 唐山 063000;
3. 开滦员工健康保健中心, 唐山 063000;
4. 国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院胸外科, 北京 100021
2. Department of Oncology, Kailuan General Hospital, Tangshan 063000, China;
3. Health Department of Kailuan(Group), Tangshan 063000, China;
4. Department of Thoracic Surgery, National Cancer Center/National Clinical Research Center for Cancer/Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021, China
据全球肿瘤估计的最新数据,2018年全球胃癌新发病例约78.3万例,居全球恶性肿瘤发病第5位[1]。肿瘤登记最新数据显示,2015年我国胃癌发病40.3万例,居全国恶性肿瘤发病第2位[2],约占全球胃癌发病的50%。既往研究提示幽门螺杆菌(Helicobacter pylori,Hp)慢性感染、胃癌家族史等是胃癌的最主要的危险因素[3-4]。近年来随着我国人民居住及卫生条件改善、Hp临床诊治的规范,人群Hp慢性感染率呈现下降趋势[5-6],然而胃癌疾病负担问题依然严重,因此积极探索除Hp感染以外的胃癌发病危险因素尤为重要。既往众多流行病学研究表明,BMI、腰围、腰臀比(WHR)、腰围身高比(WHtR)等身体测量指标可能与胃癌发病有关,但研究结论尚未达成一致。本文旨在总结国内外学者对于反映体型的身体测量指标与胃癌发病的最新研究进展,为后续研究提供依据,为胃癌防治提供参考。
1.身体测量指标与胃癌:
流行病学研究常通过简单易测的身体测量指标来定义体脂分布,主要包括BMI、腰围、臀围、WHR、WHtR等。目前使用最为广泛的评价全身性肥胖的指标为BMI。当前WHO按照BMI将人群分为体重过轻(BMI<18.5 kg/m2)、体重正常(18.5~24.9 kg/m2)、超重(25.0~29.9 kg/m2)、肥胖(≥30.0 kg/m2);由于人种不同,中国以BMI值24.0 kg/m2为成年人超重的界限,BMI值28.0 kg/m2为肥胖的界限。然而基于BMI的健康相关指南推荐是否适用于所有对象,目前尚存在争议。有学者提出BMI存在无法区分脂肪与肌肉堆积,且无法有效识别脂肪分布等弊端[7]。因此,流行病学研究常常采用腰围、臀围、WHR、WHtR等反映腹部脂肪堆积的指标作为BMI的重要补充。WHO将男性腰围>102 cm、女性腰围>88 cm定义为腹型肥胖[7],中国肥胖问题工作组将男性腰围≥85 cm、女性腰围≥80 cm定义为腹型肥胖[8]。WHR和WHtR对腹型肥胖也有着较好预测效果,既往研究中常将男性WHR>1.0,女性WHR>0.85作为腹部脂肪堆积的界值。当前国际上比较趋于公认的WHtR诊断切点值为0.50,且该切点值不存在性别或种族差别。
按照病理类型区分,约90%的胃癌发病为腺癌;按照Lauren分型可将胃癌分为肠内型和弥漫型,这两种组织类型在不同年龄、性别人群中分布有明显差异;按照胃癌发病的解剖部位,可以分为贲门癌和非贲门癌[3],该分类方法在流行病学研究中应用最为广泛。胃癌整体发病率在不同性别、种族人群中存在明显差异,男性发病率是女性的2~3倍[9],东亚地区发病率最高,北美地区发病率较低[10]。
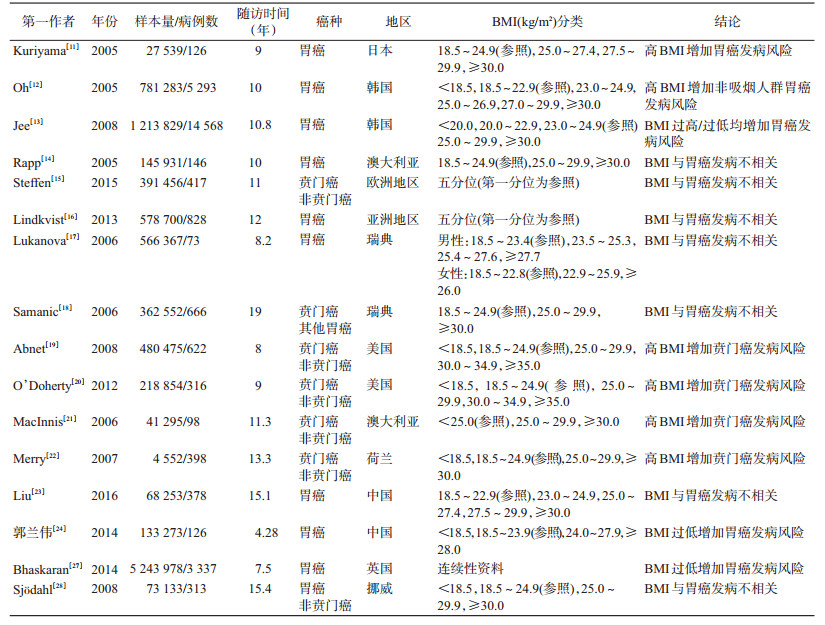
(1)BMI与胃癌:自21世纪以来,随着肥胖疾病负担的日益严重,针对肥胖与胃癌发病的关联研究日益增多。2005年,来自日本的一项队列研究率先发现,与体重正常人群(18.5≤BMI<24.9 kg/m2)相比,BMI升高(27.5≤BMI<29.9 kg/m2)增加胃癌发病风险(HR=1.80,95%CI:1.06~3.05)[11]。同期,韩国的队列研究也证实肥胖增加胃癌发病风险[12-13]。然而,基于欧洲地区[14-15]和亚洲地区人群[16]的研究提示肥胖与人群胃癌发病风险不相关,且按照性别[17]和发病部位(贲门癌和非贲门癌)[18]进行分层分析,仍未见阳性关联存在。随后,基于美国人群[19-20]和澳大利亚人群[21]的队列研究则提示,肥胖可能增加贲门癌发病风险,但与非贲门癌发病无关。来自荷兰的队列研究结果也证实肥胖仅增加贲门癌发病风险,并发现成年期间BMI增加8 kg/m2以上也将增加贲门癌发病风险[22]。针对中国大陆人群的超重/肥胖与胃癌发病的研究相对较少,来自我国上海地区女性队列和北方地区的开滦队列研究提示肥胖与胃癌发病风险无统计学关联[23-24]。Yang等[25]于2009年汇总10项BMI与胃癌发病相关的队列研究进行Meta分析,数据显示肥胖增加胃癌发病风险(OR=1.36,95%CI:1.21~1.54),按照性别、发病部位、地区进行分层,结果显示肥胖与胃癌发病的阳性关联仅存在于男性、贲门癌、非亚洲地区人群中。然而,与上述结果略有不同,最新的Meta分析显示肥胖与胃癌发病风险无统计学关联(HR=1.03,95%CI:1.00~1.06)[26]。关于全身性肥胖与胃癌发病的研究结果目前尚无统一定论,未来需要更多前瞻性研究在探索全身性肥胖与胃癌发病的关系。针对低体重与胃癌发病关联的研究数量有限,Bhaskaran等[27]对527万例英国人群随访7.5年,随访期间累计新发胃癌3 337例,分析发现BMI与胃癌发病呈非线性关联,低体重可能增加胃癌发病风险(RR=1.42,95%CI:1.03~1.96)。然而来自美国的NIH-AARP膳食和健康队列研究[20]、挪威的Nord-Trondelag Health(HUNT)研究结果显示,低体重与贲门癌和非贲门癌均无关联[28]。基于中国人群的开滦队列研究提示,低体重可能增加男性人群胃癌发病风险(HR=3.82,95%CI:1.97~7.38)[24]。目前,对于低体重与胃癌发病的关联探讨,数量有限且研究结论尚未达成一致。有学者认为低体重与胃癌发病的关联可能归因于反向因果关联。低体重人群往往有较大可能为癌前病变或者早期癌患者,在病变早期尚未被发现/诊断前已经影响消化功能,进而导致体重下降,在统计分析中表现为BMI与胃癌发病的反向关联。为有效识别BMI与胃癌发病的真实关联,未来相关研究的开展更应注重人群纳入与排除,避免人群选择偏倚,尽量保证结果可靠性。见表 1。
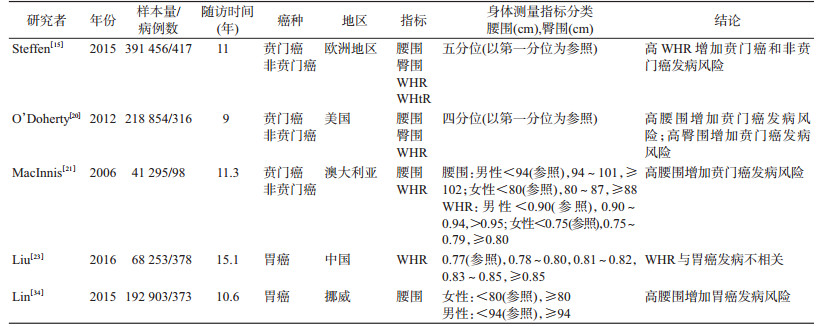
(2)腰围、臀围、WHR和WHtR与胃癌:尽管目前BMI仍然是国际上使用最为广泛的评价全身性肥胖的指标,但是BMI相同的情况下,腹部脂肪堆积差异巨大,BMI不能有效区分脂肪堆积部位,存在一定局限性[7]。此外,与西方人群相比,亚洲地区人群更容易腹部脂肪沉积进而导致腹型肥胖[29]。腰围、臀围、WHR是常常用来反映腹型肥胖的身体测量指标,且既往研究表明,腹型肥胖似乎是独立的危险性预测因素[8],与BMI相比,腹型肥胖相关指标对恶性肿瘤发病预测效果更佳[30]。因此,针对腹型肥胖相关的身体测量指标,如腰围、臀围、WHR等指标开展胃癌发病风险探索具有重要公共卫生学意义。
2006年,MacInnis等[21]在澳大利亚墨尔本协作队列研究中探索腹型肥胖相关指标与胃癌发病的关联,结果显示腰围升高增加贲门癌发病风险,但未见与非贲门癌的关联;然而WHR升高与贲门癌和非贲门癌发病均无统计学关联。随后在美国开展的NIH-AARP膳食与健康队列研究获得一致结果,并发现臀围过高也增加贲门癌发病风险[20]。2015年欧洲地区的EPIC队列研究同样开展了腹型肥胖与胃癌发病的关联探讨,研究结果提示,腹型肥胖相关指标中,WHR(HR=2.18,95%CI:1.24~3.83)增加贲门癌和非贲门癌(HR=2.12,95%CI:1.16~3.89)发病风险[15]。国内相关研究开展较少。
除上述指标外,WHtR也是新近提出的评价腹型肥胖的指标[31],2015年欧洲地区的EPIC队列研究结果提示,WHtR较高可能与贲门癌发病风险升高相关,但与非贲门癌发病并未发现阳性关联,该结果未来仍需前瞻性队列研究及生物学机制研究中进一步验证[15]。
我国肥胖疾病负担严重,全身性肥胖(BMI≥28.0 kg/m2)率从1991年的3.75%上升至2011年的11.3%[32];腹型肥胖(腰围:男性≥90 cm,女性≥80 cm)率由1993年的20.1%上升至2011年的47.7%[33]。然而当前尚无直接证据证实中国人群中肥胖与胃癌发病的阳性关联,未来仍需高质量的基于中国人群的前瞻性队列研究探索并验证,见表 2。
2.身体测量指标与癌症发生的生物学机制:2008年,世界癌症研究基金会和美国国家癌症研究所发布的“食物、营养、身体活动和癌症预防”专家报告会中进一步明确了肥胖与癌症之间的关系,并明确指出保持BMI和腰围在正常范围内是预防癌症发生的重要方法之一[35]。
既往流行病学研究提示,肥胖增加胃癌发病风险。一方面可能由于脂肪组织特别是内脏脂肪导致多种脂肪因子,如肿瘤坏死因子-α、游离脂肪酸、瘦素和炎症标记物释放增加,引起胰岛素抵抗,致使体内胰岛素样生长因子-1(IGF-1)和胰岛素水平升高,从而促进细胞增殖,抑制细胞凋亡,导致癌症发生[36-39]。此外,FTO基因(fat mass and obesity associated gene)[40]、MMP9位点甲基化[41]、组蛋白赖氨酸特异性脱甲基酶-1(histone lysine specific demethylase 1,LSD1)[42]和miR-143[43]先后被证实与胃癌发病相关。另一方面,肠道菌群作为肥胖基本机制的驱动因素渐渐成为研究焦点,研究提示肠道菌群丰富度降低、菌群构成改变与胃癌发病存在阳性关联[44],间接提供了肥胖与胃癌发病关联的证据。
贲门癌与非贲门癌在临床表现、病例特征及预后等均存在明显不同,既往流行学研究提示,肥胖与胃癌的关联在贲门癌中更加明显,可能由于肥胖往往导致腹内压增高,出现胃食管反流,贲门部位胃酸暴露总时间、频率及持续时间均高于非肥胖人群,从而引发炎症或癌前病变,最终导致贲门癌发生[45]。
既往流行病学研究提示体重过低可能增加肺癌、口腔癌、食管癌、胃癌、肝癌等多种癌症的发病风险[27, 46-47]。英国的队列研究及我国开滦队列研究提示体重过低也可能增加胃癌发病风险,其内在机制目前尚不清楚,可能是机体长期处于营养不良状态的结果;低热量饮食或其他原因导致的体重过低往往伴随着机体微量元素/矿物质的长期缺乏,如维生素A、C、E、核黄素、胡萝卜素等[48-49]。上述微量元素和抗氧化剂通过清除体内的氧自由基降低DNA受损伤的概率[50],从而降低胃癌发病、死亡风险。体内微量元素的长期缺乏,可能导致氧自由基清除能力下降,进而导致胃癌发病风险增加。中国香港地区调查结果显示成年人体重过低人群占比有升高趋势[51],提示除肥胖外,我国还可能承担着因体重过轻带来的疾病负担,尤其对于经济落后的偏远地区,采取有效健康干预措施,改善人群营养状况,可能对于胃癌防控具有一定的公共卫生学意义。
3.小结与展望:近年来,超重和肥胖率在全球迅速攀升,随着我国经济的发展以及生活、饮食习惯的改变,超重和肥胖问题在我国迅速蔓延,未来几十年间还有明显增长的趋势[52],与此同时,体重过轻问题也不容忽视。既往关于体型、体脂分布的身体测量指标与胃癌发病关联的研究多在欧美地区开展,多数研究提示全身性肥胖或腹型肥胖可能增加贲门癌发病风险,体重过轻也可能增加胃癌发病风险,但关联有待进一步确证。然而亚洲地区,尤其是作为胃癌高发现场的中国,相关的大型前瞻性队列研究数量有限。西方人群研究结论对我国人群的胃癌防治固然有借鉴意义,但由于肥胖流行情况、人群易感性、种族特征差异、病理类型等不同,其研究结论的外推型,对中国人群的适用性有待进一步考证。
我国队列研究虽起步较晚但发展迅速,如中国慢性前瞻性研究、上海健康队列研究、开滦队列研究等样本量较大,随访时间较长,开展身体测量指标与胃癌发病相关研究有较大优势。当前,各项队列研究相继开展身体测量指标与胃癌发病的线性、非线性关联探索研究,解读除超重和肥胖外,体重过轻对于胃癌发病的影响,深入探讨各项身体测量指标在儿童、青春期、中年期等节点的变化与胃癌发病风险的关联。此外,基于关联探索的结果,开展身体测量指标预测中国人群胃癌发病的适宜界值点的探讨,基于当前已有的较为成熟的胃癌发病风险预测模型,纳入适宜身体测量指标或指标组合,完成风险预测模型的优化及人群应用效果的评价,对高危人群识别及针对性的胃癌防控策略的推广和应用意义重大;再者,近年来随着肠道菌群相关研究的兴起,肠道菌群环境与癌症发病的相关性已逐步得到证实,探索并评价肠道菌群移植、个体靶向菌群治疗等相关体重、体型管理措施对于胃癌防控的效果,也有重要的公共卫生意义。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
IARC. Cancer today[EB/OL].[2019-4-23]. http://gco.iarc.fr/today/home.
|
| [2] |
孙可欣, 郑荣寿, 张思维, 等. 2015年中国分地区恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2019, 28(1): 1-11. Sun KX, Zheng RS, Zhang SW, et al. Report of cancer incidence and mortality in different areas of China, 2015[J]. Chin Cancer, 2019, 28(1): 1-11. DOI:10.11735/j.issn.1004-0242.2019.01.A001 |
| [3] |
Karimi P, Islami F, Anandasabapathy S, et al. Gastric cancer:descriptive epidemiology, risk factors, screening, and prevention[J]. Cancer Epidemiol Biomarkers Prev, 2014, 23(5): 700-713. DOI:10.1158/1055-9965.epi-13-1057 |
| [4] |
Fock KM. Review article:the epidemiology and prevention of gastric cancer[J]. Aliment Pharmacol Ther, 2014, 40(3): 250-260. DOI:10.1111/apt.12814 |
| [5] |
Park JY, Forman D, Waskito LA, et al. Epidemiology of Helicobacter pylori and CagA-positive infections and global variations in gastric cancer[J]. Toxins, 2018, 10(4): 163. DOI:10.3390/toxins10040163 |
| [6] |
张慧, 薛艳, 周丽雅, 等. 北京某三级甲等医院35年间主要上消化道疾病及幽门螺杆菌感染的演变[J]. 中华内科杂志, 2016, 55(6): 440-444. Zhang H, Xue Y, Zhou LY, et al. The changes of main upper gastrointestinal diseases and Helicobacter pylori infection status in the past thirty five years[J]. Chin J Intern Med, 2016, 55(6): 440-444. DOI:10.3760/cma.j.issn.0578-1426.2016.06.008 |
| [7] |
WHO. Obesity:preventing and managing the global epidemic[R]. Geneva, Switzerland:World Health Organ, 2000:1-253.
|
| [8] |
中国肥胖问题工作组. 中国成人超重和肥胖症预防与控制指南(节录)[J]. 营养学报, 2004, 26(1): 1-4. China Working Group on Obesity. Guidelines for prevention and control of overweight and obesity in Chinese adults[J]. Acta Nutr Sin, 2004, 26(1): 1-4. DOI:10.3321/j.issn:0512-7955.2004.01.001 |
| [9] |
Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J]. Int J Cancer, 2010, 127(12): 2893-2917. DOI:10.1002/ijc.25516 |
| [10] |
Forman D, Burley VJ. Gastric cancer:global pattern of the disease and an overview of environmental risk factors[J]. Best Pract Res Clin Gastroenterol, 2006, 20(4): 633-649. DOI:10.1016/j.bpg.2006.04.008 |
| [11] |
Kuriyama S, Tsubono Y, Hozawa A, et al. Obesity and risk of cancer in Japan[J]. Int J Cancer, 2005, 113(1): 148-157. DOI:10.1002/ijc.20529 |
| [12] |
Oh SW, Yoon YS, Shin SA. Effects of excess weight on cancer incidences depending on cancer sites and histologic findings among men:Korea National Health Insurance Corporation study[J]. J Clin Oncol, 2005, 23(21): 4742-4754. DOI:10.1200/JCO.2005.11.726 |
| [13] |
Jee SH, Yun JE, Park EJ, et al. Body mass index and cancer risk in Korean men and women[J]. Int J Cancer, 2008, 123(8): 1892-1896. DOI:10.1002/ijc.23719 |
| [14] |
Rapp K, Schroeder J, Klenk J, et al. Obesity and incidence of cancer:a large cohort study of over 145000 adults in Austria[J]. Br J Cancer, 2005, 93(9): 1062-1067. DOI:10.1038/sj.bjc.6602819 |
| [15] |
Steffen A, Huerta JM, Weiderpass E, et al. General and abdominal obesity and risk of esophageal and gastric adenocarcinoma in the European prospective investigation into cancer and nutrition[J]. Int J Cancer, 2015, 137(3): 646-657. DOI:10.1002/ijc.29432 |
| [16] |
Lindkvist B, Almquist M, Bjørge T, et al. Prospective cohort study of metabolic risk factors and gastric adenocarcinoma risk in the Metabolic Syndrome and Cancer Project (Me-Can)[J]. Cancer Causes Control, 2013, 24(1): 107-116. DOI:10.1007/s10552-012-0096-6 |
| [17] |
Lukanova A, Björ O, Kaaks R, et al. Body mass index and cancer:results from the northern Sweden health and disease cohort[J]. Int J Cancer, 2006, 118(2): 458-466. DOI:10.1002/ijc.21354 |
| [18] |
Samanic C, Chow WH, Gridley G, et al. Relation of body mass index to cancer risk in 362552 Swedish men[J]. Cancer Causes Control, 2006, 17(7): 901-909. DOI:10.1007/s10552-006-0023-9 |
| [19] |
Abnet CC, Freedman ND, Hollenbeck AR, et al. A prospective study of BMI and risk of oesophageal and gastric adenocarcinoma[J]. Eur J Cancer, 2008, 44(3): 465-471. DOI:10.1016/j.ejca.2007.12.009 |
| [20] |
O'Doherty MG, Freedman ND, Hollenbeck AR, et al. A prospective cohort study of obesity and risk of oesophageal and gastric adenocarcinoma in the NIH-AARP Diet and Health Study[J]. Gut, 2012, 61(9): 1261-1268. DOI:10.1136/gutjnl-2011-300551 |
| [21] |
MacInnis RJ, English DR, Hopper JL, et al. Body size and composition and the risk of gastric and oesophageal adenocarcinoma[J]. Int J Cancer, 2006, 118(20): 2628-2631. DOI:10.1002/ijc.21638 |
| [22] |
Merry AHH, Schouten LJ, Goldbohm RA, et al. Body mass index, height and risk of adenocarcinoma of the oesophagus and gastric cardia:a prospective cohort study[J]. Gut, 2007, 56(11): 1503-1511. DOI:10.1136/gut.2006.116665 |
| [23] |
Liu Y, Warren Andersen S, Wen WQ, et al. Prospective cohort study of general and central obesity, weight change trajectory and risk of major cancers among Chinese women[J]. Int J Cancer, 2016, 139(7): 1461-1470. DOI:10.1002/ijc.30187 |
| [24] |
郭兰伟, 李霓, 王刚, 等. BMI与恶性肿瘤发病风险的前瞻性队列研究[J]. 中华流行病学杂志, 2014, 35(3): 231-236. Guo LW, Li N, Wang G, et al. Body mass index and cancer incidence:a prospective cohort study in northern China[J]. Chin J Epidemiol, 2014, 35(3): 231-236. DOI:10.3760/cma.j.issn.0254-6450.2014.03.003 |
| [25] |
Yang P, Zhou Y, Chen B, et al. Overweight, obesity and gastric cancer risk:results from a Meta-analysis of cohort studies[J]. Eur J Cancer, 2009, 45(16): 2867-2873. DOI:10.1016/j.ejca.2009.04.019 |
| [26] |
Fang XX, Wei JY, He XY, et al. Quantitative association between body mass index and the risk of cancer:a global Meta-analysis of prospective cohort studies[J]. Int J Cancer, 2018, 143(7): 1595-1603. DOI:10.1002/ijc.31553 |
| [27] |
Bhaskaran K, Douglas I, Forbes H, et al. Body-mass index and risk of 22 specific cancers:a population-based cohort study of 5·24 million UK adults[J]. Lancet, 2014, 384(9945): 755-765. DOI:10.1016/S0140-6736(14)60892-8 |
| [28] |
Sjödahl K, Jia CQ, Vatten L, et al. Body mass and physical activity and risk of gastric cancer in a population-based cohort study in Norway[J]. Cancer Epidemiol Biomarkers Prev, 2008, 17(1): 135-140. DOI:10.1158/1055-9965 |
| [29] |
WHO Expert Consultation. Appropriate body-mass index for Asian populations and its implications for policy and intervention strategies[J]. Lancet, 2004, 363(9403): 157-163. DOI:10.1016/s0140-6736(03)15268-3 |
| [30] |
Harding JL, Shaw JE, Anstey KJ, et al. Comparison of anthropometric measures as predictors of cancer incidence:a pooled collaborative analysis of 11 Australian cohorts[J]. Int J Cancer, 2015, 137(7): 1699-1708. DOI:10.1002/ijc.29529 |
| [31] |
Lee JS, Aoki K, Kawakubo K, et al. A study on indices of body fat distribution for screening for obesity[J]. Sangyo Eiseigaku Zasshi, 1995, 37(1): 9-18. DOI:10.1539/sangyoeisei.37.9 |
| [32] |
Mi YJ, Zhang B, Wang HJ, et al. Prevalence and secular trends in obesity among Chinese adults, 1991-2011[J]. Am J Prev Med, 2015, 49(5): 661-669. DOI:10.1016/j.amepre.2015.05.005 |
| [33] |
Du P, Zhang B, Wang HJ, et al. The prevalence and secular trends of abdominal obesity among Chinese adults, 1993-2011[J]. Ann Epidemiol, 2015, 25(10): 797-799. DOI:10.1016/j.annepidem.2015.06.082 |
| [34] |
Lin YL, Ness-Jensen E, Hveem K, et al. Metabolic syndrome and esophageal and gastric cancer[J]. Cancer Causes Control, 2015, 26(12): 1825-1834. DOI:10.1007/s10552-015-0675-4 |
| [35] |
Wiseman M. The second World Cancer Research Fund/American Institute for Cancer Research expert report. Food, nutrition, physical activity, and the prevention of cancer:a global perspective[J]. Proc Nutr Soc, 2008, 67(3): 253-256. DOI:10.1017/s002966510800712x |
| [36] |
Freedland ES. Role of a critical visceral adipose tissue threshold (CVATT) in metabolic syndrome:implications for controlling dietary carbohydrates:a review[J]. Nutr Metab (Lond), 2004, 1(1): 12. DOI:10.1186/1743-7075-1-12 |
| [37] |
Neeland IJ, Ayers CR, Rohatgi AK, et al. Associations of visceral and abdominal subcutaneous adipose tissue with markers of cardiac and metabolic risk in obese adults[J]. Obesity (Silver Spring), 2013, 21(9): E439-447. DOI:10.1002/oby.20135 |
| [38] |
Renehan AG, Zwahlen M, Egger M. Adiposity and cancer risk:new mechanistic insights from epidemiology[J]. Nat Rev Cancer, 2015, 15(8): 484-498. DOI:10.1038/nrc3967 |
| [39] |
Hanley AJG, McKeown-Eyssen G, Harris SB, et al. Cross-sectional and prospective associations between abdominal adiposity and proinsulin concentration[J]. J Clin Endocrinol Metab, 2002, 87(1): 77-83. DOI:10.1210/jcem.87.1.8139 |
| [40] |
Xu D, Shao WW, Jiang YS, et al. FTO expression is associated with the occurrence of gastric cancer and prognosis[J]. Oncol Rep, 2017, 38(6): 2285-2292. DOI:10.3892/or.2017.5904 |
| [41] |
Wang R, Deng XY, Yuan CF, et al. IFT80 improves invasion ability in gastric cancer cell line via ift80/p75NGFR/MMP9 signaling[J]. Int J Mol Sci, 2018, 19(11): 3616. DOI:10.3390/ijms19113616 |
| [42] |
Fang RZ, Xu J, Lin H, et al. The histone demethylase lysine-specific demethylase-1-mediated epigenetic silence of KLF2 contributes to gastric cancer cell proliferation, migration, and invasion[J]. Tumour Biol, 2017, 39(4): 1010428317698356. DOI:10.1177/1010428317698356 |
| [43] |
Mao GP, Liu R, Qin YR. miR-143 inhibits cell proliferation of gastric cancer cells through targeting GATA6[J]. Oncol Res, 2018, 26(7): 1023-1029. DOI:10.3727/096504018X15151515028670 |
| [44] |
朱燕燕, 温建勋, 任晓萌, 等. 胃癌患者肠道菌群的分布特点分析[J]. 中国微生态学杂志, 2017, 29(6): 655-658. Zhu YY, Wen JX, Ren XM, et al. The distribution characteristics of intestinal flora in patients with gastric cancer[J]. Chin J Microecol, 2017, 29(6): 655-658. DOI:10.13381/j.cnki.cjm.201706009 |
| [45] |
钱睿, 刘玲, 王玉玲, 等. 肥胖与胃癌的研究进展[J]. 医学综述, 2015, 21(23): 4280-4282. Qian R, Liu L, Wang YL, et al. Research progress in obesity and gastric cancer[J]. Med Recapit, 2015, 21(23): 4280-4282. DOI:10.3969/j.issn.1006-2084.2015.23.020 |
| [46] |
Wei LP, Li N, Wang G, et al. Waist circumference might be a predictor of primary liver cancer:a population-based cohort study[J]. Front Oncol, 2018, 8: 607. DOI:10.3389/fonc.2018.00607 |
| [47] |
谢双华, 王刚, 郭兰伟, 等. 腰围与男性肺癌发病关系的前瞻性队列研究[J]. 中华流行病学杂志, 2017, 38(2): 137-141. Xie SH, Wang G, Guo LW, et al. Relation between waist circumference and risk of male lung cancer incidence:a prospective cohort study[J]. Chin J Epidemiol, 2017, 38(2): 137-141. DOI:10.3760/cma.j.issn.0254-6450.2017.02.001 |
| [48] |
Gao YT, McLaughlin JK, Gridley G, et al. Risk factors for esophageal cancer in Shanghai, China. Ⅱ. Role of diet and nutrients[J]. Int J Cancer, 1994, 58(2): 197-202. DOI:10.1002/ijc.2910580209 |
| [49] |
Pera M, Pera M. Recent changes in the epidemiology of esophageal cancer[J]. Surg Oncol, 2001, 10(3): 81-90. DOI:10.1016/S0960-7404(01)00025-1 |
| [50] |
Chung MY, Lim TG, Lee KW. Molecular mechanisms of chemopreventive phytochemicals against gastroenterological cancer development[J]. World J Gastroenterol, 2013, 19(7): 984-993. DOI:10.3748/wjg.v19.i7.984 |
| [51] |
Mak KK, Ho SY, Lo WS, et al. Health-related physical fitness and weight status in Hong Kong adolescents[J]. BMC Public Health, 2010, 10: 88. DOI:10.1186/1471-2458-10-88 |
| [52] |
唐雯, 李晓松, 潘杰. 中国儿童超重和低体重与家庭社会经济特征相关性研究[J]. 卫生研究, 2014, 43(2): 219-223. Tang W, Li XS, Pan J. Study on the prevalence of childhood overweight and underweight, and the association with family socio-economic status (SES)[J]. J Hyg Res, 2014, 43(2): 219-223. |
 2019, Vol. 40
2019, Vol. 40