文章信息
- 赵爽, 赵雪莲, 胡尚英, 王岩, 热米拉·热扎克, 徐小倩, 段仙芝, 陈凤, 张询, 赵方辉.
- Zhao Shuang, Zhao Xuelian, Hu Shangying, Wang Yan, Remila Rezhake, Xu Xiaoqian, Duan Xianzhi, Chen Feng, Zhang Xun, Zhao Fanghui.
- 汉族和蒙古族女性HPV感染率及型别分布的差异分析
- Comparison of high-risk human papillomavirus infection rate and genotype distribution between Han and Mongolian women
- 中华流行病学杂志, 2019, 40(11): 1439-1444
- Chinese Journal of Epidemiology, 2019, 40(11): 1439-1444
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.11.018
-
文章历史
收稿日期: 2019-03-26
2. 首都医科大学附属北京同仁医院妇产科, 北京 100176;
3. 国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院病理科, 北京 100021
2. Department of Gynecology and Obstetrics, Beijing Tongren Hospital, Capital Medical University, Beijing 100176, China;
3. Department of Pathology, National Cancer Center/National Clinical Research Center for Cancer/Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021, China
子宫颈癌是严重威胁女性健康的恶性生殖系统肿瘤之一,高危人乳头瘤病毒(high risk-human papillomavirus,HR-HPV)的持续感染是宫颈癌发生发展的必要因素。已有研究表明HPV感染具有地域和民族差异,不同地区、不同民族间HPV感染型别的流行病学特征不同[1-3]。目前针对不同民族女性中HPV型别感染情况及不同宫颈病变级别中HPV型别分布情况的研究相对较少。基于此,本研究比较我国汉族和蒙古族女性HPV的感染及型别分布特征,为制定适宜我国不同民族宫颈癌防治策略提供依据。
对象与方法1.研究对象:2017年6月由中国医学科学院肿瘤医院与世界卫生组织/国际癌症研究署(WHO/IARC)合作开展以人群为基础的多中心宫颈癌筛查研究。采用以乡镇为基础的整群抽样的方法,在我国山西省襄垣县、阳城县和内蒙古自治区鄂托克旗3个农村地区选取9 517名30~65岁有性生活、未怀孕、具有完整子宫、无宫颈治疗史、无骨盆放射治疗史并自愿签署知情同意书的女性。本研究获得中国医学科学院肿瘤医院伦理委员会批准。
2.筛查流程:每名研究对象完成宫颈癌危险因素的问卷调查后在基层医务人员指导下采集2份宫颈阴道分泌物标本。采集标本由经过中国医学科学院肿瘤医院专家培训的实验室人员分别进行careHPV及PCR HPV检测(不分型),并对任意阳性标本进行基于PCR方法的HPV分型检测。任一HPV检测方法阳性结果者转诊阴道镜,阴道镜下怀疑有病变的女性,在阴道镜指示下进行直接活检。阴道镜下不满意者行宫颈管搔刮术。
3.检查方法:
(1)careHPV(德国Qiagen公司):检测原理与第二代杂交捕获技术(hybrid capture 2,HC2)检测相似,是基于HC2的原理,样本中的HR-HPV DNA可与混合探针中的互补性RNA探针杂交形成DNA:RNA杂交物。载有抗DNA:RNA杂交物抗体的磁珠可将DNA:RNA杂交物捕获,从而使其与非杂交物分离,含有碱性磷酸酶的抗DNA:RNA杂交物抗体,与被捕获的DNA:RNA杂交物偶合,通过信号放大和化学发光方法定性检测14种HR-HPV(HPV16、18、31、33、35、39、45、51、52、56、58、59、66和68型),但不能单独区分特定型别。标本中检出HPV DNA≥1.0 pg/ml即为阳性。
(2)PCR HPV检测(湖南圣湘生物科技有限公司):采用15种HR-HPV核酸检测试剂盒(湖南圣湘生物科技有限公司,国械注准20163401304)进行PCR HPV不分型检测,该检测方法采用一步法快速检测技术,核酸无需提取,采用荧光定量PCR技术进行检测,可识别涵盖careHPV检测型别在内的15种HR-HPV型别(HPV16、18、31、33、35、39、45、51、52、53、56、58、59、66和68),但不能单独区分特定型别。循环阈值≤39即为阳性。
采用HR-HPV核酸(分型)检测试剂盒(湖南圣湘生物科技有限公司,国械注准20163401295)对careHPV和PCR HPV不分型检测任意阳性标本进行基于PCR方法的HPV分型检测。该检测方法的原理与基于PCR HPV不分型检测相同,但可区分以上15种HR-HPV的特定型别。
4.疾病的确诊:病理结果作为最终疾病诊断金标准,均由中国医学科学院肿瘤医院病理专家在盲法下进行读片或质控,采用宫颈管上皮内瘤变命名系统记录诊断结果,即分为正常、宫颈上皮内瘤样变1级(cervical intraepithelial neoplasia grade 1,CIN1)、宫颈上皮内瘤样变2级(cervical intraepithelial neoplasia grade 2,CIN2)、宫颈上皮内瘤样变3级(cervical intraepithelial neoplasia grade 3,CIN3)和宫颈癌。如未达到临床活检采集要求而无病理学结果者,若属于以下类别之一其病理归为正常:careHPV和PCR检测结果均阴性(HPV检测阴性者其宫颈病变的累积发生率较低[4-5]);阴道镜检查正常[6-7]。
5.统计学分析:汉族和蒙古族女性的基本人口信息,定性资料以例数和百分比(%)表示,定量资料中两民族女性年龄不服从正态分布,故以M(P25~P75)进行描述。不同民族HPV感染率和不同病变检出率的比较采用χ2或Fisher exact检验。所有的统计分析通过SPSS 23.0软件完成,以P<0.05为差异有统计学意义,所有检验均为双侧检验。
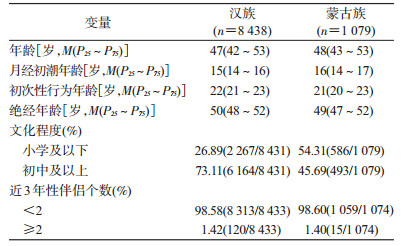
结果1.基本特征:共纳入汉族8 438人、蒙古族1 079人。汉族和蒙古族女性年龄的M(P25~P75)分别为47(42~53)岁和48(43~53)岁;月经初潮年龄分别为15(14~16)岁和16(14~17)岁;初次性行为年龄分别为22(21~23)岁和21(20~23)岁。73.11%(6 164/8 431)的汉族女性文化程度在初中及以上,蒙古族女性为45.69%(493/1 079),差异有统计学意义(χ2=342.497,P<0.001),汉族和蒙古族女性的基本人口学特征见表 1。
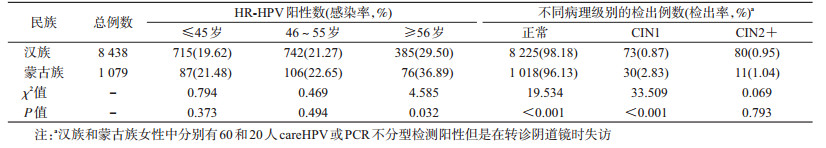
2. HPV感染率:汉族女性中HPV感染率为21.83%(1 842/8 438),蒙古族女性为24.93%(269/1 079),两民族差异有统计学意义(χ2=5.328,P=0.021)。HPV52(4.21%)是汉族女性最常见的HR-HPV型别,占阳性人群的19.27%,其次为HPV58(3.42%)、16(3.09%)、53(2.96%)、68(2.69%)、51(2.39%)。蒙古族女性最常见的HR-HPV型别为HPV58(3.34%)、68(3.34%)、52(3.15%)、16(2.78%)、56(2.50%)、53(2.32%)。汉族女性在以下高危型别的感染率低于蒙古族:HPV18(0.96% vs. 1.85%,χ2=7.276,P=0.007),HPV31(1.27% vs. 2.04%,χ2=4.251,P=0.039),HPV35(0.65% vs. 1.58%,χ2=10.872,P=0.001),HPV45(0.46% vs. 0.93%,χ2=4.031,P=0.045),见表 2。
两民族女性在31~45岁的HPV年龄别感染率相对稳定,汉族女性在46岁之后HPV感染率缓慢上升,蒙古族女性在50岁之后开始上升,且比汉族女性上升更快,在55岁之后超过同年龄段汉族女性的HPV感染率(图 2)。汉族和蒙古族HPV感染率的差别主要体现在≥56岁年龄组人群,HPV感染率分别为29.50%和36.89%,两者差异有统计学意义(χ2=4.585,P=0.032)。见表 3。

|
| 图 2 汉族和蒙古族女性不同年龄组HPV感染率 |
3.宫颈病变检出率及HR-HPV基因型别分布:汉族女性中CIN1、CIN2+的检出率分别为0.87%(73/8 378)、0.95%(80/8 378);蒙古族女性中分别为2.83%(30/1 059)、1.04%(11/1 059)。两民族CIN1的检出率差异有统计学意义(χ2=33.509,P<0.001),CIN2+检出率差异无统计学意义(χ2=0.069,P=0.793),见表 3。
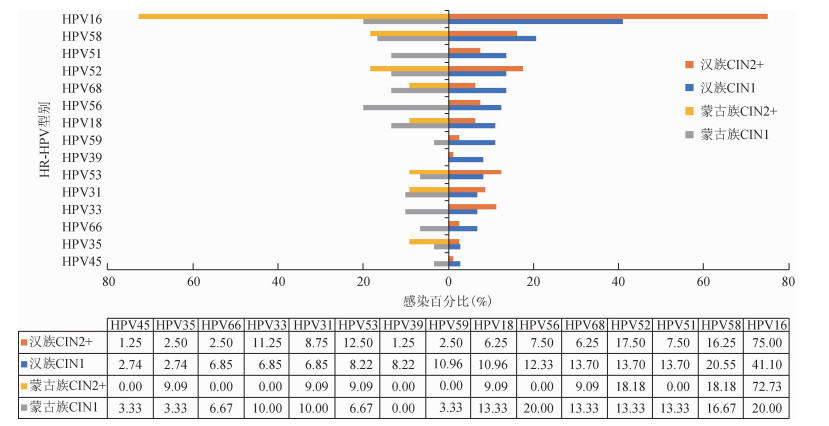
有宫颈病变的汉族和蒙古族女性HPV16感染所占比例均最高(汉族58.82% vs.蒙古族34.14%)。CIN1病变中汉族女性HR-HPV型别分布前6位依次为HPV16、58、51、52、68、56型,蒙古族女性依次为HPV16、56、58、18、51、52、68型,其中HPV16感染所占比例差异有统计学意义(χ2=4.162,P=0.041)。两民族CIN2+女性HR-HPV型别分布排在前3位的均是HPV16、52、58型(图 1)。
|
| 图 1 汉族和蒙古族有宫颈病变女性的HR-HPV的型别分布 |
4. HR-HPV单一与多重感染情况:汉族和蒙古族女性单一HR-HPV感染率分别为58.63%(961/1 639)、55.65%(133/239),多重感染率分别为41.37%(678/1 639)、44.35%(106/239),两民族间差异无统计学意义(χ2=0.764,P=0.382)。
汉族及蒙古族女性间HR-HPV多重感染情况在病变级别正常(40.14% vs. 46.11%,χ2=2.361,P=0.124)、CIN1(50.00% vs. 46.43%,χ2=0.102,P=0.749)、CIN2+(48.10% vs. 27.27%,χ2=1.689,P=0.194)中差异无统计学意义。
讨论本研究比较了我国汉族和蒙古族女性HPV的感染及型别分布特征,结果显示,与汉族女性相比,蒙古族女性HR-HPV感染率较高。汉族女性常见的HPV感染型别为HPV52、58、16、53、68、51型;蒙古族女性最常见的HR-HPV型别为HPV58、68、52、16、56、53型。两民族CIN2+女性HR-HPV型别分布前3位的均是HPV16、52、58型。两民族女性的HPV多重感染情况差别不大。
本研究中HPV阳性率为两种检测方法——careHPV检测和PCR HPV检测任意阳性时的HPV检出率,因此阳性率略高于相关研究中我国女性HR-HPV患病率[8]。蒙古族女性HPV感染率高于汉族女性,与国内其他研究报道一致[9]。本研究中的蒙古族女性来自内蒙古自治区鄂托克旗,该地区地域辽阔,人口分散,且大多数女性生活在边远牧区,距离医疗机构远,医疗卫生服务可及性不高。基于中国人群的17个荟萃分析研究显示,我国女性HPV感染呈现双峰现象,农村女性感染双峰在15~24岁和45~49岁[8]。国外研究同样显示,女性在45~50岁围绝经期会出现HPV感染的第二高峰[10-11]。与本研究结果基本一致,但由于<30岁年龄组的样本量较少,故小年龄组HPV感染的高峰不明显。进一步分析发现两民族的年龄别感染率蒙古族女性在50岁之后开始上升,且比汉族女性上升更快,具体原因尚待探究。
本研究显示在自然人群中HPV52型的检出率高于HPV16型,与国内其他研究报道不完全一致:一些研究显示,HPV16是最常见的HR-HPV基因型别[12-14]。然而,也有研究显示,江苏、广东、浙江省HPV52的流行超过HPV16[15-17]。以上研究表明HPV感染型别的分布存在地区差异。尽管不同研究HPV16检出率的顺位在自然人群中存在差异,但在有宫颈病变人群中HPV16均是首位感染型别。原因是HPV16的致癌力最强,故其在有宫颈病变的人群中所占比例最大。HPV52、58是CIN2+女性中排在HPV16之后的常见感染型别,与其他研究中东亚CIN2女性常见感染型别一致[18-19]。因此,在研制针对中国女性的HPV预防性疫苗时,除了与宫颈癌最为相关的HPV16和18型外,还应提高对HPV52、58型的重视度,进而提高我国人群的HPV免疫效果,从而预防宫颈癌的发生。
段仙芝等[20]的研究显示,蒙古族女性CIN1、CIN2+的检出率分别为2.87%、1.80%,CIN1检出率与本研究相近,CIN2+检出率高于本研究。本研究中汉族和蒙古族女性CIN2+的检出率差异无统计学意义,薛翠娥[21]的研究同样显示宫颈癌患者中鳞癌患者所占比例,汉族和蒙古族差异无统计学意义。但两民族CIN2+检出率的差异仍需大样本研究验证。
目前,国内外关于多重感染与宫颈癌发生风险的研究结论不一。Lee等[22]认为,多重感染发生宫颈癌的危险高于单一型别感染者。张建明等[23]的研究同样发现随着宫颈病变程度的加重,HPV多重感染有增加趋势,且随着宫颈病变的级别增加,多重感染率亦会增高,说明HPV多重感染可能促进宫颈癌的发生。然而,van der Weele等[24]的研究显示HPV的多重感染与HPV的持续感染无关。本研究同样发现,HPV多重感染率并不随着宫颈病变级别的增加而增加,提示HPV多重感染不增加宫颈病变的严重程度。
本研究存在局限性。蒙古族女性全部来自于内蒙古自治区鄂托克旗,且相对汉族女性,蒙古族女性样本量相对较少,可能降低了蒙古族女性的代表性。蒙古族女性HR-HPV的感染情况,仍需进行更大样本量和高质量的HPV型别检测方法的研究。其次,研究表明性伴侣数是影响HPV感染的危险因素[25],本研究中蒙古族女性HPV感染率高于汉族,但两民族性伴侣数的差异不大,结果有待进一步研究进行确认。
综上所述,蒙古族女性的HPV感染率高于汉族。汉族女性常见的HPV感染型别为HPV52、58、16;蒙古族女性最常见的HR-HPV型别为HPV58、68、52。尽管型别分布存在一定差异,但是两民族有宫颈病变的女性(CIN2+)HR-HPV型别分布前3位的均是HPV16、52、58,对汉族和蒙古族女性进行宫颈癌的综合防控时,应提高对HPV16、52、58型的重视。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
de Sanjosé S, Diaz M, Castellsagué X, et al. Worldwide prevalence and genotype distribution of cervical human papillomavirus DNA in women with normal cytology:a Meta-analysis[J]. Lancet Infect Dis, 2007, 7(7): 453-459. DOI:10.1016/S1473-3099(07)70158-5 |
| [2] |
Krul EJT, Van de vijver MJ, Schuuring E, et al. Human papillomavirus in malignant cervical lesions in Surinam, a high-risk country, compared to the Netherlands, a low-risk country[J]. Int J Gynecol Cancer, 1999, 9(3): 206-211. DOI:10.1046/j.1525-1438.1999.99020.x |
| [3] |
Niccolai LM, Mehta NR, Hadler JL. Racial/Ethnic and poverty disparities in human papillomavirus vaccination completion[J]. Am J Prev Med, 2011, 41(4): 428-433. DOI:10.1016/j.amepre.2011.06.032 |
| [4] |
Elfström KM, Smelov V, Johansson AL, et al. Long term duration of protective effect for HPV negative women:follow-up of primary HPV screening randomised controlled trial[J]. BMJ, 2014, 348: g130. DOI:10.1136/bmj.g130 |
| [5] |
Dong L, Hu SY, Zhang Q, et al. Risk prediction of cervical cancer and precancers by type-specific human papillomavirus:evidence from a population-based cohort study in China[J]. Cancer Prev Res, 2017, 10(12): 745-751. DOI:10.1158/1940-6207 |
| [6] |
Zhao XL, Hu SY, Zhang Q, et al. High-risk human papillomavirus genotype distribution and attribution to cervical cancer and precancerous lesions in a rural Chinese population[J]. J Gynecol Oncol, 2017, 28(4): e30. DOI:10.3802/jgo.2017.28.e30 |
| [7] |
Zhao XL, Zhao S, Hu SY, et al. Role of human papillomavirus DNA load in predicting the long-term risk of cervical cancer:a 15-year prospective cohort study in China[J]. J Infect Dis, 2019, 219(2): 215-222. DOI:10.1093/infdis/jiy507 |
| [8] |
Zhao FH, Lewkowitz AK, Hu SY, et al. Prevalence of human papillomavirus and cervical intraepithelial neoplasia in China:a pooled analysis of 17 population-based studies[J]. Int J Cancer, 2012, 131(12): 2929-2938. DOI:10.1002/ijc.27571 |
| [9] |
Wang XH, Ji YP, Li J, et al. Prevalence of human papillomavirus infection in women in the Autonomous Region of Inner Mongolia:a population-based study of a Chinese ethnic minority[J]. J Med Virol, 2018, 90(1): 148-156. DOI:10.1002/jmv.24888 |
| [10] |
Castle PE, Schiffman M, Herrero R, et al. A prospective study of age trends in cervical human papillomavirus acquisition and persistence in Guanacaste, Costa Rica[J]. J Infect Dis, 2005, 191(11): 1808-1816. DOI:10.1086/428779 |
| [11] |
Centurioni MG, Puppo A, Merlo DF, et al. Prevalence of human papillomavirus cervical infection in an Italian asymptomatic population[J]. BMC Infect Dis, 2005, 5: 77. DOI:10.1186/1471-2334-5-77 |
| [12] |
Li LK, Dai M, Clifford GM, et al. Human papillomavirus infection in Shenyang city, People's Republic of China:a population-based study[J]. Br J Cancer, 2006, 95(11): 1593-1597. DOI:10.1038/sj.bjc.6603450 |
| [13] |
Wu RF, Dai M, Qiao YL, et al. Human papillomavirus infection in women in Shenzhen city, People's Republic of China, a population typical of recent Chinese urbanization[J]. Int J Cancer, 2007, 121(6): 1306-1311. DOI:10.1002/ijc.22726 |
| [14] |
Zhao R, Zhang WY, Wu MH, et al. Human papillomavirus infection in Beijing, People's Republic of China:a population-based study[J]. Br J Cancer, 2009, 101(9): 1635-1640. DOI:10.1038/sj.bjc.6605351 |
| [15] |
Zhao FH, Zhu FC, Chen W, et al. Baseline prevalence and type distribution of human papillomavirus in healthy Chinese women aged 18-25 years enrolled in a clinical trial[J]. Int J Cancer, 2014, 135(11): 2604-2611. DOI:10.1002/ijc.28896 |
| [16] |
Zeng ZY, Yang HT, Li ZB, et al. Prevalence and genotype distribution of HPV infection in China:analysis of 51, 345 HPV genotyping results from China's largest CAP certified laboratory[J]. J Cancer, 2016, 7(9): 1037-1043. DOI:10.7150/jca.14971 |
| [17] |
Ye J, Cheng XD, Chen XJ, et al. Prevalence and risk profile of cervical Human papillomavirus infection in Zhejiang Province, southeast China:a population-based study[J]. Virol J, 2010, 7: 66. DOI:10.1186/1743-422X-7-66 |
| [18] |
Chan PKS, Ho WCS, Chan MCW, et al. Meta-analysis on prevalence and attribution of human papillomavirus types 52 and 58 in cervical neoplasia worldwide[J]. PLoS One, 2014, 9(9): e107573. DOI:10.1371/journal.pone.0107573 |
| [19] |
Bosch FX, Burchell AN, Schiffman M, et al. Epidemiology and natural history of human papillomavirus infections and type-specific implications in cervical neoplasia[J]. Vaccine, 2008, 26 Suppl 10: K1-16. DOI:10.1016/j.vaccine.2008.05.064 |
| [20] |
段仙芝, 白鹏来, 王少明. 内蒙古东部地区宫颈癌及宫颈癌前病变的人群筛查研究[J]. 中国妇产科临床杂志, 2012, 13(3): 190-193. Duan XZ, Bai PL, Wang SM. Population-based screening of cervical cancer and precancerous lesions among women from Eastern Area of Inner Mongolia[J]. Chin J Clin Obstet Gynecol, 2012, 13(3): 190-193. DOI:10.3969/j.issn.1672-1861.2012.03.010 |
| [21] |
薛翠娥. 汉族和蒙古族宫颈癌临床病理对比分析[J]. 中国医药科学, 2012, 2(20): 104. Xue CE. Clinicopathological comparative analysis of cervical cancer between Han and Mongolian Nationalitie[J]. China Med Pharm, 2012, 2(20): 104. |
| [22] |
Lee SA, Kang D, Seo SS, et al. Multiple HPV infection in cervical cancer screened by HPVDNAChipTM[J]. Cancer Lett, 2003, 198(2): 187-192. DOI:10.1016/S0304-3835(03)00312-4 |
| [23] |
张建明, 周杨杨, 程建平, 等. 宫颈癌及上皮内瘤变患者人乳头瘤病毒DNA检测及型别分布研究[J]. 现代检验医学杂志, 2010, 25(1): 67-70. Zhang JM, Zhou YY, Cheng JP, et al. Detection and distribution of human papillomavirus genotypes in cervical carcinoma and intraepithelial neoplasia[J]. J Mod Lab Med, 2010, 25(1): 67-70. DOI:10.3969/j.issn.1671-7414.2010.01.022 |
| [24] |
van der Weele P, van Logchem E, Wolffs P, et al. Correlation between viral load, multiplicity of infection, and persistence of HPV16 and HPV18 infection in a Dutch cohort of young women[J]. J Clin Virol, 2016, 83: 6-11. DOI:10.1016/j.jcv.2016.07.020 |
| [25] |
赵娜, 赵方辉, 高晓虹, 等. 城市和农村妇女高危型人乳头瘤病毒感染的危险因素分析[J]. 中华肿瘤防治杂志, 2011, 18(16): 1225-1229. Zhao N, Zhao FH, Gao XH, et al. Risk factors of high-risk human papillomavirus infection in urban and rural area of China[J]. Chin J Cancer Prev Treat, 2011, 18(16): 1225-1229. DOI:10.16073/j.cnki.cjcpt.2011.16.008 |
 2019, Vol. 40
2019, Vol. 40