文章信息
- 宋元君, 罗嘉远, 陈敏, 刘弘, 吴寰宇, 陈涌, 陈洪友, 宫宵欢, 齐辰, 林声, 陆冬磊, 袁政安, 许学斌, 吴凡.
- Song Yuanjun, Luo Jiayuan, Chen Min, Liu Hong, Wu Huanyu, Chen Yong, Chen Hongyou, Gong Xiaohuan, Qi Chen, Lin Sheng, Lu Donglei, Yuan Zheng'an, Xu Xuebin, Wu Fan.
- 上海地区首次发现和阿奇霉素耐药高度相关的肠产毒性大肠埃希菌O:6血清群的流行克隆
- The first identification of epidemic clone of enterotoxic Escherichia coli O: 6 serogroup highly associated with azithromycin resistance in Shanghai
- 中华流行病学杂志, 2019, 40(11): 1403-1408
- Chinese Journal of Epidemiology, 2019, 40(11): 1403-1408
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.11.012
-
文章历史
收稿日期: 2019-05-31
2. 复旦大学上海医学院 200032
2. Fudan University Shanghai Medical College, Shanghai 200032, China
肠产毒性大肠埃希菌(ETEC)是发展中国家儿童和旅行者腹泻的重要病原菌[1]。疫苗和公共卫生干预可使ETEC发病下降,但仍有优势血清群暴发[2-4]。上海市ETEC监测显示病例主要为成年人[5-6]。为揭示流行季节ETEC成年人峰值病例的肠毒素型、血清群、耐药表型、定殖因子及分子型等多维度表型特征,本研究基于2016-2018年上海市腹泻病监测和食源性监测网络的报告病例进行流行病学设计、病例菌株的抽样,通过数据展示,提炼和预警首次发现ETEC特定血清群耐阿奇霉素的优势克隆。
对象与方法1.研究对象和取样方法:研究对象为ETEC腹泻病例,来自2016-2018年上海市腹泻病监测网络(22家哨点医院)和食源性监测网络(26家哨点医院)报告病例数。纳入的ETEC病例须同时满足年龄20~60岁,发病时间为7、8月份,其入选监测点需满足3年中连续,且7、8月各有≥2例实验室确诊病例。符合抽样条件的病例共84例(株),分别来自浦东新区仁济医院、普陀区人民医院、徐汇区第六人民医院、青浦区中山医院青浦分院、宝山区第一人民医院宝山分院和奉贤区平安卫生院。实验室诊断:均为单一ETEC感染,其肠毒素依据不耐热肠毒素(LT)和(或)耐热肠毒素(ST)存在3种分型。所有入选病例菌株经专业实验室统一纯化、复核肠毒素型别后分别按照血清群、耐药表型、定殖因子等毒力基因型和分子型进行多维度、多变量测试。见图 1。

|
| 注:红色数字分别代表2016、2017、2018年的抽样病例数 图 1 入选ETEC病例数和来源分布 |
2.主要试剂和仪器:主要试剂包括麦康凯琼脂平板、细菌基因组DNA提取试剂盒、ETEC检定试剂盒、限制性内切酶XbaⅠ、低熔点琼脂糖、大肠埃希菌O多价和单价血清、革兰阴性需氧菌药敏检测板CMV3AGNF、ETEC定殖因子(CFA/I)、致病蛋白序列(CS1~CS22)、阿奇霉素耐药基因mphA引物[6-7]。检测仪器包括荧光PCR扩增仪C1000TM、PCR扩增仪C1000TouchTM、脉冲场凝胶电泳仪和成像仪、菌液比浊仪、全自动药敏试验菌接种仪、药敏读数仪。
3. ETEC肠毒素型复核及血清分群:3种肠毒素型包括ST型[分为人源(STh)或猪源(STp)]、LT型和复合型(LT+STh/STp);血清群鉴定使用玻片凝集法,纯培养物直接或经100 ℃ 30 min加热、破坏荚膜(K)抗原,血清分群遵循先多价后单价原则,以肉眼呈强凝集者判断结果。
4. ETEC毒力基因型:19种针对定殖因子和蛋白序列(CFs):CFA/I、CS1、CS2、CS3、CS4、CS5、CS6、CS7、CS8、CS12、CS13、CS14、CS15、CS17、CS18、CS19、CS20、CS21、CS22,详见参考文献[7]。
5. ETEC耐药表型:选用美国国家肠道耐药监测(NARMS)推荐定量检测(MIC)药敏板,含7类14种抗生素:头孢西丁(FOX)、阿奇霉素(AZI)、氯霉素(CHL)、四环素(TET)、头孢曲松(AXO)、阿莫西林/克拉维酸(AUG2)、环丙沙星(CIP)、庆大霉素(GEN)、萘啶酸(NAL)、头孢替呋(XHL)、磺胺异恶唑(FIS)、复方新诺明(SXT)、氨苄青霉素(AMP)、链霉素(STR);质量控制菌为大肠埃希菌ATCC25922,操作和结果判断参照2015年NARMS报告和2018年美国临床实验室标准CLSI-M100,多重耐药菌(MDR):对≥3种不同种类抗生素耐药。
6. ETEC分子分型:参考2017年国家致病菌识别网公布电泳参数,以限制性内切酶XbaⅠ对84株ETEC进行酶切。分子量对照为布伦登卢普沙门菌(H9812),聚类分析软件为BioNumerics(7.6),算法为非加权配对平均法(UPGMA),电泳条带优化度1.5%,相似度为100%。
7.基于最终数据和基因验证ETEC耐药克隆:将覆盖本地区的84株流行季节成年人腹泻ETEC完成多维度和多变量数据集成与分析。根据血清群和阿奇霉素之间的高度相关性进行mphA基因的补充验证试验,根据血清群对应的基因阳性病例分析耐药克隆的分子流行特征。
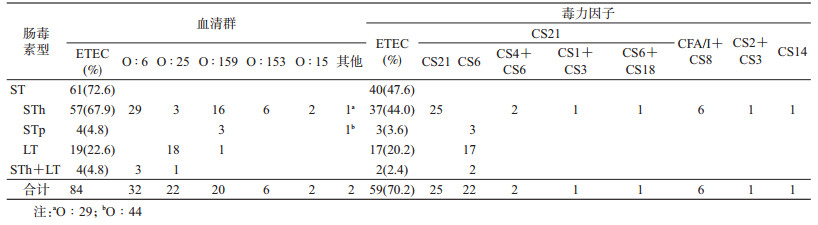
结果1. ETEC成年人病例的肠毒素型、血清群和毒力基因型特征:84株ETEC的肠毒素型以ST型为主(61/84,72.6%),其中STh和STp分别为57株(93.4%)和4株(6.6%);有59株ETEC除肠毒素外携有≥1种的定殖和毒力因子:其中以STh型和CS21(CS1、CS3、CS4、CS6、CS18)的表型组合为优势(29株),有6株STh型的表型为CFA/I和CS8;血清群除2株未能分群外,主要为O:6(32株)、O:25(22株)和O:159(20株),O:6和O:159的肠毒素型以STh型为主,O:25肠毒素型以LT型为主。见表 1。
ETEC年度血清群病例显示,O:25和O:159病例呈递减趋势、O:6病例呈递升趋势、O:153病例仅见于2017年;血清群和毒力因子的关联特征提示,O:25以CS21+CS6为优势型、O:159以不产毒力因子为优势型、O:6以CS21为优势型。见图 2。

|
| 图 2 ETEC成年人病例年度血清群分布和与毒力因子关联 |
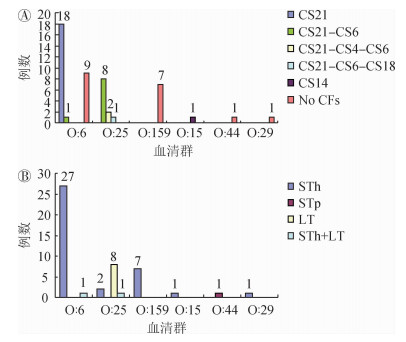
2. ETEC成年人病例的耐药特征:84株ETEC的MIC结果显示磺胺异恶唑耐药最高(98.8%);其次为萘啶酸(70.2%)、氨苄青霉素(55.9%)、阿奇霉素(35.7%);2种常用的三代头孢菌素的耐药>20%、除复方新诺明(16.7%)和四环素(11.9%)外,其他均<10%;MDR构成比为58.3%,见表 2。49株MDR的血清群和肠毒素、细胞毒力因子的关联特征显示,携带毒力因子CS21的O:6群和不携带毒力因子的O:6、O:159、O:44、O:29群等弱毒株产生MDR的比例较高,分别为85.7%(18/21)和70.8%(17/24),见图 2B;MDR肠毒素组合以血清群O:6、O:159携带STh型多见(34/49),O:25以LT型为主。见图 3。
|
| 图 3 ETEC的MDR血清群和毒力、肠毒素关联 |
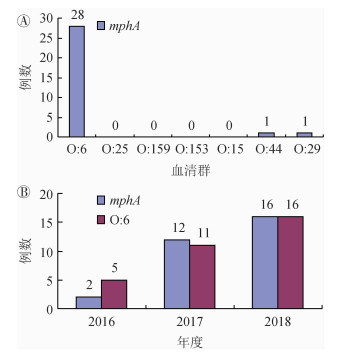
3. ETEC成年人病例基于分子分型的数据展示和分析:84株ETEC电泳图经聚类后获35种带型,优势带型为PT21(14株)、PT14(8株)、PT34(6株)、PT18(5株)。其中PT11、12、13、14、15型均为血清群O:25,遗传相似度超过90%;PT20、21、22、23、24型均为血清群O:6,相似度超过95%。6株PT34型的O:153同源性为100%。见图 4。多维度和多变量数据经集成聚类和展示发现:阿奇霉素耐药型和O:6血清群之间存在高度相关性(28/32),遂验证30株MIC耐药的ETEC阿奇霉素的耐药基因mphA:2株mphA阳性株属未知血清群,28株mphA阳性株均为O:6血清群。28例O:6/mphA病例的年度分布提示见图 5。

|
| 注:FOX:头孢西丁,AZI:阿奇霉素,CHL:氯霉素,TET:四环素,AXO:头孢曲松,AUG2:阿莫西林/克拉维酸,CIP:环丙沙星,GEN:庆大霉素,NAL:萘啶酸,XHL:头孢替呋,FIS:磺胺异恶唑,SXT:复方新诺明,AMP:氨苄青霉素,STR:链霉素 图 4 上海地区ETEC成年人病例基于分子分型聚类的多维度和多变量数据集成(限制性内切酶:XbaⅠ) |
|
| 图 5 ETEC成年人病例阿奇霉素耐药基因的血清群分布和O:6血清群的年度分布 |
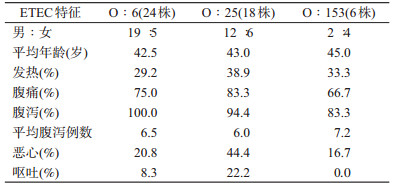
4. 3种ETEC优势克隆病例的临床流行病学特征比较:按照分子分型提示为优势克隆的结果,查找对应3种ETEC血清群/肠毒素/毒力基因型(O:6/STh+CS21、O:25/LT+CS21+CS6、O:153/STh+CFA/I+CS8)的病例特征。O:6和O:25病例皆以成年男性为主,O:25/LT+CS21+CS6病例在发热、腹痛和恶心等临床指标比O:6和O:153严重。O:153/STh+CFA/I+CS8虽具CFA/I分型,但未见危重症状。见表 3。
20世纪80年代,WHO的儿童腹泻多中心研究项目基于ST和LT型肠毒素酶联免疫技术,定义ETEC是发展中国家的儿童仅次痢疾的细菌性腹泻病原[8]。上海市的城市化发展使ETEC流行趋向成年人社交型[6, 9]。早期ETEC多为肠毒素复合型伴有定殖因子CFA/I及数种细胞因子,ETEC疫苗研发应用干预其流行与进化[10-11]。ETEC等肠道菌的耐药增长也是新热点[12]。本研究以近3年ETEC的监测网络和实验室表型分析技术回顾性研究ETEC流行特征,不同于常规分析视角[13-15]。
上海市近3年ETEC病例肠毒素型构成较5年前无明显差异,与深圳市和广东省情况相似[6, 14-15]。优势血清群O:6、O:159、O:153均与STh高度相关,O:25和LT型相关,O:6、O:25和O:159呈交替逆转流行趋势;细胞因子以O:6、O:25组合CS21为优势、O:159携带毒力因子少,唯O:153/STh+CFA/I+CS8和分子克隆特征提示为点源暴发,比对认为可能是输入病例[16]。故上海市ETEC表型特征和浙江省近似、与深圳市差异较大[15-16]。O:6/ST+LT和O:25/LT型是日本高暴发菌型[3]。O:6在ETEC家族古老且广泛分布;O:25和O:159在国内外其他报道中多携带CS6[3-4, 14],此类早期O:6、O:25、O:159以复合型肠毒素为主、携带CFA/I和多种细胞因子,而本研究的ETEC除O:25/LT外多趋向STh和CS21型构成,符合适应性进化特征[17],也说明上海市ETEC血清群发生的适应性进化可能与环境改变有关。
上海市成年人病例的ETEC耐药谱和儿童不同[18],成年人群磺胺类、萘啶酸、氨苄青霉素和阿奇霉素的MIC耐药率超过30%,MDR(58.3%)高于浙江省(34.4%)、与广东省(51.4%)相近[13, 15]。表型特征提示,ETEC弱毒株较易形成MDR。分子分型证实O:6优势克隆(PT20~24)的遗传相似度超过O:25和O:159,佐证了血清群优势转换的互作结果。数据显示,ETEC O:6血清群和阿奇霉素耐药具有一致性,且验证耐药基因mphA存在。耐药克隆始于2016年,流行曲线与O:6的克隆病例一致。阿奇霉素应用临床腹泻感染的历史较短,国内已有耐阿奇霉素宋内志贺菌暴发的报道[19]。本研究发现的ETEC特定表型(O:6/STh+CS21+mphA)和阿奇霉素存在高度相关的报道属全球首次发现[20]。其进化为稳定耐药克隆的内源与移动机制值得进一步研究。
本研究证实,上海地区成年人ETEC存在菌型和特定耐药克隆的优势转换,发现ETEC存在弱毒趋势,可能和儿童、成年人疫苗的知晓和接种有关。本研究没有观察到具有定殖因子的O:153/STh+CFA/I+CS8隐性暴发病例存在临床重症,仅以ETEC归因研究结果提示防控机构应重视水和海产品的高危暴露风险[4]。本研究确信基于流行病学监测结合表型特征分析能发现流行优势群体,多维度、多变量数据展示有助于揭示ETEC优势传播,达到精准监测、预警暴发的目的。
利益冲突 所有作者均声明不存在利益冲突
志谢 谨以此文致敬原上海市防疫站微生物科主任司马惠兰女士早期在ETEC实验室诊断和全球发展中国家开展的儿童腹泻多中心研究的贡献
| [1] |
Qadri F, Svennerholm AM, Faruque ASG, et al. Enterotoxigenic Escherichia coli in developing countries:epidemiology, microbiology, clinical features, treatment, and prevention[J]. Clin Microbiol Rev, 2005, 18(3): 465-483. DOI:10.1128/CMR.18.3.465-483.2005 |
| [2] |
López-Gigosos RM, Plaza E, Díez-Díaz RM, et al. Vaccination strategies to combat an infectious globe:oral cholera vaccines[J]. J Glob Infect Dis, 2011, 3(1): 56-62. DOI:10.4103/0974-777X.77297 |
| [3] |
Konishi N, Onata H, Monma C, et al. Bacteriological and epidemiological characteristics of Enterotoxigenic Escherichia coli isolated in Tokyo, Japan, between 1966 and 2009[J]. J Clin Microbiol, 2011, 49(9): 3348-3351. DOI:10.1128/JCM.02576-10 |
| [4] |
Dalton CB, Mintz ED, Wells JG, et al. Outbreaks of Enterotoxigenic Escherichia coli infection in American adults:a clinical and epidemiologic profile[J]. Epidemiol Infect, 1999, 123(1): 9-16. DOI:10.1017/S095026889900252 |
| [5] |
Pan HJ, Zhang JM, Kuang D, et al. Molecular analysis and antimicrobial susceptibility of enterotoxigenic Escherichia coli from diarrheal patients[J]. Diagn Microbiol Infect Dis, 2015, 81(2): 126-131. DOI:10.1016/j.diagmicrobio.2014.10.008 |
| [6] |
汤泓, 李勇, 张平平, 等. 上海市2012-2013年4种致泻性大肠埃希菌监测[J]. 中华流行病学杂志, 2015, 36(11): 1263-1268. Tang H, Li Y, Zhang PP, et al. Surveillance for diarrheagenic Escherichia coil in Shanghai, 2012-2013[J]. Chin J Epidemiol, 2015, 36(11): 1263-1268. DOI:10.3760/cma.j.issn.0254-6450.2015.11.016 |
| [7] |
Rodas C, Iniguez V, Qadri F, et al. Development of multiplex PCR assays for detection of Enterotoxigenic Escherichia coli colonization factors and toxins[J]. J Clin Microbol, 2009, 47(4): 1218-1220. DOI:10.1128/JCM.00316-09 |
| [8] |
Sima H, Lu GZ, Mathan MM, et al. Etiology of acute diarrhoea among children in developing countries:a multicentre study in five countries[J]. Bull World Health Organ, 1991, 69(5): 549-555. |
| [9] |
Chang HL, Zhang L, Ge YL, et al. A hospital-based case-control study of diarrhea in children in Shanghai[J]. Pediatr Infect Dis J, 2017, 36(11): 1057-1063. DOI:10.1097/INF.0000000000001562 |
| [10] |
Leach S, Lundgren A, Carlin N, et al. Cross-reactivity and avidity of antibody responses induced in humans by the oral inactivated multivalent Enterotoxigenic Escherichia coli (ETEC) vaccine ETVAX[J]. Vaccine, 2017, 35(32): 3966-3973. DOI:10.1016/j.vaccine.2017.06.006 |
| [11] |
Nandre RM, Ruan X, Duan Q, et al. Antibodies derived from an Enterotoxigenic Escherichia coli (ETEC) adhesin tip MEFA (multiepitope fusion antigen) against adherence of nine ETEC adhesins:CFA/I, CS1, CS2, CS3, CS4, CS5, CS6, CS21 and EtpA[J]. Vaccine, 2016, 34(31): 3620-3625. DOI:10.1016/j.vaccine.2016.04.003 |
| [12] |
Liu HB, Zhu BH, Liang BB, et al. A novel mcr-1 variant carried by an IncI2-type plasmid identified from a multidrug resistant Enterotoxigenic Escherichia coli[J]. Front Microbiol, 2018, 9: 815. DOI:10.3389/fmicb.2018.00815 |
| [13] |
何冬梅, 梁宇恒, 柯碧霞, 等. 2013-2016年广东省腹泻患者致泻性大肠埃希菌病原学监测[J]. 中华微生物学和免疫学杂志, 2018, 38(5): 345-353. He DM, Liang YH, Ke BX, et al. Monitoring of diarrheagenic Escherichia coli infections in patients in Guangdong province during 2013 to 2016[J]. Chin J Microbiol Immunol, 2018, 38(5): 345-353. DOI:10.3760/cma.j.issn.0254-5101.2018.05.004 |
| [14] |
Li YH, Luo Q, Shi XL, et al. Phenotypic and genotypic characterization of clinical Enterotoxigenic Escherichia coli isolates from Shenzhen, China[J]. Foodborne Pathog Dis, 2017, 14(6): 333-340. DOI:10.1089/fpd.2016.2233 |
| [15] |
Chen Y, Chen X, Zheng S, et al. Serotypes, genotypes and antimicrobial resistance patterns of human diarrhoeagenic Escherichia coli isolates circulating in southeastern China[J]. Clin Microbiol Infect, 2014, 20(1): 52-58. DOI:10.1111/1469-0691.12188 |
| [16] |
李毅, 章乐怡, 胡玉琴. 一起聚集性腹泻事件致病菌分子特征分析[J]. 预防医学, 2018, 30(12): 1272-1274. Li Y, Zhang YY, Hu YQ. Characteristic analysis of pathogens in an aggregated diarrhea Event[J]. Prev Med, 2018, 30(12): 1272-1274. DOI:10.19485/j.cnki.issn2096-5087.2018.12.023 |
| [17] |
Blackburn D, Husband A, Saldaña Z, et al. Distribution of the Escherichia coli common pilus among diverse strains of human Enterotoxigenic E. coli[J]. J Clin Microbiol, 2009, 47(6): 1781-1784. DOI:10.1128/JCM.00260-09 |
| [18] |
常海岭, 李月芳, 曾玫, 等. 儿童致泻性大肠埃希菌腹泻临床与病原分布特点[J]. 中华传染病杂志, 2015, 33(3): 137-141. Chang HL, Li YF, Zeng M, et al. Clinical and etiologic features of diarrheagenic Escherichia coli-associated diarrhea in children[J]. Chin J Infect Dis, 2015, 33(3): 137-141. DOI:10.3760/cma.j.issn.1000-6680.2015.03.004 |
| [19] |
Ma QX, Xu XB, Luo M, et al. A waterborne outbreak of Shigella sonnei with resistance to azithromycin and third-generation cephalosporins in China in 2015[J]. Antimicrob Agents Chemother, 2017, 61(6): e00308-17. DOI:10.1128/AAC.00308-17 |
| [20] |
Pattabiraman V, Katz LS, Chen JC, et al. Genome wide characterization of Enterotoxigenic Escherichia coli serogroup O:6 isolates from multiple outbreaks and sporadic infections from 1975-2016[J]. PLoS One, 2018, 13(12): e0208735. DOI:10.1371/journal.pone.0208735 |
 2019, Vol. 40
2019, Vol. 40