文章信息
- 胥洋, 丁呈怡, 卓琳, 詹思延.
- Xu Yang, Ding Chengyi, Zhuo Lin, Zhan Siyan.
- 《中国药物流行病学研究方法学指南(T/CPHARMA 002-2019)》团体标准制定过程
- Developing process of guide on methodological standards in pharmacoepidemiology (T/CPHARMA 002-2019)
- 中华流行病学杂志, 2019, 40(10): 1186-1190
- Chinese Journal of Epidemiology, 2019, 40(10): 1186-1190
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.10.003
-
文章历史
收稿日期: 2019-09-24
2. 北京大学第三医院临床流行病学研究中心 100191
2. Research Center of Clinical Epidemiology, Peking University Third Hospital, Beijing 100191, China
药物流行病学是一门研究药物及医疗产品在人群中的使用情况(utilization)和使用效果(risk and effectiveness)的学科,其研究方法与传统流行病学的研究方法部分类似,但是也有自身独特的地方[1]。研究设计是否合理,统计分析是否恰当直接关系到一个药物流行病学研究的成败。而判断研究设计的合理性与统计分析的恰当性需要参照专门性指南。在我国,药物流行病学研究虽然尚处于起步阶段,但是发展迅速,因此制定一部专门的药物流行病学研究方法学指南就显得尤为紧迫和重要。有鉴于此,中国药学会药物流行病学专业委员会申请了中国科学技术协会“2016年承接政府转移职能与科技公共服务工程”项目并获得支持,开启了《药物流行病学研究方法学指南(T/CPHARMA 002-2019)》[2]的制定。
实际上,为规范药物流行病学研究,世界各国管理机构和学会组织均制定了自己的指南。我国有着独特的国情,无法完全照搬国外指南,加之我国药物流行病学研究领域技术力量薄弱,拥有相关研究经验的人员极其匮乏,因此我国药物流行病学指南的制定要走引进-改造的路径,本文将对这一路径进行详细的描述。
一、方法1.指南制定流程:药物流行病学研究方法学指南制作步骤分为定性系统综述、半结构化问卷调查和专家评阅。第一部分,采用了系统综述的方法与标准流程,对文献进行全面检索,最大限度地减小了遗失关键文献引起的研究结果偏倚。第二部分,采用了定量打分制和德尔菲法相结合。将半结构化问卷发放给来自流行病学、统计学、临床药学、药事管理等多学科的22位专家征询意见,使用定量打分制来决定指南内容,客观地评价了专家对药物流行学研究领域各方面内容的关注程度,确保指南涵盖的内容能够满足大多数研究者的需求,又避免了指南篇幅过大。德尔菲法采用多轮专家反复评议的方式,保证了指南具体推荐条目可以兼顾各方意见,避免了某位权威专家的个人观点占据主导[3]。第三部分,咨询了我国药物流行病学领域比较权威的多位专家,这些专家都有多年在我国开展药物流行病学研究的经验,保证了指南的权威性以及与我国国情的适应性。
2.团体标准的制定:根据团体标准的相关规定和格式要求,在三步骤指南制定流程的基础上,对指南格式和部分内容进行修改,形成意见征求稿后向社会公布,收集有关单位及专家所提出的具体的修改意见和建议,并根据意见反馈作进一步修订。
3.统计学分析:本研究的统计分析为描述性统计,其中连续型变量计算均值与标准差,分类型变量计算频数和百分比。
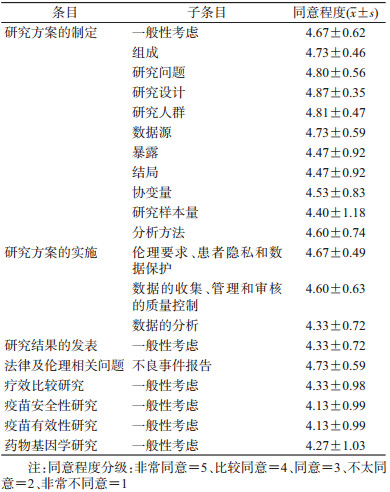
二、结果1.定性系统综述结果:在世界各国管理机构和学会组织的官网上进行手动检索,纳入关于药物流行病学研究的指南共计10份[4-13],其中有关药物流行病学研究的指南4份,有关基于多用途的健康数据库开展药物流行病学研究的指南3份,有关通过多研究者合作或多数据源合并开展药物流行病学研究的指南3份,纳入的指南具体情况见表 1。
通过对上述指南的梳理与总结,提取关键信息点,发现上述指南主要围绕研究方案的制定、研究方案的实施、研究结果的发表、法律及伦理4个方面进行阐述,有些指南还进一步说明了具体的研究设计类型和实施中需要注意的问题,主要包括的研究类型包括疗效比较研究、疫苗安全性和/或有效性研究、药物基因学研究。
在研究方案的制定方面,各指南主要围绕研究方案制定的一般性考虑、研究方案的组成、研究问题、研究设计、研究人群、数据源、暴露、结局、协变量、研究样本量、统计分析方法这几个方面进行说明。在研究方案的实施方面,各指南主要在伦理要求、患者隐私和数据保护,数据的收集、管理和审核的质量控制,数据的分析3个方面给予指导。在研究结果的发表方面,各指南主要回答了研究结果应该报告什么,报告给谁这两个问题。在法律及伦理相关问题上,各指南主要关注不良反应的报告。涉及具体研究类型的指南对该研究设计和实施中的关键点进行了着重说明。
2.半结构式问卷调查结果:根据定性系统综述的结果,构建半结构化问卷,问卷主要由三大部分组成:第一部分为问卷填写人的基本信息,由9个问题组成,包括填写人的姓名、年龄、性别、学历、职称、职务、相关工作年限、对药物流行病学研究方法学的判断依据、对药物流行病学研究方法学的熟悉程度。第二、三部分主要依据前面定性系统综述中总结的各指南结构,建立了5个条目共20个子条目的半结构化问题;第二部分主要征询每个子条目是否应该包括在我国的药物流行病学研究方法学指南中,采取1~5分的打分制;第三部分主要以Guide on Methodological Standards in Pharmacoepidemiology(Revision 5),European Network of Centres for Pharmacoepidemiology and Pharmacovigilance,Guidelines for Good Pharmacoepidemiology Practices(GPP)(Reversion 3),International Society for Pharmacoepidemiology这两部指南为主体,其他指南为补充,询问专家对于这些指南中每个子条目下相关推荐意见的看法,并根据我国国情进行修改。
本研究于2016年9月23日召开专家讨论会,现场发放了半结构式问卷,共发放问卷22份,回收15份,问卷回收率为68.1%。
(1)填写人信息情况:填写人共15人,其中男性4人、女性11人,平均年龄为51岁。问卷填写人总体学历、职称较高,从事相关工作的年限较长,对药物流行病学研究方法学的熟悉程度也较高,详细统计信息见表 2。
(2)指南结构情况:专家总体上同意5个条目共20个子条目的指南框架结构,但是指出疫苗安全性研究和疫苗有效性研究2个子条目可以考虑合并,20个子条目是否纳入药物流行病学研究方法学指南的同意程度见表 3。
(3)各子条目内容修改意见情况:专家对于子条目中的具体内容进行了针对性的修改,意见如下:对于子条目数据源,有专家指出随着利用二次数据源开展流行病学研究逐渐普遍,应结合我国国情,推荐一些质量好且可用于研究的具体二次数据源;对于子条目协变量,有专家提议是否考虑引入因果关系图分析暴露、协变量和结局之间的关系,为后续统计模型的建立打下基础;对于子条目药物基因组学研究,有专家指出要考虑到候选基因筛选的问题。
3.指南写作与评阅结果:根据上述建议完成了指南初稿的写作,于2017年5月19日送予8名专家进行评阅修改,于2017年7月9日完成了指南的定稿工作,并于2017年7月20日在兰州召开的全国药物流行病学年会上向全体参会代表进行了首次公开解读,同时在专委会网站上进行广泛的意见征集。最终版的指南包括两大部分7条目,第一部分为基本研究流程,包括研究方案的制定、研究方案的实施、研究结果的发表和法律及伦理4个条目的相关问题,第二部分为具体研究类型,包括疗效比较研究、疫苗安全性和有效性研究及药物基因组学研究3个条目,指南全文共计6 815字。该指南已于2019年1月在药物流行病学杂志上刊出[14]。
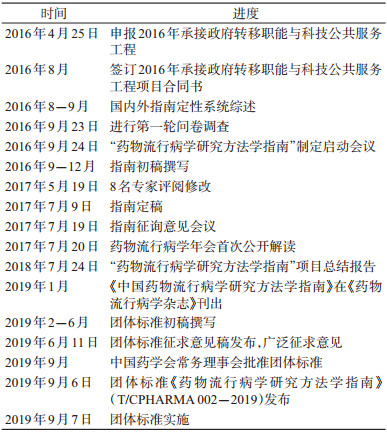
4.团体标准的制定:为响应2015年国务院针对我国标准制定、标准供给的一些体制机制瓶颈问题,加强我国的技术标准体系建设和深化标准化工作改革需求及《深化标准化工作改革方案》和2019年1月国家标准化委员会及民政部联合颁布的《团体标准管理规定》精神[15-16],中国药学会组织各专业委员会开展了团体标准工作。药物流行病学专业委员会在经过三步骤所制定的指南基础上,根据《标准化工作导则第1部分:标准的结构和编写》与《标准编写规则》草拟了《中国药物流行病学研究方法学指南(征求意见稿)》[17-18],并于2019年6月11日通过中国药学会网站及全国团体标准信息平台向社会公布,向各有关单位及专家广泛征求意见。
公示期内,共收到5位专家针对7个子条目的修改意见。中国药学会组织专委会讨论,邀请团体标准专家作多轮修订,形成团体标准终稿,全文共计7 798字。经中国药学会常务理事会研究,批准由中国药学会药物流行病学专业委员会起草编制的《药物流行病学研究方法学指南(T/CPHARMA 002-2019)》为中国药学会团体标准,并于2019年9月6日发布,2019年9月7日起实施。团体标准制定时间进度见表 4。
1.指南制作方法:目前指南的制定方法主要有两种,一是基于系统评价的结果生成推荐意见[19-20],二是基于专家意见生成推荐意见[21]。本指南的制定过程融合了上述两种方法,在推荐意见池生成过程中采用了文献系统综述的方法,在推荐意见池提炼过程中采用了行业专家评议的方法,这在药物流行病学研究方法学指南的制定上尚属首创。欧洲和美国相应的指南的制定方法[4-5, 11]:召集相应研究领域的专家,确定指南的基本框架,专家根据自己最熟悉的研究方向书写框架下的某一部分内容,最后再次召集专家集中评议。此种方法适应于指南制订国家在某一研究领域上已经有一定的研究积累,该领域各个研究方向有一定的人才储备,且有相应的学科带头人。此种方法的弊端在于某一研究方向上容易受到学术权威的影响,某些内容仅受学术权威个人观点的影响,缺乏公允性。但是,此种方法在国际上首次制定某种指南时是必须的,在后续可以通过指南版本的更新逐渐剔除和修正缺乏广泛认可度的推荐意见。而我国的指南制定前,国际上已经发布了多部指南,因此再采取欧美的方法就有些不合时宜。
2.优势与局限性:
(1)优势:与国外的药物流行病学指南相比[4, 6],本指南从制定到征询意见稿发布耗时一年多,可以说是一本快速建议指南,这与我国药物流行病学研究大多水平不高,与国际存在一定的脱节,急需规范化的现状是相适应的[22]。本指南制定过程中汇聚了中国最权威的药物流行病学研究者,问卷调查阶段咨询专家22人,指南评阅阶段咨询专家8人,这些研究者来源于高校、医院和企业,背景各不相同,有流行病学专家,统计方法学专家,也有一线医生、药师等,因此本指南兼顾了各方需求,这就决定本指南适用范围较广,适合为多种不同场景下开展药物流行病学研究提供指引。
(2)局限性:本指南的局限性主要体现在原创性不足上,本指南的制定流程使用的是引进-改造的方法,这就意味着指南中的推荐意见大多是对国外相关指南的中国化改造,并不是基于中国药物流行病学研究者自己学术观点的提炼和汇总。但在现阶段实属无奈之举,我国药物流行病学研究基础相对薄弱,处于起步阶段,大多数研究者仅从事应用类研究,即评价某一药物和某一研究结局的相关性,对研究方法学重视不足,方法学探索性文章鲜有发表,如药物流行病学研究的关键问题之一,时间依赖性偏倚和混杂的识别与控制[23],中国学者对此的理解和思考就略显不足,缺乏相应的控制手段,在应用类研究中往往忽略,更不用说提出自己的独有观点。本指南的局限性还体现在对于伦理相关的问题的重视程度不够,这是由于我国长期以来药物流行病学研究对于伦理的忽视,缺乏此方面的经验积累,在指南书写时又由于我国国情的特殊性较难从国外指南中得到借鉴。可喜的是,我国药物流行病学研究者对伦理问题越来越重视,相信在本指南的下一次修订时,这一问题能够得到较大的改观。
药物流行病学研究方法学指南,是我国第一部对药物流行病学研究的各个环节给予明确指导的指南,且该指南的制定流程遵循科学性的原则,因此该指南的发布对于规范我国药物流行病学研究工作有着深远的意义。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
International Society for Pharmacoepidemiology (ISPE). About Pharmacoepidemiology[EB/OL]. (2016)[2019-09-15]. https://www.pharmacoepi.org/about-ispe/about-pharmacoepidemiology/.
|
| [2] |
中国药学会药物流行病学专业委员会. 中国药物流行病学研究方法学指南(T/CPHARMA 002-2019)[J]. 中华流行病学杂志, 2019, 40(10): 000-000. Pharmacoepidemiology Professional Committee of Chinese Pharmaceutical Association. Guide on methodological standards in pharmacoepidemiology(T/CPHARMA 002-2019)[J]. Chin J Epidemiol, 2019, 40(10): 000-000. DOI:10.3760/cma.j.issn.0254-6450.2019.10.000 |
| [3] |
Loo R. The Delphi method:a powerful tool for strategic management[J]. Polic:Int J, 2002, 25(4): 762-769. DOI:10.1108/13639510210450677 |
| [4] |
European Medicines Agency. Guideline on good pharmacovigilance practices[EB/OL]. (2014-12-28)[2019-09-15]. https://www.ema.europa.eu/en/human-regulatory/post-authorisation/pharmacovigilance/good-pharmacovigilance-practices.
|
| [5] |
European Network of Centres for Pharmacoepidemiology and Pharmacovigilance. Guide on methodological standards in pharmacoepidemiology (revision 5)[EB/OL]. (2016)[2019-09-15]. http://www.encepp.eu/standards_and_guidances/methodologicalGuide.shtml.
|
| [6] |
International Society for Pharmacoepidemiology. Guidelines for good pharmacoepidemiology practices (GPP) (reversion 3)[EB/OL]. (2015-06)[2019-09-15]. https://www.pharmacoepi.org/resources/policies/guidelines-08027/.
|
| [7] |
European Medicines Agency. Guideline on conduct of pharmacovigilance for medicines used by the paediatric population[EB/OL]. (2006-07-28)[2019-09-15]. https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-conduct-pharmacovigilance-medicines-used-paediatric-population_en.pdf.
|
| [8] |
U.S. Food and Drug Administration. Best practices for conducting and reporting pharmacoepidemiologic safety studies using electronic healthcare data[EB/OL]. (2013-05)[2019-09-15]. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/best-practices-conducting-and-reporting-pharmacoepidemiologic-safety-studies-using-electronic.
|
| [9] |
Hall GC, Sauer B, Bourke A, et al. Guidelines for good database selection and use in pharmacoepidemiology research[J]. Pharmacoepidemiol Drug Saf, 2012, 21(1): 1-10. DOI:10.1002/pds.2229 |
| [10] |
(AGENS) WGftSaUoSD. GPS-good practice in secondary data analysis: revision after fundamental reworking[EB/OL]. (2008)[2019-09-15]. https://www.dgepi.de/assets/Leitlinien-und-Empfehlungen/Practice-in-Secondary-Data-Analysis.pdf.
|
| [11] |
Mini-Sentinel Collaborating Centers. Mini-sentinel statement of principles and policies[EB/OL]. (2014-05-01). http://www.mini-sentinel.org/about_us/principles_and_policies.aspx.
|
| [12] |
Verstraeten T, DeStefano F, Chen RT, et al. Vaccine safety surveillance using large linked databases:opportunities, hazards and proposed guidelines[J]. Exp Rev Vacc, 2003, 2(1): 21-29. DOI:10.1586/14760584.2.1.21 |
| [13] |
Coloma PM, Schuemie MJ, TrifiròG, et al. Combining electronic healthcare databases in Europe to allow for large-scale drug safety monitoring:the EU-ADR Project[J]. Pharmacoepidemiol Drug Saf, 2011, 20(1): 1-11. DOI:10.1002/pds.2053 |
| [14] |
中国药学会药物流行病学专业委员会. 中国药物流行病学研究方法学指南[J]. 药物流行病学杂志, 2019, 28(1): 5-9. Pharmacoepidemiology Professional Committee of Chinese Pharmaceutical Association. Guide on methodological standards in pharmacoepidemiology[J]. Chin J Pharmacoepidemiol, 2019, 28(1): 5-9. |
| [15] |
国务院.国务院关于印发深化标准化工作改革方案的通知, 2015[EB/OL]. (2015-03-11)[2019-12-01].http://www.gov.cn/zhengce/content/2015-03/26/content_9557.htm. State Council. Notification of State Council on the issuance of reforming plans for deepen the standardization[EB/OL]. (2015-03-11)[2019-12-01]. http://www.gov.cn/zhengce/content/2015-03/26/content_9557.htm. |
| [16] |
国家标准化管理委员会, 民政部.国家标准化管理委员会民政部关于印发《团体标准管理规定》的通知[EB/OL]. (2019-01-09)[2019-08-31].http://images3.mca.gov.cn/www2017/file/201901/1547801421687.pdf. National Standardization Committee, Ministry of Civil Affairs. Notification of the ministry of civil affairs on the issuance of regulations on the management of group standards[EB/OL]. (2019-01-09)[2019-08-31]. http://images3.mca.gov.cn/www2017/file/201901/1547801421687.pdf. |
| [17] |
逄征虎. GB/T 1.1-2000《标准化工作导则第1部分:标准的结构和编写规则》介[J]. 中国个体防护装备, 2001(5): 29-31. Pang ZH. Guidelines for standardization:part 1[J]. Chin J Protect Prev, 2001(5): 29-31. DOI:10.3969/j.issn.1671-0312.2001.05.008 |
| [18] |
国家质量技术监督局. 标准编写规则[M]. 北京: 中国标准出版社, 2001. National Bureau of Quality and Technical Supervision. Rules for drafting standards[M]. Beijing: Standards Press of China, 2001. |
| [19] |
Chen K, Zhang X, Ke X, et al. Individualized medication of Voriconazole:a practice guideline of the division of therapeutic drug monitoring, Chinese pharmacological society[J]. Ther Drug Monit, 2018, 40(6): 663-674. |
| [20] |
唐惠林, 陈耀龙, 门鹏, 等. 《基于肠促胰素治疗药物临床应用的快速建议指南》方法学介绍[J]. 中国医院药学杂志, 2017, 37(18): 1860-1863. Tang HL, Chen YL, Men P, et al. Introduction of the method described in a rapid advice guideline of the clinical application of incretin based therapies[J]. Chin J Hosp Pharm, 2017, 37(18): 1860-1863. DOI:10.13286/j.cnki.chinhosppharmacyj.2017.18.21 |
| [21] |
中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2013年版)[J]. 中华糖尿病杂志, 2014, 22(8): 2-42. Diabetes Society of Chinese Medical Association. Guidelines for the prevention and treatment of type 2 diabetes in China (2013 edition)[J]. Chin J Diabetes, 2014, 22(8): 2-42. |
| [22] |
王小琴, 陈耀龙, 杨楠, 等. 快速建议指南及其制定方法介绍[J]. 中国循证医学杂志, 2015, 15(9): 1103-1105. Wang XQ, Chen YL, Yang N, et al. Rapid advice guideline and its methodology:an introduction[J]. Chin J Evid-based Med, 2015, 15(9): 1103-1105. |
| [23] |
Pazzagli L, Linder M, Zhang ML, et al. Methods for time-varying exposure related problems in pharmacoepidemiology:an overview[J]. Pharmacoepidemiol Drug Saf, 2018, 27(2): 148-160. DOI:10.1002/pds.4372 |
 2019, Vol. 40
2019, Vol. 40