文章信息
- 滕艾颖, 徐留臣, 杨鹏, 孙成云, 陈保立, 王爽, 寇增强, 房明, 王苗苗, 毕振强.
- Teng Aiying, Xu Liuchen, Yang Peng, Sun Chengyun, Chen Baoli, Wang Shuang, Kou Zengqiang, Fang Ming, Wang Miaomiao, Bi Zhenqiang.
- 山东省某地产超广谱β-内酰胺酶大肠埃希菌耐药情况及多位点序列分型
- Multi locus sequence typing and antibiotic susceptibility of extended-spectrum beta-lactamases producing Enterobacteriaceae in rural residents in villages with pig-breeding farms in Shandong province
- 中华流行病学杂志, 2019, 40(9): 1145-1149
- Chinese Journal of Epidemiology, 2019, 40(9): 1145-1149
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.09.024
-
文章历史
收稿日期: 2019-01-26
2. 山东省疾病预防控制中心细菌性传染病防制所, 济南 250014;
3. 诸城市疾病预防控制中心 262200;
4. 济宁医学院附属医院 272029;
5. 山东省疾病预防控制中心, 济南 250014;
6. 山东省传染病预防控制重点实验室, 济南 250014;
7. 山东大学预防医学研究院, 济南 250014
2. Institute for Bacterial Infectious Disease Control and Prevention, Shandong Provincial Center for Disease Control and Prevention, Jinan 250014, China;
3. Zhucheng County Center for Disease Control and Prevention, Zhucheng 262200, China;
4. Affiliated Hospital of Jining Medical University, Jining 272029, China;
5. Shandong Provincial Center for Disease Control and Prevention, Jinan 250014, China;
6. Shandong Key Laboratory for Communicable Disease Control and Prevention, Jinan 250014, China;
7. Shandong University Institute of Preventive Medicine, Jinan 250014, China
近年来,革兰阴性杆菌尤其是大肠埃希菌对临床常见抗菌药物的耐药率呈增长趋势[1],其对β-内酰胺类抗菌药物产生耐药性的主要原因是超广谱β-内酰胺酶(Extended-spectrum β-lactamases,ESBLs)的产生。中国细菌耐药监测研究报告显示,临床分离大肠埃希菌中的ESBLs检出率为59.4%[2]。细菌耐药性的增强,会导致感染者住院时间延长、医疗费用增加等,给患者造成极大的负担[3]。有研究指出,抗生素在动物养殖领域大规模应用导致细菌耐药性增加,也加速了耐药菌株在动物与人群中的传播[4]。在山东省,非养殖地区农村居民中该菌检出率为42%[5];某生猪养殖县农村居民中检出率则高达81.3%[6]。因此,本研究对该生猪养殖县农村地区产ESBLs大肠埃希菌进行耐药性和分子分型分析,旨在为该地区对耐药菌的预防与控制提供理论依据。
材料与方法1.研究材料:于2016年7月在山东省某生猪养殖县户数>100的农村,按照东、西、南、北的空间分布随机抽取12个农村,每村随机抽取65户,每户采集1人新鲜粪便。调查对象需满足条件:年龄≥18周岁;在该地区居住≥6个月;具有正常理解与交流能力;排除从事抗菌药相关行业人员,如村医和兽医。从新鲜粪便样本中分离得到产ESBLs大肠埃希菌611株,每村随机选取30株共360株进行研究。
2.实验室检测:
(1) 耐药性分析:①药物敏感性检测:根据美国临床和实验室标准协会(CLSI) M100-S27标准,使用琼脂稀释法进行抗菌药物敏感性试验。检测的抗菌药物包括阿莫西林/克拉维酸、哌拉西林/他唑巴坦、头孢噻肟、头孢西丁、美罗培南、庆大霉素、阿米卡星、复方新诺明、磷霉素、环丙沙星、呋喃妥因、替加环素、四环素和氟苯尼考。抗菌药物折点值均参照CLSI M100-S27标准,由于CLSI未给出替加环素标准,其折点值参照欧盟药敏试验标准EUCAST 2017。②β-内酰胺酶基因型检测:使用普通PCR检测blaCTX-M、blaSHV和blaTEM三种常见β-内酰胺酶基因型,对blaCTX-M型菌株进一步进行检测,确认是否为CTX-M-1组和CTX-M-9组。引物序列见表 1。
(2) 多位点序列分型(Multilocus sequence typing,MLST):使用天根生化科技(北京)有限公司DNA提取试剂盒提取核酸,参考MLST网站(https://pubmlst.org/)对目标菌进行分子分型实验,对大肠埃希菌7个管家基因adk、fumC、gyrB、icd、mdh、purA和recA进行PCR扩增,扩增引物见表 2。25 μl反应体系:12.5 μl Taq Green PCR Master Mix聚合酶,1 μl正向引物,1 μl反向引物,9.5 μl无菌水和基因组DNA模板1 μl。PCR扩增条件:5 ℃预变性2 min;95 ℃变性1 min,退火1 min(各基因的退火温度见表 1),72 ℃延伸2 min,35个循环;72 ℃再延伸5 min。扩增结束后,PCR产物由生工生物工程(上海)股份有限公司进行测序,应用Contig软件和CLC sequence软件拼接剪切,得到目标长度序列,上传至PubMLST国际统一数据库获得菌株ST序列型。应用eBURST v3.0软件进行聚类分析,确定大肠埃希菌不同的克隆群(clonal complexe,CC)。若7个管家基因中至少有6个是相同的,就被认为是同一个克隆群,在遗传学上具有一定的相关性又同时存在序列差异[10]。每个克隆群都有一个经软件推测认定的原始ST型(Founder ST),以该ST型序号命名克隆群序号。
3.统计学分析:应用SPSS 25.0软件对β-内酰胺酶基因型与耐药表型之间的关联进行分析,检验水准α=0.05,双侧检验。
结果1.耐药性分析:
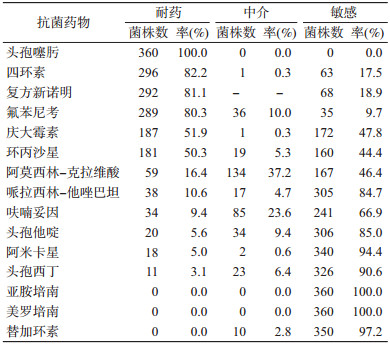
(1) 抗菌药物敏感性检测:产ESBLs大肠埃希菌对头孢噻肟、四环素、复方新诺明及氟苯尼考的耐药率较高,分别为100.0% (360/360)、82.2% (296/360)、81.1% (292/360)、80.3% (289/360);对亚胺培南、美罗培南、替加环素、头孢西丁的耐药率较低,均低于5.0%。见表 3。317株耐≥3类药物,多重耐药率为86.9%。氟苯尼考作为动物专用药,未计入统计范围。
(2)β-内酰胺酶基因型检测:CTX-M阳性菌株357株(99.2%),其中CTX-M-9组占35.6%(128/360),CTX-M-1组占24.4%(88/360);TEM阳性菌株97株(26.9%);SHV阳性菌株4株(1.1%)。
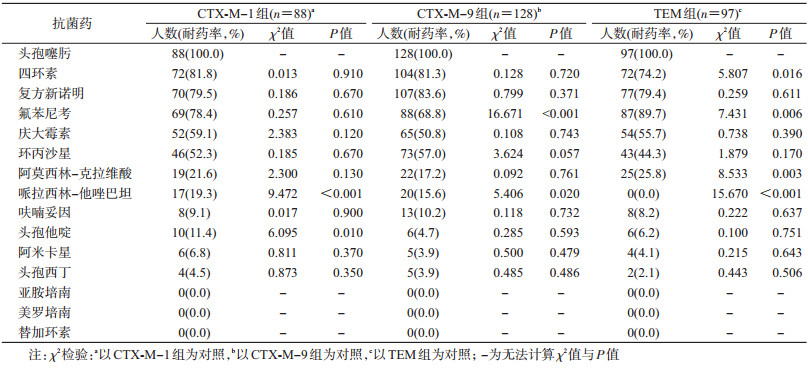
(3) β-内酰胺酶基因型与耐药表型的关联分析:对含有β-内酰胺酶基因型CTX-M-1组、CTX-M-9组、TEM分别进行15种药物的耐药率的比较。CTX-M-1组基因型菌株,对哌拉西林-他唑巴坦(χ2=9.472,P<0.001)、头孢他啶(χ2=6.095,P=0.010)的耐药率较高;CTX-M-9组基因型对氟苯尼考的耐药率较低(χ2=16.671,P<0.001),对哌拉西林-他唑巴坦的耐药率较高(χ2=5.406,P=0.020);TEM基因型对四环素(χ2=5.807,P=0.016)、哌拉西林-他唑巴坦(χ2=15.670,P<0.001)的耐药率较低,对氟苯尼考(χ2=7.431,P=0.006)、阿莫西林-克拉维酸(χ2=8.533,P=0.003)的耐药率较高。见表 4。
2. MLST分析:360株产ESBLs大肠埃希菌共检出132个ST型,其中115个是已知ST型,另外发现17个未在数据库中比对成功的新的ST型。ST10为本研究中最主要的ST型,占12.5%(45/360);其次ST38型有18株,ST48型有16株,ST46、ST6338型各有11株,ST206型有10株;其他ST型均有10株以下菌株数对应。经eBURST v3.0软件分析,部分试验菌株形成14个克隆群,CC10为本研究最主要的克隆群,包括39个ST型(主要为ST10、ST48、ST46等),共148株,占41.1%(数据未展示)。
讨论随着以头孢噻肟为代表的三代头孢菌素的广泛使用,社区健康人群携带产ESBLs菌株比例日益增加。本研究检测了山东省某生猪养殖县农村地区360株产ESBLs大肠埃希菌对常见抗菌药敏感性及β-内酰胺酶基因型,分析二者之间的关系;同时进行MLST分子分型研究,分析该地区耐药菌可能存在的传播模式,以期为指导抗生素的使用和控制耐药菌的传播提供参考。
抗菌药物敏感性检测结果显示,该地区产ESBLs大肠埃希菌对头孢噻肟、四环素、复方新诺明、氟苯尼考具有较高耐药性,且多重耐药情况严重,与既往研究结果一致[2, 6, 11]。提示该地区应加强这几类抗菌药物管控,降低多重耐药菌株的比例,防止超级耐药细菌的发生。
检测β-内酰胺酶基因型发现,产ESBLs大肠埃希菌的基因型与耐药表型存在一定的关联性。以CTX-M-9组、CTX-M-1组为主的CTX-M基因型为该地区最主要的β-内酰胺酶基因型。其中,CTX- M-9组基因型大肠埃希菌对氟苯尼考的耐药率较低,分析可能与含有氟苯尼考抗菌药物耐药基因有关;CTX-M-1组基因型菌株对头孢他啶的耐药率较高,与Wang等[12]研究上海华山医院分离出的155株产ESBLs大肠埃希菌结果一致。此外,本地区还检测出了97株TEM基因型。2013年的1项研究结果显示,Pa/Pb启动子能调控TEM-1β内酰胺酶的高表达,使细菌对阿莫西林-克拉维酸、哌拉西林-他唑巴坦等含酶抑制剂抗菌药物产生较高耐药性[13],在本研究中,TEM基因型菌株对阿莫西林-克拉维酸有更高的耐药性,对哌拉西林-他唑巴坦有较低的耐药性,分析可能与TEM亚型和含有的具体抗菌药物耐药基因不同有关。
本研究中360株产ESBLs大肠埃希菌检测出132种ST型,用eBURST v3.0软件聚类分析显示,CC10为相对优势克隆群,包含39个ST型,共148株,占41.1%,提示目标菌有一定的聚集性,它们之间的亲缘关系相对较近,存在克隆传播的可能。有研究证明,编码ESBLs的基因位于质粒上,常与其他耐药基因同时存在,能够通过接合、转化、转导等形式在细菌间扩散,从而导致耐药性的传播[14]。根据报道,CC10是一种常见于牲畜中菌株的克隆群,在我国西北部甘肃等3省规模化养猪场健康猪群[15]、我国台湾中南部地区腹泻仔猪[16]、葡萄牙中部地区屠宰场健康猪群[17]、丹麦农场健康猪群[18]、以色列奶牛场[19]分离出的产ESBLs大肠埃希菌中均为主要流行克隆群亚型。本研究地区以家庭养殖散养户为主,居民与养殖动物接触密切,2017年针对该地区的一项研究发现,养殖户的养猪废弃物及其周边环境样本中检测出CC10且为相对优势克隆群[20],提示该地区可能存在动物与人类之间的传播。
综上所述,今后本地区对头孢噻肟、四环素、复方新诺明、氟苯尼考的用药需更谨慎,而亚胺培南、美罗培南、替加环素尚未在该地区产生耐药性,可继续用于抗感染治疗。同时要重视农村养殖区的卫生环境,妥善处理好养殖废弃物,减少耐药菌在动物与人类之间传播的可能性。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
胡付品, 郭燕, 朱德妹, 等. 2017年CHINET中国细菌耐药性监测[J]. 中国感染与化疗杂志, 2018, 18(3): 241-251. Hu FP, Guo Y, Zhu DM, et al. Antimicrobial resistance profile of clinical isolates in hospitals across China:report from the CHINET Surveillance Program, 2017[J]. Chin J Infect Chemother, 2018, 18(3): 241-251. DOI:10.16718/j.1009-7708.2018.03.001 |
| [2] |
李耘, 吕媛, 郑波, 等. 中国细菌耐药监测研究2015-2016革兰氏阴性菌监测报告[J]. 中国临床药理学杂志, 2017, 33(23): 2521-2542. Li Y, Lv Y, Zheng B, et al. Antimicrobial susceptibility of Gram-negative organisms:results from China antimicrobial resistance surveillance trial program, 2015-2016[J]. Chin J Clin Pharmacol, 2017, 33(23): 2521-2542. DOI:10.13699/j.cnki.1001-6821.2017.23.056 |
| [3] |
Lee SY, Kotapati S, Kuti JL, et al. Impact of extended-spectrum β-lactamase-producing Escherichia coli and Klebsiella species on clinical outcomes and hospital costs:a matched cohort study[J]. Infect Control Hosp Epidemiol, 2006, 27(11): 1226-1232. DOI:10.1086/507962 |
| [4] |
王军, 李景云, 瞿秀, 等. 山区某养鸡场内鸡和周边人群肠道中大肠埃希菌耐药性研究[J]. 中华预防医学杂志, 2008, 42(4): 281-282. Wang J, Li JY, Qu X, et al. Resistance study of intestinal escherichia coli in chickens and surrounding people in a chicken farm in mountainous area[J]. Chin J Prev Med, 2008, 42(4): 281-282. DOI:10.3321/j.issn:0253-9624.2008.04.018 |
| [5] |
Sun Q, Tärnberg M, Zhao L, et al. Varying high levels of faecal carriage of extended-spectrum beta-lactamase producing Enterobacteriaceae in rural villages in Shandong, China:implications for global health[J]. PLoS One, 2014, 9(11): e113121. DOI:10.1371/journal.pone.0113121 |
| [6] |
王苗苗.山东某生猪养殖县农村居民产ESBL大肠埃希菌流行现状及分子分型研究[D].济南: 山东大学, 2017. Wang MM. Prevalence and molecular typing of ESBL producing escherichia coli among rural residents in pig breeding county Shandong province[D]. Jinan: Shandong University, 2017. http://xueshu.baidu.com/s?wd=paperuri%3A%28ee05299b78b7054932cba4c553c93057%29&filter=sc_long_sign&tn=SE_xueshusource_2kduw22v&sc_vurl=http%3A%2F%2Fcdmd.cnki.com.cn%2FArticle%2FCDMD-10422-1017070516.htm&ie=utf-8&sc_us=17238959972610551833 |
| [7] |
Roschanski N, Fischer J, Guerra B, et al. Development of a multiplex real-time PCR for the rapid detection of the predominant beta-lactamase genes CTX-M, SHV, TEM and CIT-type AmpCs in Enterobacteriaceae[J]. PLoS One, 2014, 9(7): e100956. DOI:10.1371/journal.pone.0100956 |
| [8] |
Zhang J, Zheng BW, Zhao L, et al. Nationwide high prevalence of CTX-M and an increase of CTX-M-55 in Escherichia coli isolated from patients with community-onset infections in Chinese county hospitals[J]. BMC Infect Dis, 2014, 14: 659. DOI:10.1186/s12879-014-0659-0 |
| [9] |
Costa D, Poeta P, Sáenz Y, et al. Detection of Escherichia coli harbouring extended-spectrum β-lactamases of the CTX-M, TEM and SHV classes in faecal samples of wild animals in Portugal[J]. J Antimicrob Chemother, 2006, 58(6): 1311-1312. DOI:10.1093/jac/dkl415 |
| [10] |
Feil EJ, Li BC, Aanensen DM, et al. eBURST:inferring patterns of evolutionary descent among clusters of related bacterial genotypes from multilocus sequence typing data[J]. J Bacteriol, 2004, 186(5): 1518-1530. DOI:10.1128/JB.186.5.1518-1530.2004 |
| [11] |
曾莉.不同来源大肠杆菌ESBLs基因分子流行病学研究[D].广州: 华南农业大学, 2016. Zeng L. Molecular characteristics of Plasmid-Mediated ESBLs genes in Escherichia coli isolated from animals, retail meat and humans[D]. Guangzhou: South China Agricultural University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10564-1016923174.htm |
| [12] |
Wang P, Hu FP, Xiong ZZ, et al. Susceptibility of extended-spectrum-β-lactamase-producing Enterobacteriaceae according to the New CLSI breakpoints[J]. J Clin Microbiol, 2011, 49(9): 3127-3131. DOI:10.1128/JCM.00222-11 |
| [13] |
孙景勇, 王勇, 倪语星. TEM-1β内酰胺酶介导的大肠埃希菌对哌拉西林-他唑巴坦和头孢哌酮耐药机制的研究[J]. 中国感染与化疗杂志, 2013, 13(3): 167-172. Sun JY, Wang Y, Ni YX. Hyperproduction of TEM-1β-lactamase mediates the resistance of Escherichia coli to piperacillin-tazobactam and cefoperazone[J]. Chin J Infect Chemother, 2013, 13(3): 167-172. DOI:10.16718/j.1009-7708.2013.03.003 |
| [14] |
Koczura R, Mokracka J, Jabłońska L, et al. Antimicrobial resistance of integron-harboring Escherichia coli isolates from clinical samples, wastewater treatment plant and river water[J]. Sci Total Environ, 2012, 414: 680-685. DOI:10.1016/j.scitotenv.2011.10.036 |
| [15] |
白雪.猪源大肠杆菌耐药性分析及ESBLs类基因的质粒传播[D].咸阳: 西北农林科技大学, 2018. Bai X. Study on the antimicrobial resistance of escherichia coli in swine origin and the transmission of esbl genes by plasmids[D]. Xianyang: Northwest A&F University, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10712-1018955409.htm |
| [16] |
Lee WC, Yeh KS. Characteristics of extended-spectrum β-lactamase-producing Escherichia coli isolated from fecal samples of piglets with diarrhea in central and southern Taiwan in 2015[J]. BMC Vet Res, 2017, 13(1): 66. DOI:10.1186/s12917-017-0986-7 |
| [17] |
Ramos S, Silva N, Dias D, et al. Clonal diversity of ESBL-producing Escherichia coli in pigs at slaughter level in portugal[J]. Foodborne Pathog Dis, 2013, 10(1): 74-79. DOI:10.1089/fpd.2012.1173 |
| [18] |
Hammerum AM, Larsen J, Andersen VD, et al. Characterization of extended-spectrum β-lactamase (ESBL)-producing Escherichia coli obtained from Danish pigs, pig farmers and their families from farms with high or no consumption of third-or fourth-generation cephalosporins[J]. J Antimicrob Chemother, 2014, 69(10): 2650-2657. DOI:10.1093/jac/dku180 |
| [19] |
Lifshitz Z, Sturlesi N, Parizade M, et al. Distinctiveness and similarities between extended-spectrum β-lactamase-producing Escherichia coli isolated from cattle and the community in Israel[J]. Microb Drug Resist, 2018, 24(6): 868-875. DOI:10.1089/mdr.2017.0407 |
| [20] |
孙磐.家庭式猪养殖地区产ESBL大肠埃希菌耐药性及其向周边环境传播的研究[D].济南: 山东大学, 2017. Sun P. Study on the antimicrobial resistance and the dissemination to surroundings of ESBL-producing Escherichia coli in household pig breeding area[D]. Jinan: Shandong University, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10422-1017068778.htm |
 2019, Vol. 40
2019, Vol. 40