文章信息
- 卓凌云, 黄鹏, 凡豪志, 巫晶晶, 王炎, 叶翔宇, 喻荣彬.
- Zhuo Lingyun, Huang Peng, Fan Haozhi, Wu Jingjing, Wang Yan, Ye Xiangyu, Yu Rongbin.
- 江苏省某戒毒所男性吸毒人员甲状腺激素水平及影响因素研究
- Study on thyroid hormone levels and influence factors in drug users in a drug rehabilitation center in Jiangsu province
- 中华流行病学杂志, 2019, 40(9): 1134-1138
- Chinese Journal of Epidemiology, 2019, 40(9): 1134-1138
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.09.022
-
文章历史
收稿日期: 2019-01-21
毒品的滥用严重危害社会安宁和人体健康,已成为当今社会主要的公共卫生问题之一[1]。联合国发布的《2017年世界毒品问题报告》指出,2015年全球约有2.5亿人使用毒品,其中1 200万为注射毒品者。根据国家禁毒办《2017年中国毒品形势报告》显示,截至2017年底,我国约有255.3万名吸毒人员,同比增长了1.9%。毒品的长期使用不仅会使人产生依赖性,还会增加HCV/HIV感染、肝肾功能损伤、内分泌紊乱以及心血管等疾病的发生风险[2-3]。既往研究表明,毒品会导致下丘脑-垂体-甲状腺轴功能异常[4-5]。甲状腺是人体的重要内分泌器官之一,与机体新陈代谢、生长发育以及各器官系统正常活动有着密不可分的关系[6]。然而,目前关于吸毒人群甲状腺功能的研究寥寥无几。因此,本研究对江苏省某戒毒所的788名男性吸毒人员进行调查,以了解吸毒人群甲状腺激素水平及影响甲状腺功能的相关因素,以期为吸毒人群的健康教育和疾病监测等相关内容的制定提供理论依据。
对象与方法1.研究对象:选择2018年6-8月于江苏省某戒毒所接受戒毒治疗的全体吸毒人员(均为男性)为研究对象。排除年龄<18周岁及既往有甲状腺疾病的吸毒人员。所有的入选对象均被告知研究目的,并签署了知情同意书。
2.研究方法:
(1) 现场调查:本研究采用的问卷参考欧洲毒品及毒瘾监测中心(European Monitoring Centre for Drugs and Drug Addiction,EMCDDA)推荐的“针对注射吸毒人群进行生物行为调查的问卷实例(Example questionnaire for bio-behavioural surveys in people who inject drugs)”自行设计。所有研究对象均通过一对一的问卷调查,获得年龄、民族、吸毒种类以及吸食方式等信息。在问卷调查结束后,每位研究对象均被抽取10 ml的静脉血以进行甲状腺激素等指标的检测。静脉血的采集以及实验室检测均由江苏省宜兴市第三人民医院的医护人员进行。
(2) 实验室检测:HCV抗体、梅毒抗体以及HBsAg的筛查采用ELISA,参考值范围:抗-HCV和梅毒抗体的S/CO值,0~1;HBsAg的S/CO值,0~0.5。血清促甲状腺激素(TSH)、游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、三碘甲状腺原氨酸(T3)以及甲状腺素(T4)水平采用全自动电化学发光免疫分析仪与配套的试剂进行检测,参考值范围:T3,0.66~1.61 ng/ml;T4,6.09~13.23 μg/dl;FT3,2.5~4.4 pg/ml;FT4,0.61~1.35 ng/dl;TSH,0.34~5.60 mIU/L。血糖、ALT以及AST采用罗氏全自动生化分析仪测定,参考值范围:血糖3.61~6.44 mmol/L;ALT和AST 3~50 U/L。所有的检测均按照产品说明书进行操作。各指标不在正常值范围均定义为异常。
HCV抗体阳性的样本进一步采用全自动病毒载量检测系统进行血清HCV-RNA水平的检测,血清HCV-RNA水平高于1 000 IU/ml定义为阳性。并参考中华人民共和国国家卫生和计划生育委员会发布的《丙型肝炎诊断标准(WS 213-2018)》将入选的研究对象分为3组:非HCV感染组(抗-HCV阴性,HCV-RNA阴性)、HCV自限清除组(抗-HCV阳性,HCV-RNA阴性)以及HCV慢性感染组(抗-HCV阳性,HCV-RNA阳性)。
(3) 质量控制:所有参与现场调查和实验室检测的人员必须经过统一培训,并在考核合格后才能参与调查和实验。在调查过程中,由专人对已完成的问卷进行审核。采用双轨录入的方式进行问卷的录入。
3.统计学方法:采用EpiData 3.0软件进行数据录入,并建立数据库。采用Stata 14.0软件进行统计学分析。计量变量采用x±s或M(P25~P75)进行描述,t检验或秩和检验进行分析;计数资料采用百分比(%)进行描述,χ2检验、校正χ2检验或Fisher’s确切概率法进行分析。采用多因素logistic回归进一步的分析影响甲状腺激素水平的相关因素。采用Spearman秩相关检验进行血清HCV-RNA水平和激素水平之间的相关性分析。所有的检验均为双侧检验,以P<0.05为差异有统计学意义。
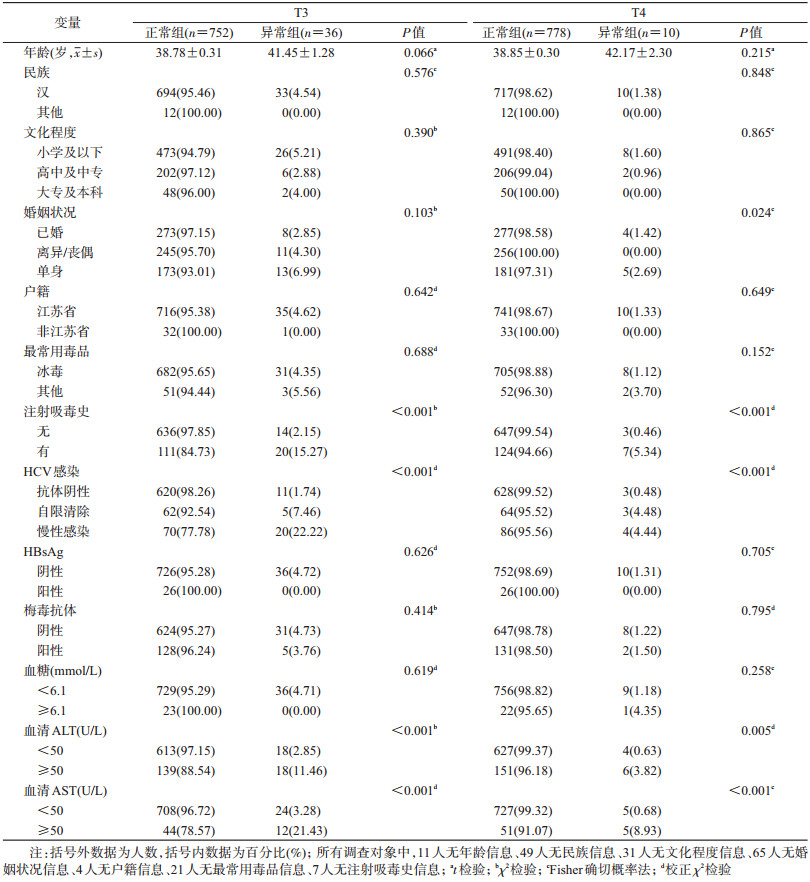
结果1.基本情况:2018年6-8月江苏省某戒毒所共收治803名吸毒对象,其中有15名患者未参加问卷调查及采血而被排除,最终纳入788名研究对象。该戒毒所均为男性,来自全国14个行政单位,95.34%(751/784)为江苏省户籍;年龄(38.90±0.30)岁,最大年龄为66岁,最小年龄为21岁。95.79%(751/784)最常用毒品为冰毒,16.77%(131/781)有注射吸毒史。
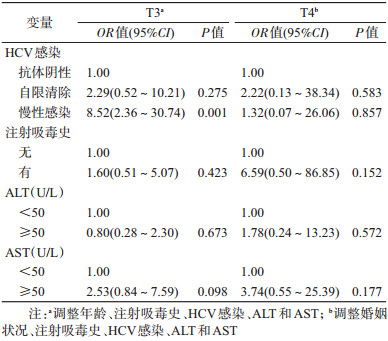
2.吸毒人群甲状腺相关激素异常率分析:788名男性吸毒人员中,5项甲状腺相关激素T3、T4、FT3、FT4以及TSH的异常率分别为4.57%(36/788,95%CI:3.22%~6.27%)、1.27%(10/788,95%CI:0.61%~2.32%)、0.51%(4/788,95%CI:0.14%~1.29%)、0.38%(3/788,95%CI:0.07%~1.11%)和0.89%(7/788,95%CI:0.36%~1.82%)。进一步对异常率较高的T3和T4进行分层描述并进行相关因素的单因素分析(表 1),结果显示,T3和T4异常率在有注射吸毒史(15.27% vs. 5.34%)、HCV感染(自限清除:7.46% vs. 4.48%;慢性感染:22.22% vs. 4.44%)、血清ALT(11.46% vs. 3.82%)及AST(21.43% vs. 8.93%)水平>50 U/L的吸毒人群中较高。将单因素检验P<0.1的因素纳入多因素logistic回归模型进行调整(表 2),结果显示HCV感染是吸毒人群发生T3异常的影响因素(OR=8.52,95%CI:2.36~30.74,P=0.001)。
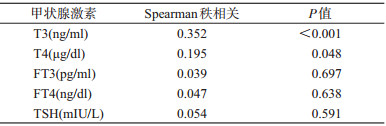
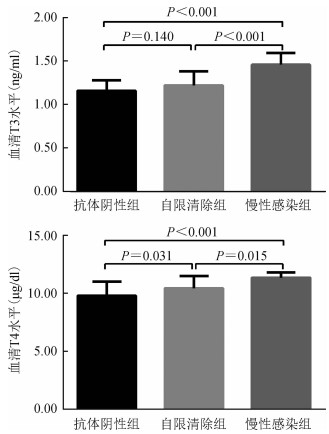
3.不同HCV感染状况人群甲状腺相关激素分泌水平比较:为进一步探讨HCV感染对甲状腺相关激素水平的影响,根据HCV抗体和HCV-RNA的检测结果对788名男性吸毒人员进行分组,包括631名非感染者,67名自限清除患者以及90名持续感染者。Kruskal-Wallis检验结果显示,3组人群的血清T3和T4差异有统计学意义(P<0.001)(表 3)。进一步采用Nemenyi法进行两两比较发现,慢性感染组的血清T3、T4水平高于其他两组;自限清除组的血清T3水平与阴性组差异无统计学意义,但血清T4水平高于阴性组(图 1)。此外,Spearman秩相关检验结果,显示仅血清T3(P<0.001)和T4(P=0.048)水平与HCV病毒载量之间存在相关关系(表 4)。
|
| 图 1 3组人群血清T3和T4水平比较 |
甲状腺激素在维持机体的生长发育及调节机体新陈代谢等方面具有重要的作用,其分泌受下丘脑-垂体-甲状腺轴及血浆激素水平的双重调节[6]。既往研究表明,甲基苯丙胺(冰毒)、大麻及阿片类药物等毒品均能对甲状腺功能产生影响,可表现为甲状腺功能亢进或减退[4, 7-10]。本研究调查了江苏省某戒毒所男性吸毒人员甲状腺激素异常情况及相关影响因素,发现男性吸毒人群血清T3水平的异常率高于其他4项指标,且HCV感染是导致T3异常最主要的原因。
既往研究多聚焦于HCV感染者接受治疗后由药物所致的甲状腺相关激素异常[11-13],关于HCV感染造成的甲状腺功能异常的研究相对较少。2014年,Mao等[14]发现我国华东地区丙型肝炎(丙肝)患者的甲状腺功能的异常率约20.7%。本研究在吸毒人群中发现,未接受过治疗的丙肝患者中,HCV感染可致甲状腺功能异常。其主要致病机制包括[15-19],HCV侵入人体后,机体的免疫系统被激活诱导细胞因子的释放,并通过“旁路途径”引发甲状腺炎症并造成甲状腺组织的损伤和激素的分泌异常;甲状腺也可以作为HCV复制的肝外储库,感染甲状腺的HCV有助于甲状腺自身免疫的发生;而与机体自身蛋白间存在相似结构的病毒蛋白使机体对自身抗原产生交叉免疫反应从而产生自身抗体,也会造成甲状腺组织的损伤;另外遗传易感性也是可能的机制。因此,应将甲状腺相关知识加入吸毒人群的健康教育中,并且加强对HCV感染的男性吸毒人员进行甲状腺功能的监测。
本研究的3组人群5种激素的中位水平均处于正常值范围内,但是仍存在明显的组间差异,与张健等[20]研究结果相似。HCV感染是一个高度复杂的疾病,会造成甲状腺功能和肝功能的异常[14, 21-22]。肝脏作为甲状腺激素灭活的主要器官及蛋白的合成场所,其功能影响着血清甲状腺激素和蛋白水平。此外,甲状腺功能异常也影响着肝脏功能[23]。这些因素的相互作用可能是引起血液中5种激素紊乱的原因,但机制尚未明确。以往研究还发现,HCV-RNA表达水平越高的丙肝患者发生甲状腺功能异常的概率越大[14]。本研究发现血清T3水平随着HCV病毒载量升高而升高。高HCV-RNA水平增强了HCV的免疫原性,从而引发更严重的甲状腺功能异常并使得患者体内的甲状腺激素升高的程度增加,提示应积极的进行抗病毒治疗以防止疾病进一步的发展,降低甲状腺相关疾病的发生。
本研究存在局限性。首先,本研究未设置健康对照,仅对吸毒人群甲状腺异常情况进行了现况调查,无法得知吸毒人群甲状腺功能异常率是否高于普通人群。因此,应进一步进行相关的研究以明确吸毒行为与甲状腺功能、甲状腺功能与丙肝之间的关系;其次,研究纳入丙肝患者的感染时间未知,感染时间较长者其肝功能及甲状腺功能异常的概率加大,故易对最终结果造成一定的影响;最后,本研究仅涉及一所戒毒所且该戒毒所的所有吸毒人员均为男性,无法代表女性吸毒人群及全体吸毒人群的异常情况,应进一步开展多中心的研究。
综上所述,HCV感染是血清甲状腺水平的影响因素之一。慢性感染HCV的男性吸毒人群的血清T3水平高于抗体阴性组和自限清除组,且异常情况可能随着HCV病毒载量的升高而加重。因此,在对吸毒人群进行行为干预时,应将甲状腺疾病的相关知识纳入吸毒(尤其是HCV感染)的人群健康教育内容中,以提高吸毒人员对甲状腺疾病的认识;定期对HCV感染的吸毒人员进行甲状腺功能的监测,以便及早发现功能异常者并采取相应的防治措施。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Sun HQ, Bao YP, Zhou SJ, et al. The new pattern of drug abuse in China[J]. Curr Opin Psychiatry, 2014, 27(4): 251-255. DOI:10.1097/YCO.0000000000000073 |
| [2] |
Hser YI, Liang D, Lan YC, et al. Drug Abuse, HIV, and HCV in Asian Countries[J]. J Neuroimmune Pharmacol, 2016, 11(3): 383-393. DOI:10.1007/s11481-016-9665-x |
| [3] |
李坤陶. 毒品的种类及危害[J]. 生物学通报, 2007, 42(5): 11-13. Li KT. Types and harms of drugs[J]. Bulletin Biological, 2007, 42(5): 11-13. DOI:10.3969/j.issn.0006-3193.2007.05.005 |
| [4] |
Li SX, Yan SY, Bao YP, et al. Depression and alterations in hypothalamic-pituitary-adrenal and hypothalamic-pituitary-thyroid axis function in male abstinent methamphetamine abusers[J]. Hum Psychopharmacol, 2013, 28(5): 477-483. DOI:10.1002/hup.2335 |
| [5] |
Carrico AW, Rodriguez VJ, Jones DL, et al. Short circuit:disaggregation of adrenocorticotropic hormone and cortisol levels in HIV-positive, methamphetamine-using men who have sex with men[J]. Hum Psychopharmacol, 2018, 33(1): e2645. DOI:10.1002/hup.2645 |
| [6] |
Mondal S, Raja K, Schweizer U, et al. Chemistry and biology in the biosynthesis and action of thyroid hormones[J]. Angew Chem Int Ed, 2016, 55(27): 7606-7630. DOI:10.1002/anie.201601116 |
| [7] |
Jones DL, Carrico AW, Babayigit S, et al. Methamphetamine-associated dysregulation of the hypothalamic-pituitary-thyroid axis[J]. J Behav Med, 2018, 41(6): 792-797. DOI:10.1007/s10865-018-9935-6 |
| [8] |
Malhotra S, Heptulla RA, Homel P, et al. Effect of Marijuana Use on Thyroid Function and Autoimmunity[J]. Thyroid, 2017, 27(2): 167-173. DOI:10.1089/thy.2016.0197 |
| [9] |
Zhou BY, Yan SY, Shi WL, et al. Serum proteomic analysis reveals high frequency of haptoglobin deficiency and elevated thyroxine level in heroin addicts[J]. PLoS One, 2014, 9(4): e95345. DOI:10.1371/journal.pone.0095345 |
| [10] |
Gozashti MH, Mohammadzadeh E, Divsalar K, et al. The effect of opium addiction on thyroid function tests[J]. J Diabetes Metab Disord, 2014, 13(1): 5. DOI:10.1186/2251-6581-13-5 |
| [11] |
Costelloe SJ, Wassef N, Schulz J, et al. Thyroid dysfunction in a UK hepatitis C population treated with interferon-α and ribavirin combination therapy[J]. Clin Endocrinol (Oxf), 2010, 73(2): 249-256. DOI:10.1111/j.1365-2265.2010.03785.x |
| [12] |
Liu CJ, Chu YT, Shau WY, et al. Treatment of patients with dual hepatitis C and B by peginterferon α and ribavirin reduced risk of hepatocellular carcinoma and mortality[J]. Gut, 2014, 63(3): 506-514. DOI:10.1136/gutjnl-2012-304370 |
| [13] |
Nair Kesavachandran C, Haamann F, Nienhaus A. Frequency of thyroid dysfunctions during interferon alpha treatment of single and combination therapy in hepatitis C virus-infected patients:a systematic review based analysis[J]. PLoS One, 2013, 8(2): e55364. DOI:10.1371/journal.pone.0055364 |
| [14] |
Mao XR, Zhang LT, Chen H, et al. Possible factors affecting thyroid dysfunction in hepatitis C virus-infected untreated patients[J]. Exp Ther Med, 2014, 8(1): 133-140. DOI:10.3892/etm.2014.1709 |
| [15] |
Pastore F, Martocchia A, Stefanelli M, et al. Hepatitis C virus infection and thyroid autoimmune disorders:a model of interactions between the host and the environment[J]. World J Hepatol, 2016, 8(2): 83-91. DOI:10.4254/wjh.v8.i2.83 |
| [16] |
刘亚洲, 孟庆华. 丙型肝炎病毒相关甲状腺功能障碍发病机制与临床治疗研究进展[J]. 中华临床感染病杂志, 2014, 7(3): 271-276. Liu YZ, Meng QH. Advances in pathogenesis and management of hepatitis C virus-related thyroid dysfunction[J]. Chin J Clin Infect Dis, 2014, 7(3): 271-276. DOI:10.3760/cma.j.issn.1674-2397.2014.03.023 |
| [17] |
陈芳, 涂相林. 肝脏疾病与甲状腺功能状态[J]. 世界华人消化杂志, 2017, 25(28): 2503-2509. Chen F, Tu XL. Liver diseases and thyroid functional status[J]. World Chin J Digestol, 2017, 25(28): 2503-2509. |
| [18] |
Blackard JT, Kong L, Huber AK, et al. Hepatitis C virus infection of a thyroid cell line:implications for pathogenesis of hepatitis C virus and thyroiditis[J]. Thyroid, 2013, 23(7): 863-870. DOI:10.1089/thy.2012.0507 |
| [19] |
Porcu E, Medici M, Pistis G, et al. A Meta-analysis of thyroid-related traits reveals novel loci and gender-specific differences in the regulation of thyroid function[J]. PLoS Genet, 2013, 9(2): e1003266. DOI:10.1371/journal.pgen.1003266 |
| [20] |
张健, 王晓英, 陈淑华, 等. 甲状腺激素在慢性丙型肝炎患者中的表达水平及临床意义[J]. 中国实用医刊, 2018, 45(4): 45-47. Zhang J, Wang XY, Chen SH, et al. Clinical significance and expression of thyroid hormones in patients with chronic hepatitis C[J]. Chin J Pract Med, 2018, 45(4): 45-47. DOI:10.3760/cma.j.issn.1674-4756.2018.04.014 |
| [21] |
柳静文, 郝英霞, 高广周. 慢性HCV感染的肝外表现研究进展[J]. 临床肝胆病杂志, 2018, 34(7): 1538-1542. Liu JW, Hao YX, Gao GZ. Research advances in extrahepatic manifestations of chronic hepatitis C virus infection[J]. J Clin Hepatol, 2018, 34(7): 1538-1542. DOI:10.3969/j.issn.1001-5256.2018.07.037 |
| [22] |
王文俊, 杨颖, 党双锁. HCV肝外表现研究现状[J]. 肝脏, 2018, 23(1): 6-8. Wang WJ, Yang Y, Dang SS. Research status on extrahepatic manifestations of HCV[J]. Chin Hepatology, 2018, 23(1): 6-8. DOI:10.3969/j.issn.1008-1704.2018.01.003 |
| [23] |
Wang RF, Tan J, Zhang GZ, et al. Risk factors of hepatic dysfunction in patients with Graves' hyperthyroidism and the efficacy of 131iodine treatment[J]. Medicine (Baltimore), 2017, 96(5): e6035. DOI:10.1097/MD.0000000000006035 |
 2019, Vol. 40
2019, Vol. 40